2-甲基-6-硝基苯胺的合成及表征
周石洋,陈 玲
2-甲基-6-硝基苯胺的合成及表征
*周石洋1,陈 玲2
(1. 重庆牧哥食品有限公司,重庆 401520;2.西南大学育才学院,重庆 401524)
以邻硝基苯胺为原料,经乙酰化、甲基化、水解三步反应合成得到了目标产物2-甲基-6-硝基苯胺,并采用IR、1H NMR和13C NMR对产物结构进行了表征。探讨了乙酰化反应时催化剂AlCl3用量、反应温度、反应时间和乙酸酐的滴加速率对邻硝基乙酰苯胺产率的影响,以及甲基化反应中催化剂AlCl3用量、反应温度、反应时间和硫酸二甲酯的滴加速率对产物产率的影响。在最佳合成条件下,2-甲基-6-硝基苯胺的产率可达93.9%。
邻硝基苯胺;乙酰化;甲基化;水解;2-甲基-6-硝基苯胺
2-甲基-6-硝基苯胺是重要的染料中间体和化工中间体,主要用于有机合成,是油漆、制药、印染等重要的原材料,也是混合炸药的重要成分之一[1-3]。国内外曾有2-甲基-6-硝基苯胺合成方法的报道,祁磊等人采用邻甲基苯胺为原料,改进乙酰化和硝化反应合成2-甲基-6-硝基苯胺,产率仅为59.4%,纯度99.68%[4];王雅珍同样也采用邻甲基苯胺为原料,经冰乙酸酰化、硝化等步骤合成2-甲基-4(6)-硝基苯胺,总产率仅为72.0%[5]。但目前工业化生产中常用用邻甲基乙酰苯胺经硝化[6],得到硝基邻甲基乙酰苯胺,再与浓盐酸一起加热至沸腾,去乙酰化,蒸馏得到2-甲基-6-硝基苯胺。此种方法用到硝酸和盐酸,这些酸性物质溶于水中都是放热反应[7]。在操作过程中反应温度不容易控制,易发生爆炸等危险,并且对反应设备要求高,必须能耐酸等苛刻条件。最终合成的产物产率低约50%,纯度约96.7%[1-3],因此,不利于工业化大规模的生产[8-10]。鉴于常用方法有这么多不利因素,研究一种新的合成2-甲基-6-硝基苯胺方法极为重要。本研究在参考国内外相关文献[4-5]的基础耻,设计并研究出了一种新的合成方法。新方法以邻硝基苯胺为原料,经乙酰化反应、甲基化反应,最后水解得到2-甲基-6-硝基苯胺。反应步骤简单,并且用不到强酸性物质,对生产设备要求不高,温度容易控制,操作简单方便[11-13]。用该方法合成的的2-甲基-6-硝基苯胺产率高达93.9%,大大提高了产率,且产物纯度为99.6%,满足市场需求,适用于工业化大规模生产。目标产物的合成路线如下:
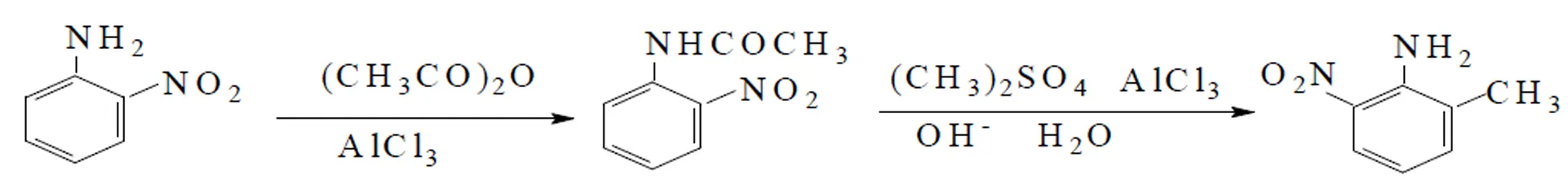
1 实验部分
1.1 仪器与试剂
ZRD-1全自动熔点仪(天津瑞来特公司);LC10AT高效液相色谱仪(日本岛津公司);IR200傅立叶红外光谱仪(美国赛默飞世尔公司);AVANCE-II 500MHz核磁共振仪(德国 Bruker 公司)。
无水AlCl3、邻硝基苯胺、乙酸酐、乙醚、硫酸二甲酯、NaOH等试剂均为分析纯。
1.2 邻硝基乙酰苯胺的合成
在250 mL三口烧瓶上,分别安装搅拌器,滴液漏斗及温度计。快速称取16.0 g经研细的无水AlCl3,放入烧瓶中,并立即加入13.8 g邻硝基苯胺和30 mL乙醚。匀速震动烧瓶,使其充分溶解。再用滴液漏斗滴加9.45 mL乙酸酐。滴完后关闭滴液漏斗旋塞,在石棉网上小火加热,在一定温度下保持缓缓回流数小时。回流完毕后,将三口烧瓶浸入冷水中,静置冷却,有橙黄色针状结晶体析出,在常温条件下抽滤,所得到的过滤物用蒸馏水洗涤三次,将粗产物烘干,保留约17.8 g粗产物。将粗产物溶于蒸馏水,加热溶液,冷却重结晶,得到纯邻硝基乙酰苯胺17.4 g,产率96.7 %,mp 74-76 ℃(文献参考值75~77℃[2]),纯度99.5%。IR(KBr,ν/cm-1):3373(仲氨中的-NH-),3092(苯环中的=C-H),1704(羰基中的-C=O),1613(苯环中的C=C),1343(硝基中的-NO2),1281(甲基中的-CH3);1H NMR(CDCl3),δ:10.30(s,1H),8.77(s,1H), 8.20(s,1H),7.66(s,1H),2.30(s,3H);13CNMR(CD3OD),δ:169.2,136.5,135.8,134.7,125.6,123.2,122.2,25.5。
1.3 2-甲基-6-硝基苯胺的合成
将上步合成的17.4 g邻硝基乙酰苯胺和30 mL乙醚加入到250 mL三口烧瓶中,快速称取16.0 g经研细的无水AlCl3,分别安装搅拌器,滴液漏斗及温度计。再在滴液漏斗中加入9.17 mL硫酸二甲酯。滴完后关闭滴液漏斗旋塞,在石棉网上小火加热,在一定温度下保持缓缓回流数小时。然后将三口烧瓶浸入冷水中,搅拌下慢慢滴加19.34 mL 20 % NaOH溶液。静置冷却,有黄色棱柱结晶体析出,在常温条件下抽滤,所得到的过滤物依次用20% NaOH溶液、蒸馏水各20 mL洗涤三次,将粗产物烘干,保留约14.5 g粗产物。将粗产物溶于蒸馏水,加热溶液,冷却重结晶,得到纯2-甲基-6-硝基苯胺14.3 g,产率97.2%,mp 95~97 ℃(文献参考值95~96 ℃[2]),纯度99.6 %。IR(KBr,ν/cm-1):3371(氨基中的-NH2),3110(苯环中的=C-H),2913苯环上的甲基-CH3),1624(苯环中的C=C),1518(硝基中的-NO2);1H NMR(CDCl3),δ:8.01(d,1H),7.23(d,1H),6.61(t,1H), 6.15(s,2H), 2.24(s,3H);13C NMR(CD3OD),δ:143.5,136.1,132.2,125.3,124.2,116.0,17.5。
2 结果与讨论
2.1 邻硝基乙酰苯胺合成
2.1.1 催化剂AlCl3用量对邻硝基乙酰苯胺产率的影响
在保持其他合成条件不变的情况下,采用(AlCl3):(乙酸酐)的摩尔比分别为1.0:1、1.1:1、1.2:1、1.3:1、1.4:1进行试验,考察了催化剂AlCl3用量对邻硝基乙酰苯胺产率的影响,结果见表1。

表 1 催化剂AlCl3用量对邻硝基乙酰苯胺产率的影响
由表1可见,当(AlCl3):(乙酸酐) = 1.2:1.0时,邻硝基乙酰苯胺的产率达到最高。催化剂AlCl3先与乙酸酐作用,再跟苯胺反应最终生成邻硝基乙酰苯胺。随着催化剂AlCl3用量的增加,邻硝基乙酰苯胺的产率不断提高。当达到1.2:1.0时,产率达到最大,随着继续增加催化剂AlCl3用量,其产率反而降低。因为过量催化剂AlCl3促进其杂质的生成,并且还能吸附乙酸酐和邻硝基乙酰苯胺,从而导致邻硝基乙酰苯胺的产率降低。如果反应过程中催化剂AlCl3用量不足,则参加反应的乙酸酐减少,合成反应不能彻底完成,导致邻硝基乙酰苯胺的产率降低。
2.1.2 反应温度对邻硝基乙酰苯胺产率的影响
反应温度关系到合成反应产率,不同反应温度产物的产率是不一样的。在保持其他合成条件不变的情况下,选择反应温度为60、70、80、90、100、110、120、130 ℃进行试验,考察了反应温度温度对邻硝基乙酰苯胺产率的影响,见图1。
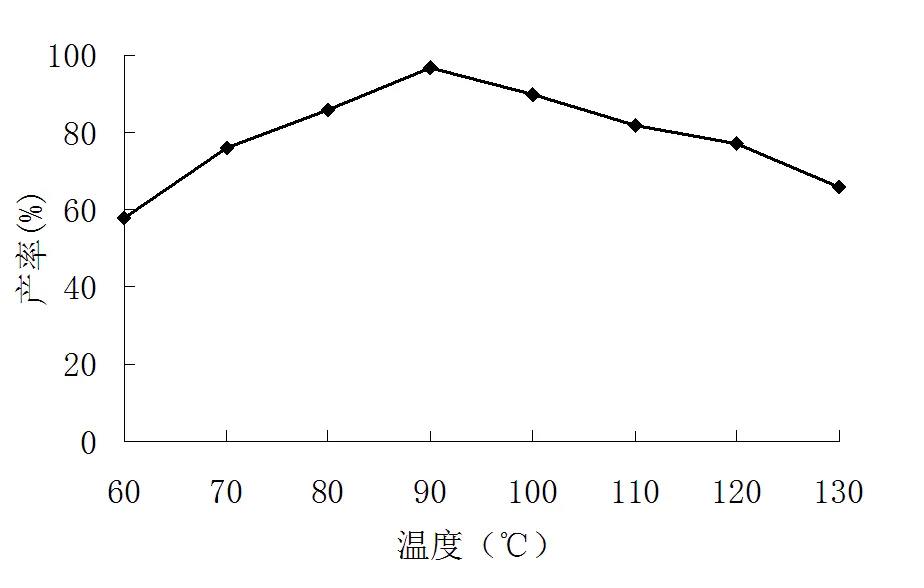
图1 反应温度对邻硝基乙酰苯胺合成产率的影响
由图1可见,反应温度在90 ℃时邻硝基乙酰苯胺的产率最高。反应温度能提高反应中活化分子数,合成邻硝基乙酰苯胺是个吸热化学反应,理论上讲反应温度越高越利于反应进行。但在现实合成中,温度越高并不利于合成反应,过高的反应温度会产生一系列副反应,如生成对位乙酰取代物等,导致产物产率下降;温度过低不能提供反应进行活化能,也会导致反应产率低。因此控制好反应温度有利于达到最优产率。
2.1.3 反应时间对邻硝基乙酰苯胺产率的影响
在保持其他合成条件不变的情况下,选择反应时间为0.5、1、1.5、2、2.5、3、3.5 h进行试验,考察了反应时间对邻硝基乙酰苯胺收率的影响,结果见图2。
由图2可见,当反应时间为2 h时,产物邻硝基乙酰苯胺产率最高,这是因为反应到2 h时其合成反应已经完全反应。当随着反应时间延长,合成反应会生成一系列副产物,如对位乙酰取代物、酸酐等物质的生成,导致邻硝基乙酰苯胺合成产率的下降;当合成反应时间偏短时,合成反应不能彻底完成,同样也导致导致合成邻硝基乙酰苯胺产率下降。反应时间跟反应温度一样,同样关系到产率的高低,因此要控制好反应时间。
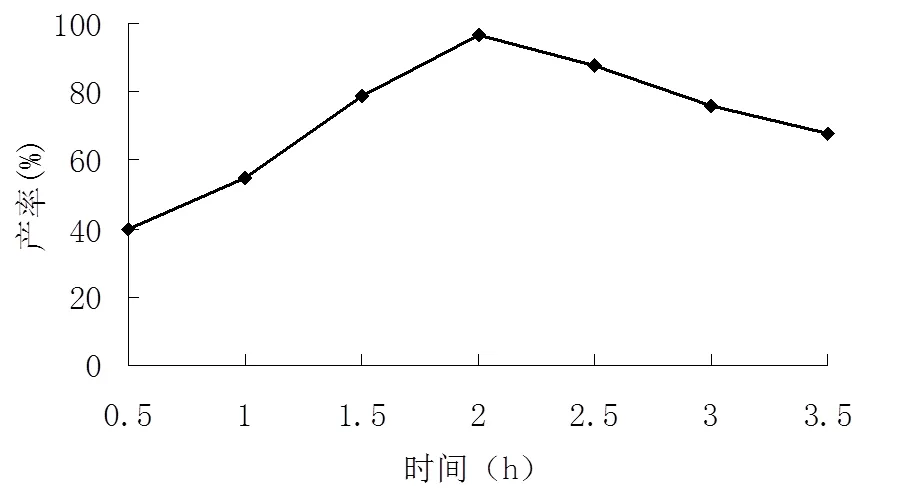
图 2 反应时间对邻硝基乙酰苯胺产率的影响
2.1.4 乙酸酐滴加速率对邻硝基乙酰苯胺产率的影响
在合成对邻硝基乙酰苯胺时,在保持其他合成条件不变的情况下,选择乙酸酐滴加速率3、4、5、6、7、8、9 mL×min-1进行试验,考察了乙酸酐滴加速率对邻硝基乙酰苯胺产率影响,结果见图3。
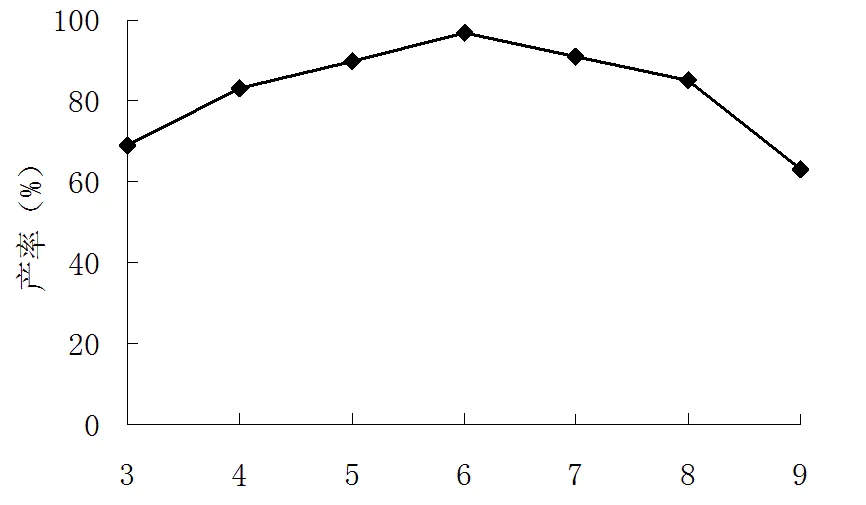
滴加速率(mL·min-1)
由图3可知,滴加乙酸酐速率为6 mL×min-1时产物产率达到最高。乙酸酐滴加速率快慢,关系到反应进行的进行程度,乙酸酐滴加的速率过快或过慢都不利用合成反应进行。如乙酸酐滴加速率过快,则溶液中乙酸酐浓度就会偏高,会发生一系列副反应,如对位乙酰取代物等生成,导致邻硝基乙酰苯胺合成的产率降低;当乙酸酐滴加速率过慢时,合成反应会不易进行,同样会导致邻硝基乙酰苯胺合成的产率偏低。
2.2 2-甲基-6-硝基苯胺的合成
2.2.1 催化剂AlCl3用量对2-甲基-6-硝基苯胺产率的影响
在保持其他合成条件不变的情况下,采用(AlCl3):(硫酸二甲酯)的摩尔比分别为1.0:1、1.1:1、1.2:1、1.3:1、1.4:1进行试验,考察催化剂AlCl3用量2-甲基-6-硝基苯胺合成产率的影响,结果见表2。

表 2 催化剂AlCl3用量对2-甲基-6-硝基苯胺产率的影响
由表2可见,当(AlCl3):(硫酸二甲酯)=1.2:1.0时,2-甲基-6-硝基苯胺的合成产率达到最高。在反应中随着催化剂用量的增加,产物产率不断增加,当比值达到1.2:1.1时产率最高,继续增加催化剂AlCl3用量,其产率降低。催化剂过多或者不足都不利于反应的进行,催化剂过量容易吸附产物不易分离产物从而导致产物产率降低。催化剂AlCl3用量不足,则参加反应的硫酸二甲酯减少,合成反应不能彻底完成,同样也导致2-甲基-6-硝基苯胺的产率降低。
2.2.2 反应温度对2-甲基-6-硝基苯胺产率的影响
在保持其他合成条件不变的情况下,选择反应温度为70、80、90、100、110、120、130 ℃进行试验,考察了反应温度温度对2-甲基-6-硝基苯胺产率的影响,结果见图4。
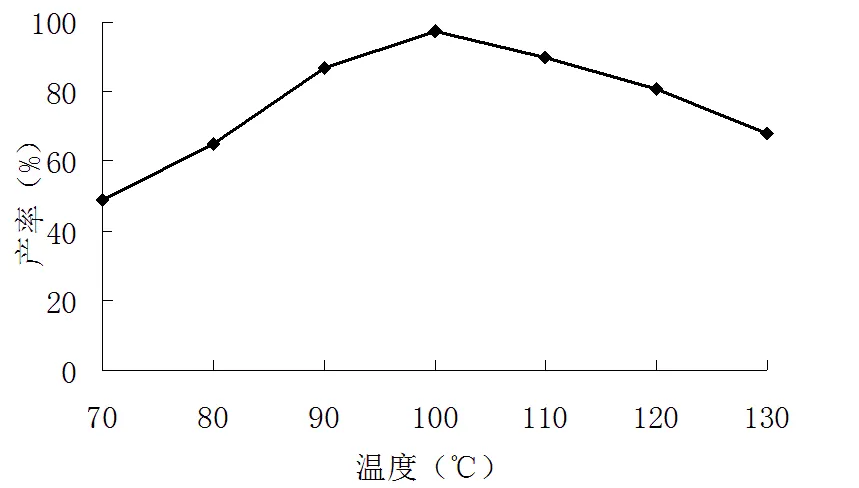
图 4 反应温度对2-甲基-6-硝基苯胺合成产率的影响
由图4可见,反应温度在100 ℃时2-甲基-6-硝基苯胺的产率最高。合成2-甲基-6-硝基苯胺同样是个吸热化学反应,反应温度越高越利于反应进行,但在现实合成中,高温并不利于合成,过高的反应温度会产生一系列副反应,如生成对位乙4酰取代物等,导致产物产率下降;温度过低不能提供反应进行活化能,同样也会导致反应产率低。
2.2.3 反应时间对2-甲基-6-硝基苯胺产率的影响
在保持其他合成条件不变的情况下,选择反应时间为1、2、3、4、5、6、7 h进行试验,考察了反应时间对对2-甲基-6-硝基苯胺合成收率的影响,结果见图5。
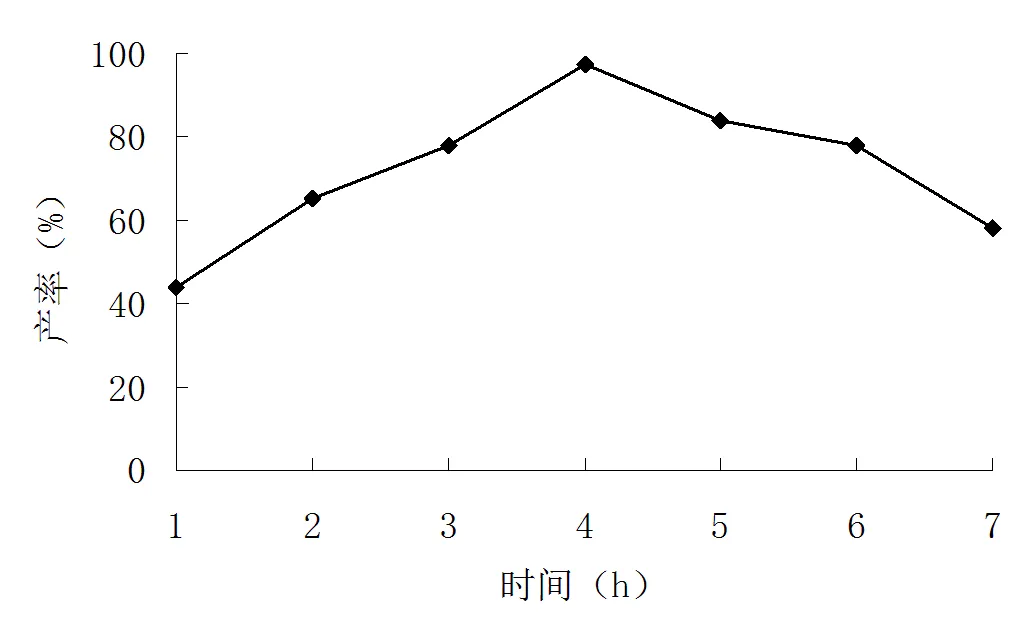
图 5 反应时间对2-甲基-6-硝基苯胺产率的影响
由图5可见,当反应时间为4 h时,产物2-甲基-6-硝基苯胺合成产率最高。当随着反应时间不断延长,合成反应同样会生成一系列副产物,如对位甲基取代物等物质的生成,导致邻2-甲基-6-硝基苯胺合成产率的下降;当合成反应时间偏短时,合成反应不能彻底完成,同样也导致导致合成2-甲基-6-硝基苯胺产率下降。
2.2.4 硫酸二甲酯滴加速率对2-甲基-6-硝基苯胺产率的影响
在合成对邻硝基乙酰苯胺时,在保持其他合成条件不变的情况下,选择硫酸二甲酯滴加速率4、5、6、7、8、9、10 mL×min-1进行试验,考察了乙酸酐滴加速率对对2-甲基-6-硝基苯胺产率影响,结果见图6。
由图6可知,滴加乙酸酐速率为7 mL×min-1时2-甲基-6-硝基苯胺产率达到最高。硫酸二甲酯滴加速率快慢,关系到2-甲基-6-硝基苯胺合成反应进行的进行程度,硫酸二甲酯滴加速率过快或过慢都不利用合成反应进行。如硫酸二甲酯滴加速率过快,则溶液中硫酸二甲酯浓度就会过高,同样会发生一系列副反应,如对位甲基取代物等生成,导致2-甲基-6-硝基苯胺合成的产率降低;当硫酸二甲酯滴加速率过慢时,2-甲基-6-硝基苯胺合成反应会不易进行,同样会导致2-甲基-6-硝基苯胺合成的产率偏低。
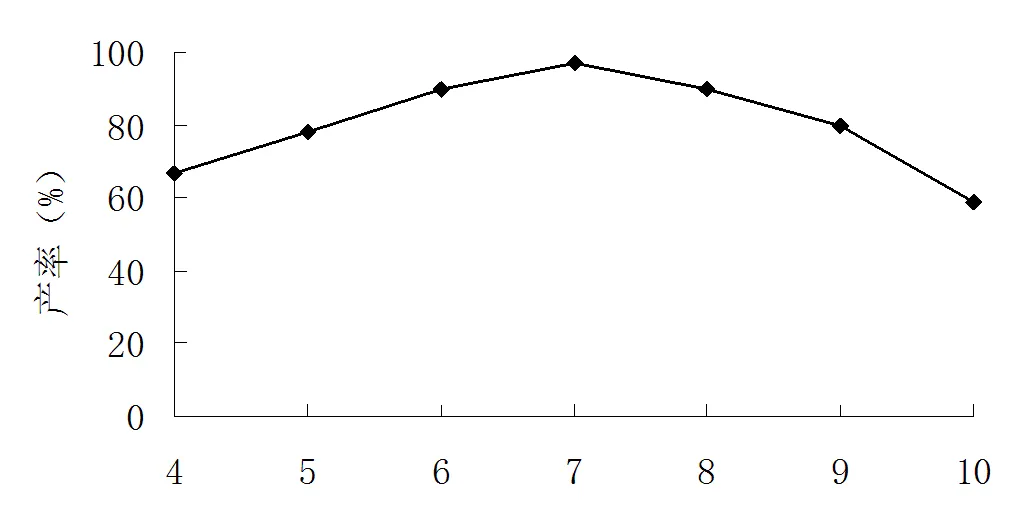
滴加速率(mL·min-1)
2.3 表征
2.3.1 邻硝基乙酰苯胺和2-甲基-6-硝基苯胺的红外谱图分析
采用IR200傅立叶红外光谱仪,通过KBr压片法对中间产物和目标产物进行红外光谱表征。其中间产物邻硝基乙酰苯胺在500~4000 cm-1区间的红外光谱图如图 7所示;目标产物2-甲基-6-硝基苯胺在500~4000 cm-1区间的红外光谱图如图 8所示。由图7可知,中间产物在3373 cm-1处的吸收峰是氨基-NH2的特性吸收峰;3092 cm-1处吸收峰是苯环中的氢=C-H,表明中间产物里有苯环结构存在;1704 cm-1处吸收峰是羰基-C=O的特性吸收峰;1613 cm-1处吸收峰是苯环C=C的特性吸收峰;1343 cm-1处吸收峰是硝基-NO2的特征吸收峰;1281 cm-1处吸收峰是甲基中-CH3的弯曲振动特征吸收峰。中间产物的红外光谱表征结果与邻硝基乙酰苯胺结构一致。由图8可知,目标产物在3371 cm-1处的吸收峰是氨基-NH2的特征吸收峰;3110 cm-1处的吸收峰是苯环中的氢=C-H,同样也表明目标产物中有苯环结构的存在;2913 cm-1处吸收峰是链接苯环上甲基-CH3的弯曲振动特征吸收峰;1624 cm-1处的吸收峰是苯环C=C的特征吸收峰;1518 cm-1处的吸收峰是硝基-NO2的特征吸收峰。目标产物的红外光谱表征结果与2-甲基-6-硝基苯胺结构一致。
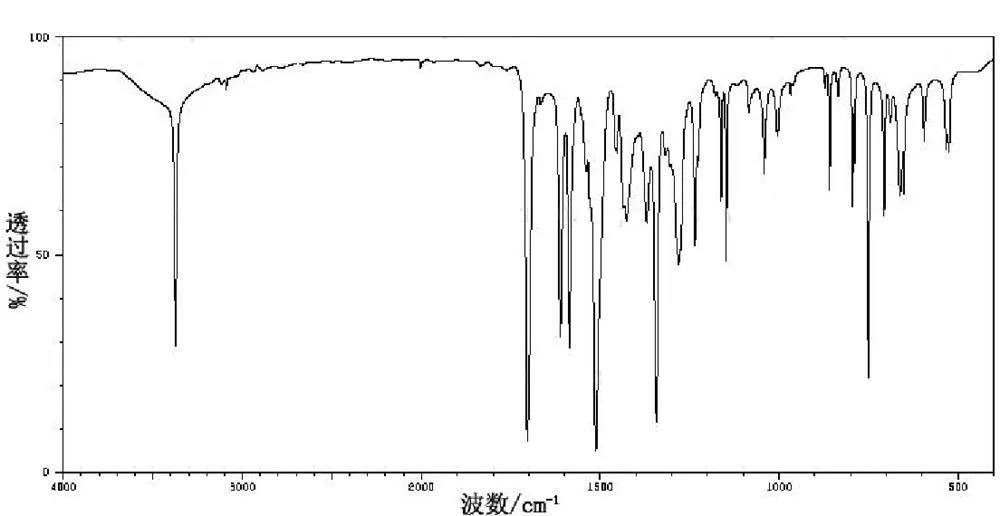
图 7 邻硝基乙酰苯胺的红外光谱
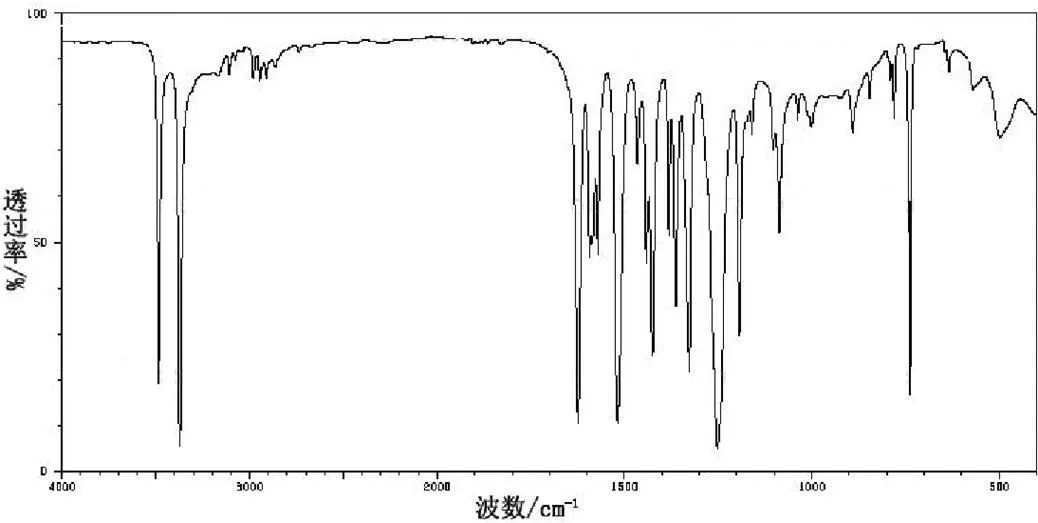
图 8 2-甲基-6-硝基苯胺的红外光谱
2.3.2 邻硝基乙酰苯胺和2-甲基-6-硝基苯胺的核磁共振图分析
采用AVANCE-II 500MHz核磁共振仪对中间产物和目标产物进行核磁共振表征。图 9所示为中间产物邻硝基乙酰苯胺1H NMR图;图10所示为目标产物2-甲基-6-硝基苯胺1H NMR图。由图9可以看出,化学位移在2.30处的吸收峰为与羰基链接的甲基质子峰;化学位移在7.66处的吸收峰为4号碳原子上质子峰;化学位移在8.20处的吸收峰为2号碳原子上质子峰;化学位移在8.77处的吸收峰为5号碳原子上的质子峰;化学位移在10.30处的吸收峰为亚氨基质子峰。由图10可以看出,化学位移在2.24处的吸收峰为2号碳原子上的质子峰;化学位移在6.15处的吸收峰为氨基质子峰;化学位移在6.61处的吸收峰为4号碳原子上的质子峰;化学位移在7.23处的吸收峰为3号碳原子上的质子峰;化学位移在8.01处的吸收峰为5号碳原子的质子峰。
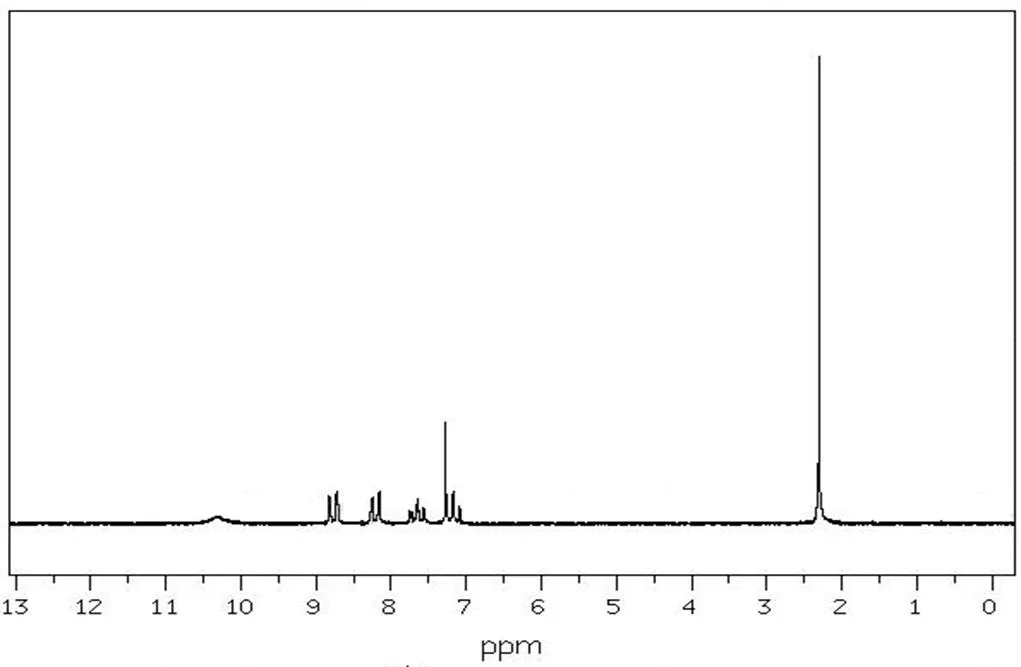
图9 邻硝基乙酰苯胺的1H NMR图
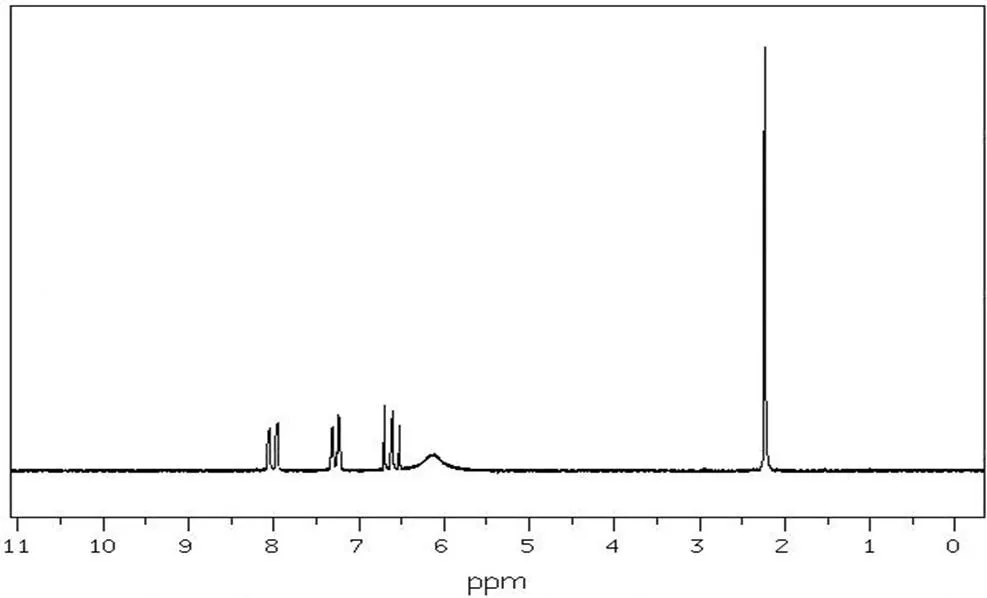
图10 2-甲基-6-硝基苯胺的1H NMR图
3 结论
以邻硝基苯胺为原料,经乙酰化、甲基化、水解三步反应合成得到了目标产物2-甲基-6-硝基苯胺,乙酰化化反应的最佳条件为:催化剂AlCl3与乙酸酐摩尔比为1.2:1.0、反应温度为9 ℃、反应时间为2 h、乙酸酐滴加速率为6 mL×min-1。甲基化反应的最佳条件为:催化剂AlCl3与硫酸二甲酯摩尔比为1.2:1.0、反应温度为100 ℃、反应时间为4 h、滴加硫酸二甲酯速率为7 mL×min-1。在最佳条件下,2-甲基-6-硝基苯胺的产率可达93.9%。
[1] 徐克勋.精细有机化工原料及中间体手册 [M].北京:化学工业出版社,1998,113-114.
[2] 北京化学试剂公司.化学试剂.精细化学品产品目录[M].北京:化学工业出版社,1999:699.
[3] 章思规,章伟.精细化学品及中间体手册[M].北京:化学工业出版社, 2004:550-552.
[4] 祁磊, 庞思平, 孙成辉. 2-甲基-6-硝基苯胺的合成工艺研究[J]. 含能材料, 2009(1):4-6+10.
[5] 王雅珍. 2-甲基-4(6)-硝基苯胺合成工艺的研究[J]. 江苏技术师范学院学报:自然科学版, 2008(3):49-53.
[6] 周石洋,陈玲,冯豫川.4-氨基苯甲酸的合成工艺研究[J].化学试剂,2013, 33(3):665-669.
[7] Anastas P T,Bartlett L B,Kirchhoff M M,et a1.The role of catalysis in the design,development,and implementation of Green Chemistry[J].Catalysis Today, 2000, 55: l1-22.
[8] 周石洋,陈玲.2,4,6-三溴-3-羟基苯甲酸的合成[J].西南民族大学学报:自然科学版,2012, 38(5):797-802.
[9] Menegheli P,Rezende M C,Zucco C.Marcos caroli rezende and cesar zucco caboxylation of arenes[J]. Synthenetic Communications,1987, 17(4):457-464.
[10] William S,Emerson W, Heyd,et al.The use of liquid phase oxidation for the preparation of nuclearly substituded styene [J]. J Am Chem Soc,1947,26(69): 1904-1906.
[11] 周石洋,陈玲.对苯二胺的合成工艺研究 [J].精细化工中间体,2013(3):57-60.
[12] Pizzio L, Vazquez P. Tungstophosphoric and molybdo- phosphoric acids supported on zirconia as esterification catalysts[J]. CatalLett,2001,77(4):233-239.
[13] 周石洋,黄坤林,陈玲. 3,4-二羟基苯甲酸乙酯合成工艺研究[J].黑龙江大学工程学报,2013, 4(2):40-45.
SYNTHESIS AND CHARACTERIZATION OF 2-METHYL-6-NITROANILINE
*ZHOU Shi-yang, CHEN Ling
(1. Chong Qing Mu Ge Food Co., Ltd. Chongqing, 401520 China;2. YuCai College, Southwest University, Chongqing, 401524, China )
Using o-nitroaniline as raw material, through acetylation, methylation, hydrolysis reactions, the target compound 2-methyl-6-nitroaniline was synthesized and characterized by IR,1H NMR and13C NMR. Both in the acetylation and methylation reaction, the influence of dosage of catalyst AlCl3, reaction temperature, reaction time, and adding rate of acetic anhydride in the former and adding rate of dimethyl sulfate in the latter were investigated. Under the optimal conditions, the yield of 2-methyl-6-nitroaniline was 93.9%.
o-nitroaniline; acetylation; methylation; hydrolysis; 2-methyl-6-nitroaniline
1674-8085(2014)01-0033-06
O625.63
A
10.3969/j.issn.1674-8085.2014.01.007
2013-09-17;
2013-12-17
*周石洋(1986-),男,湖南怀化人,工程师,硕士,主要从事有机合成研究(E-mail:zhoushiyang520@126.com);
陈 玲(1990-),女,重庆市人,西南大学育才学院本科生(E-mail:290401198@qq.com).

