基于右旋糖酐蔗糖酶转糖基作用的槲皮素葡萄糖苷的合成研究
任 亮, 张洪斌, 胡雪芹, 牛博艺
(合肥工业大学 制药工程系, 合肥 230009)
右旋糖酐蔗糖酶(Dextransucrase,EC2.4.5.1)是一种由肠膜状明串珠菌(Leuconstocmesenteriodes)和口腔链球菌(oralstrepotococcus)产生的葡萄糖基转移酶(glucosyltransferases)[1]。该酶属于糖苷水解酶第70家族(Family 70),是葡聚糖蔗糖酶领域中研究较早较热门的一类酶[2]。右旋糖酐蔗糖酶以蔗糖为底物[3],将蔗糖分子中D-葡萄糖基催化转移到受体分子。右旋糖酐蔗糖酶可以催化2种反应,一种是形成右旋糖酐,另一种是受体的糖基化反应[4]。
利用右旋糖酐蔗糖酶的转糖基作用,以碳水化合物作为受体,可以合成多种低聚糖[5],例如,Rodrigues等利用右旋糖酐蔗糖酶,以蔗糖为糖基供体,麦芽糖为糖基受体,生成新的寡糖6-a-葡萄糖基麦芽糖[6]。Díez-Municio等利用右旋糖酐蔗糖酶,以蔗糖为糖基供体,乳果糖为糖基受体,合成了一种新的三糖,乳果糖蔗糖[7]。右旋糖酐蔗糖酶还可以以天然产物作为糖基受体,合成新的糖苷类化合物[8],并在一定程度上提高它们的生理活性,例如水溶性,抗氧化性,酶抑制性等。例如,Kim等利用右旋糖酐蔗糖酶,以蔗糖为糖基供体,紫云英甙为糖基受体,得到多种紫云英甙的糖苷,相比紫云英甙,它们对基质金属蛋白酶的表达抑制作用提高了8.3%~60.6%, 抗氧化性提高18.8%~20.3%,黑色素合成抑制率提高了3.8%~18.8%[9]。Moon等利用右旋糖酐蔗糖酶,以蔗糖为糖基供体,表没食子儿茶素没食子酸为糖基受体,合成了多种表没食子儿茶素没食子酸的糖苷,合成的几种新的糖苷类化合物的水溶性分别提高了69、126和122倍[10]。Woo等利用右旋糖酐蔗糖酶合成了蛇葡萄素的糖苷,合成的新的糖苷类化合物水溶解性、抗褐变、抗氧化性及酪氨酸酶抑制性的能力相比较蛇葡萄素都有一定程度的提高[11]。
黄酮类化合物广泛存在于自然界,有抗炎抑菌、抗病毒、抗氧化、抗肿瘤、抗辐射和免疫调节等诸多活性。由于大多数黄酮类化合物在水相中溶解度低, 限制了其制剂的开发。目前国内外对黄酮类化合物进行分子修饰主要是以提高其在水相中的溶解性为目的,而对其水溶性改性所涉及的化学反应主要是糖基化。利用化学合成来进行结构修饰存在着得率低、反应专一性差、副产物多等缺点, 而生物转化技术却可弥补化学合成的不足[12]。本研究主要利用右旋糖酐蔗糖酶的转糖基作用,在有机-水两相中合成一种槲皮素糖苷[13],同时研究了槲皮素糖苷的分离纯化的方法和酶催化反应条件对槲皮素糖苷转化率的影响。
1 材料与方法
1.1 材料与试剂
1.1.1 菌种来源基因工程菌EscherichiacoliBL21(DE3)/pET28-dexYG由本实验室构建、保存。
1.1.2 试剂与仪器槲皮素;蔗糖;大孔树脂(AB-8)购于天津波鸿树脂科技有限公司;右旋糖酐蔗糖酶实验室自制;其他试剂均为分析纯,水为去离子水。GL-20G-II高速冷冻离心机(上海安亭科学仪器厂);KS-150超声波细胞粉碎机(宁波科生仪器厂);VIS-723紫外分光光度计(上海精密科学仪器有限公司);低温旋蒸仪(东京理化);Model 201高效液相色谱仪(天津埃文森科技有限公司);Quiksep-100高压层析系统(北京慧得易公司)。
1.2 实验方法
1.2.1 右旋糖酐蔗糖酶的制备与酶活力的测定
右旋糖酐蔗糖酶的制备方法参照文献[14]。
右旋糖酐蔗糖酶酶活力的测定采用DNS法,以果糖的生成速度测定酶活性大小。在 25℃下, 1 mL 底物反应液中每小时催化底物蔗糖产生 0.1 mg 果糖所需的酶量定义为一个酶活力单位(U)。
具体步骤 : 在乙酸-乙酸钠(0.02 mol/L、pH值5.4)缓冲液中配制蔗糖浓度为10%反应液,加入酶液在25℃反应1 h。终止反应后取样加入DNS试剂,在沸水浴中准确加热5 min,取出冷却至室温,用蒸馏水定容。以未反应的对照液调零点,在波长520 nm处测量光密度值,然后计算酶活。
1.2.2 酶催化反应
配置50 mL 30%的DMSO-乙酸-乙酸钙缓冲液(pH值5.4)于250 mL锥形瓶中,加入0.02 g槲皮素和5 g蔗糖,超声2 min助溶,过滤后,加入1.0 mL酶液,25°C下摇床中反应,不同反应时间取样进行分析。
1.2.3 槲皮素糖苷的分离纯化
1)醇沉除去右旋糖酐酶催化反应24 h后,加热使酶失活,终止反应,再向反应液中缓慢加入无水乙醇,并不停用玻璃棒搅拌,瞬间没有白色糖酐析出即可。
2)AB-8大孔树脂分离纯化AB-8大孔树脂的预处理[15]:先用95%乙醇浸泡10~24 h,再用95%乙醇洗至洗脱液加入水中不显浑浊即可,然后用水洗至无醇味,即可上样。
将预处理过后的AB-8大孔树脂装柱,并将醇沉,浓缩后的反应液上柱,将样品在大孔树脂中吸附0.5 h,再用大量水洗脱杂质,最后用高浓度的乙醇洗脱样品。
3)SephadexLH-20柱分离纯化[16]将上述的乙醇洗脱液浓缩后上样,先用低浓度的乙醇洗脱目标产物,再用高浓度的乙醇洗脱底物槲皮素。
1.3 酶催化反应条件的研究
酶催化反应以蔗糖浓度为10%,酶活力为30 U/mL,于25°C,150 r/min的恒温摇床中反应,在第10小时、第20小时和第44小时分别取样,测定糖基化产物的转化率。
确定最佳反应时间后,酶催化反应以蔗糖浓度为10%,于25°C,酶活力分别为20、30、40、60和120 U/mL,于150 r/min的恒温摇床中反应24 h后,取样测定糖基化产物的转化率。
确定最佳反应时间和最适酶活力后,酶催化反应的蔗糖浓度分别为2%、4%、6%、8%、10%、14%、18%和30%,酶活力分别为20、30和40 U/mL,于25°C, 150 r/min的恒温摇床中反应24 h后,取样测定糖基化产物的转化率。
1.4 检测方法
1.4.1 薄层色谱法(TLC)分析取 1 mL酶催化反应液,加入2 mL无水乙醇,醇沉除去糖酐,9000 r/min离心10 min。取上清液,用毛细管取样,点于高效G硅胶板。槲皮素及槲皮素糖苷的展开剂为正丁醇∶乙酸∶水=5∶3∶1(v/v/v),糖类杂质薄层条件:展开剂为正丁醇∶异丙醇∶乙酸∶水=7∶5∶4∶2(v/v/v/v)。显色剂为苯胺,二苯胺,磷酸溶液。
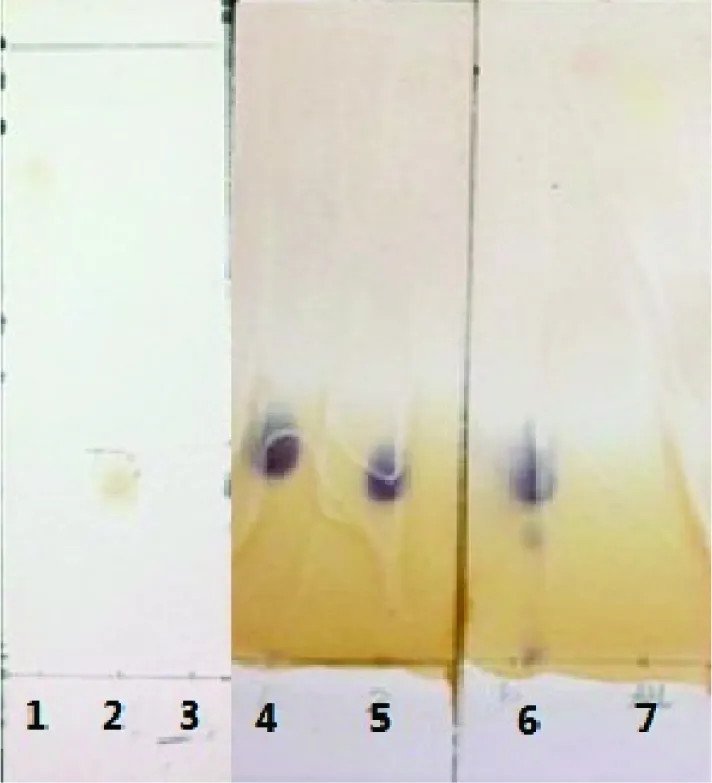
图1 槲皮素糖苷和低聚糖的薄层色谱分析
1—槲皮素标品;2—反应后,槲皮素糖苷;3—大孔树脂水洗脱液;4—果糖标品;5—蔗糖标品;6—大孔树脂水洗脱液中的糖类杂质;7—醇洗脱样品前,水洗脱液中的糖类杂质。
1.4.2 槲皮素和槲皮素糖苷的HPLC检测 Model 201高效液相色谱仪:色谱柱为C18柱(4.6 mm×150 mm)检测器:紫外检测器,检测波长:373 nm,上样量:20 μL,流速1 mL/min,洗脱液:A液,23%乙腈;B液,77%水,等梯度洗脱。
1.4.3 槲皮素糖苷的质谱(MS)分析 Thermo TSQ Quantum Quantum Ultra AM 三重四级杆质谱: 负离子模式、全扫描模式,毛细管加热温度:270℃,电喷雾电压:4500V。
2 结果与分析
2.1 酶催化反应体系的研究
2.1.1 槲皮素在不同比例的有机溶剂-乙酸-乙酸钙缓冲液(0.02 mol/L,pH=5.4)中的溶解性
槲皮素在水中的溶解度极低,需要选择有机溶剂-缓冲液的反应体系来增加底物槲皮素的溶解性。
槲皮素在反应体系中的溶剂度的大小与其测得的OD值成正比,随着有机试剂比例的不断增大,槲皮素在溶剂中OD值不断增加,说明槲皮素的溶解性也不断增加。实验结果表明,当采用20%以及更高有机溶剂比例的混合溶剂,槲皮素的溶解度大大提高。
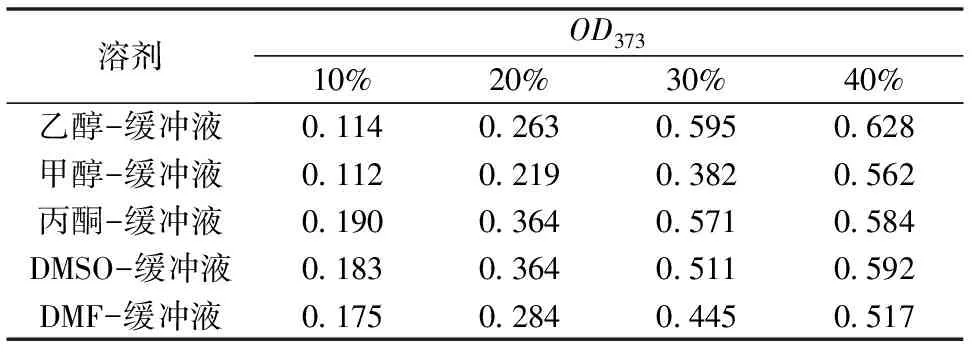
表1 槲皮素在不同比例的有机溶剂-乙酸-乙酸钙缓冲液中的OD值
2.1.2 右旋糖酐蔗糖酶在不同比例的有机溶剂-缓冲液中的酶活高低
考虑到酶在100%的有机溶剂中失活,因此实验设计用有机溶剂和水的混合物作为反应体系,配制20%和40%乙醇、甲醇、异丙醇、DMF、DMSO的水溶液,蔗糖浓度为10%,加入酶液在25℃反应1 h。终止反应后取样加入DNS试剂,在沸水浴中准确加热5 min,取出冷却至室温,用蒸馏水定容。以未反应的对照液调零点,在波长520 nm处测量光密度值,考察右旋糖酐蔗糖酶在上述体系中的酶活情况。
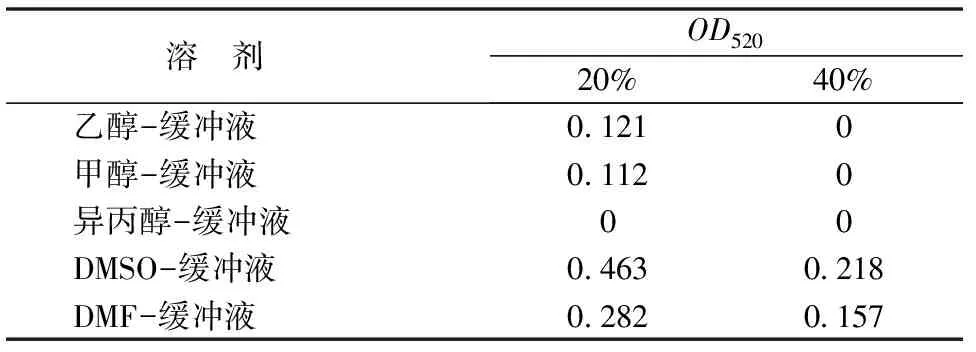
表2 右旋糖酐蔗糖酶在不同比例有机溶剂-缓冲液中的OD值
由1.2.1酶活公式可知,右旋糖酐蔗糖酶在反应体系中的酶活力大小与其测得的OD值成正比。由表2可知,在20%的有机溶剂-缓冲液体系中,除异丙醇-缓冲液反应体系外,右旋糖酐蔗糖酶都能维持一定的酶活,在40%的有机溶剂-缓冲液体系中,只有DMSO-缓冲液 和DMF-缓冲液还能维持一定的活力,但在20%DMSO-缓冲液反应体系中,右旋糖酐蔗糖酶的酶活最高。
2.1.3 右旋糖酐蔗糖酶在不同比例DMSO-乙酸-乙酸钙缓冲液(0.02 mol/L,pH值5.4)中的相对活力
由图2可知,当DMSO的比例不超过30%的情况下,酶活可以维持原来的50%,这与Emmanuelle Girard, Marie-Dominique Legoy的实验结果相吻合。综合考虑3个图的实验结果,在既能维持一定酶活,又能溶解一定量槲皮素的件下,选择30%DMSO-乙酸-乙酸钙缓冲液(0.02 mol/L,pH值5.4)作为酶催化的反应体系。100%的相对活力是指右旋糖酐蔗糖酶在100%乙酸-乙酸钙缓冲液(DMSO为0%)中的酶活力,此时酶活力最高。
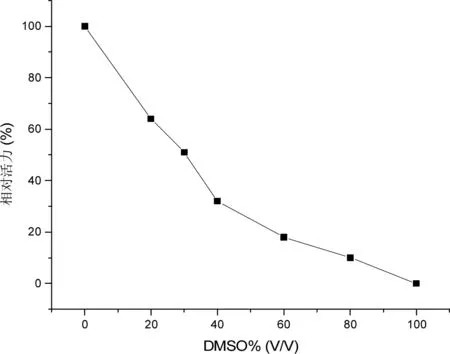
图2 右旋糖酐蔗糖酶在不同比例DMSO%(v/v)中的相对活力

图3 酶催化产物的HPLC检测结果
Fig 3 The HPLC detection results of enzyme catalyzed product
a—酶催化反应前的HPLC图谱;b—酶催化反应24 h后的HPLC图谱;c—大孔树脂分离纯化后的HPLC图谱;d—SephadexLH-20分离纯化后,目标产物峰的HPLC图谱。
2.2槲皮素及其糖基化产物的分离纯化
通过醇沉除去大分子右旋糖酐,旋蒸除去乙醇,大孔树脂柱除去低聚糖类杂质,Sephadex LH-20除去底物槲皮素,并收集目标产物槲皮素糖苷。对槲皮素及槲皮素糖苷的分离纯化结果通过高效液相色谱进行检测,每一步分离纯化后的检测结果如下图3 a、b、c、d所示。
由酶催化产物分离纯化后的HPLC检测结果可知,通过分离纯化,可以得到纯度较高的槲皮素糖苷。
2.3 酶催化反应条件的研究
2.3.1 反应时间槲皮素糖苷转化率的影响
在右旋糖酐蔗糖酶酶催化的反应过程中,反应时间越长,反应体系粘度越大,而较大的粘度对糖基受体,供体,酶之间的结合会有较大的影响。分别在0 h、10 h、20 h和44 h取样检测,考察反应时间对槲皮素糖苷转化率的影响。实验结果如图4。从图中可知,反应时间对槲皮素糖苷转化率就有较大影响,最后选择选择反应20~24 h作为酶催化反应的终点。

图4 反应时间对槲皮素糖苷转化率的影响

图5 酶活力对槲皮素糖苷转化率的影响
2.3.2 酶活力对槲皮素糖苷转化率的影响
在右旋糖酐蔗糖酶酶催化的反应过程中,酶活力越高,反应体系达到一定粘度的时间就越短,而反应体系的粘度会影响糖基受体,供体,酶之间的结合。分别考察酶活分别是20、30、40、60和120 U/mL时对酶催化产物槲皮素糖苷转化率的影响,实验结果见图5。从图中可知,酶活力在40 U/mL时,槲皮素糖苷转化率最高。当酶活力大于60 U/mL,反应24 h后,反应液变像果冻一样粘,推测可能是因为大量糖酐的生成阻碍了糖基与槲皮素之间相结合,而在较低的酶活下,反应一段时间后,反应液仍然保持一定程度的流动性,目标产物的转化率也就较高。
2.3.3 蔗糖浓度和酶活力对槲皮素糖苷转化率的影响
蔗糖作为酶催化反应的糖基供体,在反应体系溶解较多槲皮素,酶活力适宜的条件下,充足的糖基供体对糖基化产物的最终转化率是有影响的。分别考察蔗糖浓度(w/v)为2%、4%、6%、8%、10%、14%、18%和30%,酶活力为20、30和40 U/mL时,对槲皮素糖基化产物转化率的影响,实验结果如图6。从图6中可知,当蔗糖浓度为10%,在酶活是20、30和40 U/mL时槲皮素糖苷的转化率都比较高。当蔗糖浓度大于10%时,随着浓度的增加,酶活的增加并没有显著提高槲皮素糖苷的转化率,这说明当酶活较大时,随着反应时间的增加,反应体系粘度变大,不利于受体与供体结合生成产物。而当蔗糖浓度小于5%时,可能是因为蔗糖浓度较低,反应24 h后,蔗糖被耗尽,虽然酶仍然可以参加转糖基反应,但是没有足够的糖基供体,而糖基化产物槲皮素糖苷作为糖基供体,果糖作为糖基受体,使槲皮素糖苷的转化率降低,当糖基供体蔗糖浓度大于8%后,又开始恢复正常,在蔗糖浓度相同,酶活较高的条件下,槲皮素糖苷的转化率也较高。当蔗糖浓度为10%,酶活40 U/mL时,槲皮素糖苷的转化率最高,为39.5%。
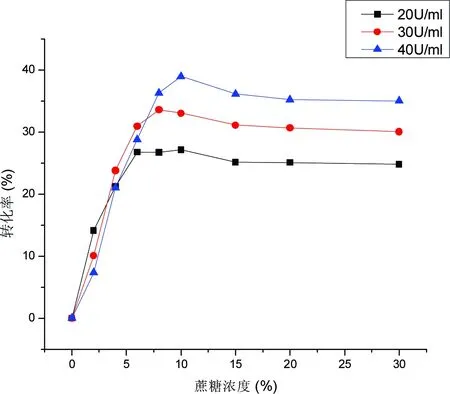
图6 不同蔗糖浓度和酶活力对槲皮素糖苷转化率的影响
2.4 槲皮素葡萄糖苷的质谱分析
槲皮素的分子量是302.23,每连接一个葡萄糖,分子量增加162,所以槲皮素单糖苷的分子量是464.23,由图7 可见,质谱图中出现的463.3峰为[M-H]质谱信号。由此可以断定,TLC图谱和HPLC图谱中出现的新物质是槲皮素的单糖苷。

图7 槲皮素糖基化产物的质谱图
2.5 槲皮素葡萄糖苷结构的推测
由产物的分子量以及底物槲皮素的结构式可以推测产物可能的结构式,由图8可知槲皮素上有5个羟基可能被糖基化。据文献报道,来自蜡状芽孢杆菌的葡萄糖基转移酶可以得到多种槲皮素的糖基化产物,糖基化位置分别是槲皮素的5,7, 3′, 4′位羟基, 而来自肠膜状明串珠菌的葡萄糖基转移酶,糖基化位置主要是在槲皮素的B环上3′, 4′位羟基,文献中还提出,槲皮素B环上两个邻位羟基(3′, 4′)对槲皮素是否可以被糖基化是极其重要的。所以推断葡萄糖基可能连接到槲皮素B环上的3′, 4′位羟基上。
对槲皮素葡萄糖苷结构的准确判断,还需要通过核磁共振氢谱来进行分析,如果葡萄糖分子连接到了4′为羟基上,由于糖分子基团的存在,会对槲皮素B环上5′位上氢原子的化学位移产生较大的影响,使其化学位移变大,而对槲皮素B环上2′, 6′位上氢原子的化学位移影响较小。同理,如果葡萄糖分子连接到了3′为羟基上,会对槲皮素B环上2′位上氢原子的化学位移产生较大的影响,使其化学位移变大。通过槲皮素葡萄糖苷1H NMR的数据与文献中数据相比较,来进一步确定其结构。
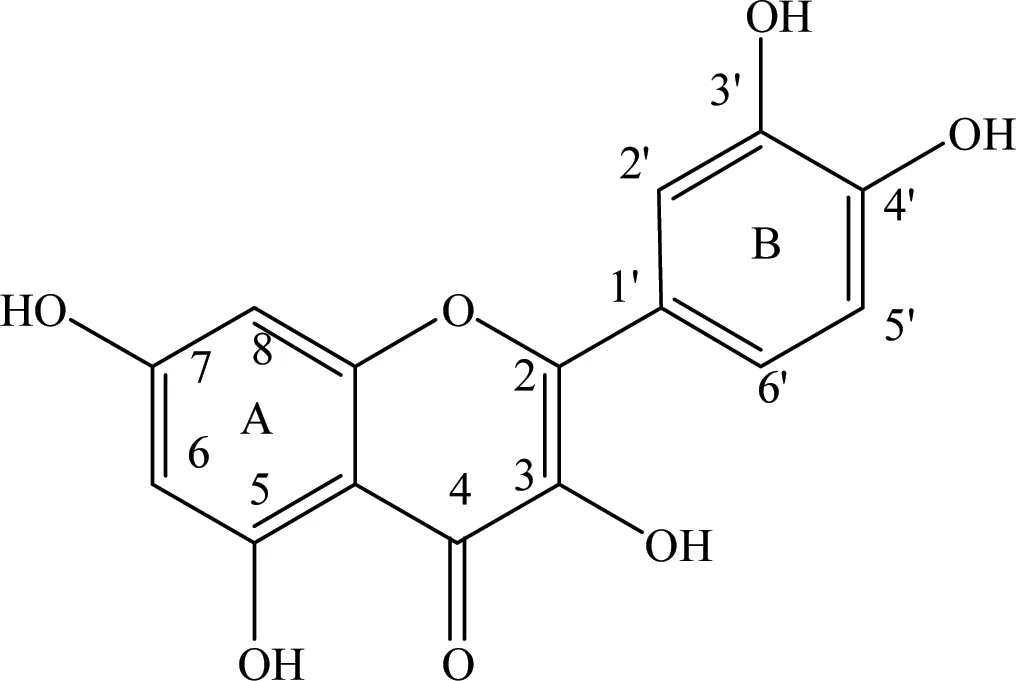
图8 槲皮素的结构式
3 结论
利用右旋糖酐蔗糖酶,通过转糖基作用,在DMS0-乙酸乙酸钙缓冲液中合成槲皮素糖苷是可行的,利用大孔树脂(AB-8)和Sephadex LH-20分离纯化后可以得到较为纯净的槲皮素单糖苷,通过薄层色谱,高效液相色谱和质谱基本可以确定酶催化产物就是槲皮素的单糖苷。
利用高效液相色谱测定了右旋糖酐蔗糖酶催化合成槲皮素单糖苷的转化率,确定了得到较高转化率槲皮素单糖苷的工艺条件,在25°C下,30%的DMSO-乙酸乙酸钙(0.02 mol/L,pH值5.4)反应体系中,以10%的蔗糖作为糖基供体,酶活力为40 U/mL,转速为150 r/min,反应24 h,糖基化产物的转化率最高可达39.5%。
参考文献:
[1]张洪斌,朱春宝,胡又佳,等.右旋糖酐蔗糖酶工程菌株的构建及其培养条件的研究[J].微生物学报,2008,48(4):492-497.
[2]罗 靳,杨雅麟,王建华.肠膜明串珠菌右旋糖酐蔗糖酶的研究进展[J].微生物学通报,2007,34(4):787-789.
[3]Robyt J F, Yoon S H, Mukerjea R. Dextransucrase and the mechanism for dextran biosynthesis[J]. Carbohydrate Research, 2008, 343:3039-3048.
[4]Davies G, Henrissat B. Structures and mechanisms of glycosyl hydrolases [J]. Structure,1995, 3(9): 853-859.
[5]Robyt J F. Mechanisms in the glucansucrase synthesis of polysaccharides and oligosaccharides from sucrose [J]. Adv Carbohydr Chem Biochem, 1995,51:33-138.
[6]Rodrigues S, Lona L M F, Franco T T. Optimizing panose production by modeling and simulation using factorial design and surface response analysis [J].Food Engineering, 2006, 75: 433-440.
[7]Díez-Municio M, Herrero M, Jimeno M L, et al. Efficient synthesis and characterization of lactulosucrose byLeuconostocmesenteroidesB-512F dextransucrase [J]. Agric Food Chem, 2012, 60: 10564-10571.
[8]Seo E S, Kang J, Lee J H, et al. Synthesis and characterization of hydroquinone glucoside using leuconostoc mesenteroides dextransucrase [J]. Enzyme and Microbial Technology, 2009, 45:355-360.
[9]Kim G E, Kang H K, Seo E S, et al. Glucosylation of the flavonoid,astragalin byLeuconostocmesenteroidesB-512FMCMdextransucrase acceptor reactions and characterization of the products [J].Enzyme and Microbial Technology, 2012, 50:50-56.
[10]Moon Y H, Kim G, Lee J H, et al. Enzymatic synthesis and characterization of novel epigallocatechin gallate glucosides [J].Molecular Catalysis B: Enzymatic, 2006, 40:1-7.
[11]Woo H J, Kang H K, Nguyen T T H, et al. Synthesis and characterization of ampelopsin glucosides using dextransucrase fromLeuconostocmesenteroidesB-1299CB4: glucosylation enhancing physicochemical properties[J]. Enzyme and Microbial Technology , 2012, 51:311-318.
[12]吴薛明, 许婷婷, 储建林, 等.黄酮类化合物酶法糖基化修饰的研究进展[J].中国天然药物,2010, 8 (5): 389-400.
[13]Bertrand A, Morel S, Lefoulon F, et al.Leuconostocmesenteroidesglucansucrase synthesis of flavonoid glucosides by acceptor reactions in aqueous-organic solvents[J].Carbohydrate Research, 2006, 341:855-863.
[14] Zhang H B, Zhu C B, Hu Y J, et al. Cloning, sequencing and expression of a dextransucrase gene ( dex YG) fromLeuconostocmesenteroides[J] .Biotechnol Lett, 2008, 30:1441-1446.
[15]朱 英,罗永明,付小梅.大孔树脂分离油茶皂苷和黄酮的研究[J].林产化学与工业,1999,19(1):40.
[16]Aramsangtienchai P, Chavasiri W, Ito K, et al. Synthesis of epicatechin glucosides by a cyclodextrin glycosyltransferase [J]. Molecular Catalysis B: Enzymatic, 2011, 73: 27-34.

