纳米二氧化钛对纤毛虫阔口游仆虫超微结构的影响研究
杨林颖, 马 瑞, 翟 楠, 倪 兵, 顾福康
(1. 华东师范大学 生命科学学院, 上海 200062;2. 上海交通大学医学院生化系公共技术平台电镜室, 上海 200025)
纳米二氧化钛(TiO2)是目前应用最广泛的纳米材料之一,在光催化性、光吸收性、可塑性等方面表现出的特点已使其在化妆品、涂料、空气净化、杀菌消毒等领域展现出了广阔的应用前景[1-3]。由于纳米TiO2能随着产品经呼吸、皮肤接触、消化道等不同途经进入生物体内,因而其潜在安全性问题已引起了人们的关注。目前对纳米TiO2生物组织毒性和细胞毒性的研究主要集中于高等动物组织或细胞[4-5],而纳米TiO2对原生动物纤毛虫的毒性研究尚未见报道。原生动物是最简单、最原始的单细胞真核生物,且生活坏境的细微变化都可引起其细胞形态及生活状态的改变,因而一直以来都是细胞学研究和环境测评的良好材料。
本研究应用透射电子显微术观察了纳米TiO2对原生动物阔口游仆虫(Euploteseurystomus)的细胞超微结构的影响,以期为深入探索纳米TiO2的细胞毒性及毒性机制提供实验依据。
1 材料和方法
1.1 实验材料及分组
阔口游仆虫采自上海郊区某池塘,经分离纯化后,用麦粒发酵液培养的鞭毛虫草履唇滴虫(Chilomonasparamecium)喂食培养,培养温度20℃。
纳米TiO2(5 nm、25 nm)购自Degussa公司,120℃高温灭菌2 h后,用双蒸水配置成1 mg/mL的颗粒悬浮母液,用数控超声波仪在300 W、25℃条件下解聚30 min,现配现用。
实验共分为5 nm组、25 nm组和对照组3组,每组均加入50只生长状态良好的阔口游仆虫。处理组分别对应加入5 nm 和25 nm TiO2母液使其在培养液中终浓度为100 μg /mL,对照组则用正常培养液培养。24 h后取样制备透射电镜样品。
1.2 透射电镜制样及观察
24 h后收集各组阔口游仆虫,并参照顾福康等[6]和Arregui等[7]报道的方法,做适当修改后制备透射电镜样品:1%的锇酸与2.5%的戊二醛(1∶1)混合液4℃下固定10 min, 0.1 mol/L PBS漂洗3次;1%锇酸4℃下固定1 h,PBS洗涤3次后,用梯度丙酮脱水、包埋聚合,超薄切片后进行醋酸铀-柠檬酸铅染色,于透射电镜(日立HT 7700)下观察。
2 结果
纳米TiO2解聚后分散效果良好(图1)。

图1 5 nm(A)和25 nm(B)TiO2解聚后的分散相

图2 正常阔口游仆虫细胞超微结构
A—腹表膜下微管层; B—背表膜下微管层; C—细胞核; D—线粒体; E—内含线粒体的自噬泡(P质膜, A表膜泡, N细胞核, Mit线粒体)。
2.1 正常阔口游仆虫的超微结构
对照组中,阔口游仆虫细胞被覆表膜,表膜由质膜、表膜泡外膜和表膜泡内膜3层膜组成。表膜下分布有各种微管类细胞骨架,其中包括由单根微管间隔排列而成的腹表膜下微管层(图2-A),及由倒“品”字形微管单元间隔排列而成的背表膜下微管层(图2-B),每个倒“品”字形微管单元含3根微管。细胞质致密,少见无结构基质。细胞核边缘不规则,核膜清晰,核内含许多颗粒状的核仁,染色质呈大小不等的颗粒状或块状,电子密度高于核仁(图2-C)。线粒体呈球形或椭球形,形态规则,内外膜清晰,内膜内凹形成大量管状或片层状的嵴(图2-D)。细胞内有各级消化泡及自噬泡,消化泡内有不同消化程度的食物颗粒,自噬泡内含有被吞噬的细胞自身结构如解体的线粒体等胞器(图2-E)。
2.2 纳米TiO2在阔口游仆虫细胞内的存在状态
处理组细胞内均出现了电子密度较高的纳米TiO2颗粒,纳米TiO2主要以聚集状存在于阔口游仆虫的消化泡(图3-A、B)和自噬泡中(图3-C),也可由单层或多层膜包裹或无膜包被直接散步于胞质或胞器等结构(图3-D)。

图3 纳米TiO2在阔口游仆虫细胞内的存在状态
2.3 处理组阔口游仆虫的超微结构
纳米TiO2能直接穿破核膜(图4-A、B)及线粒体膜(图4-C),从而对细胞核和线粒体造成直接或间接的损伤。
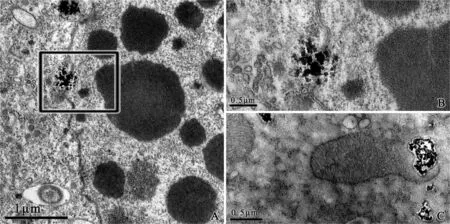
图4 聚集的纳米TiO2直接穿破核膜及线粒体膜
(B为A中黑框区域的放大)
经不同粒径纳米TiO2处理后,阔口游仆虫的细胞超微结构发生了不同程度的损伤:1) 25 nm TiO2处理组的细胞核核仁变少,染色质出现较多空洞(图5-A)或碎裂成许多小块(图5-B);线粒体外膜受损,与胞质界限模糊(图5-D)。2) 5 nm TiO2处理组的细胞损伤较为严重,细胞质不如对照组致密,整个细胞质呈现空泡化,细胞内多处出现多层膜状结构(图5-F)及内质网(图5-G),部分膜状结构正在包围纳米材料(图3-D);细胞核核仁消失,染色质浓缩聚集成大且不规则的团块状(图5-C);线粒体变形,局部凹陷,嵴瓦解,线粒体腔内有断裂的嵴碎片(图5-E),且细胞内出现大量线粒体被自噬泡吞噬消化的现象。
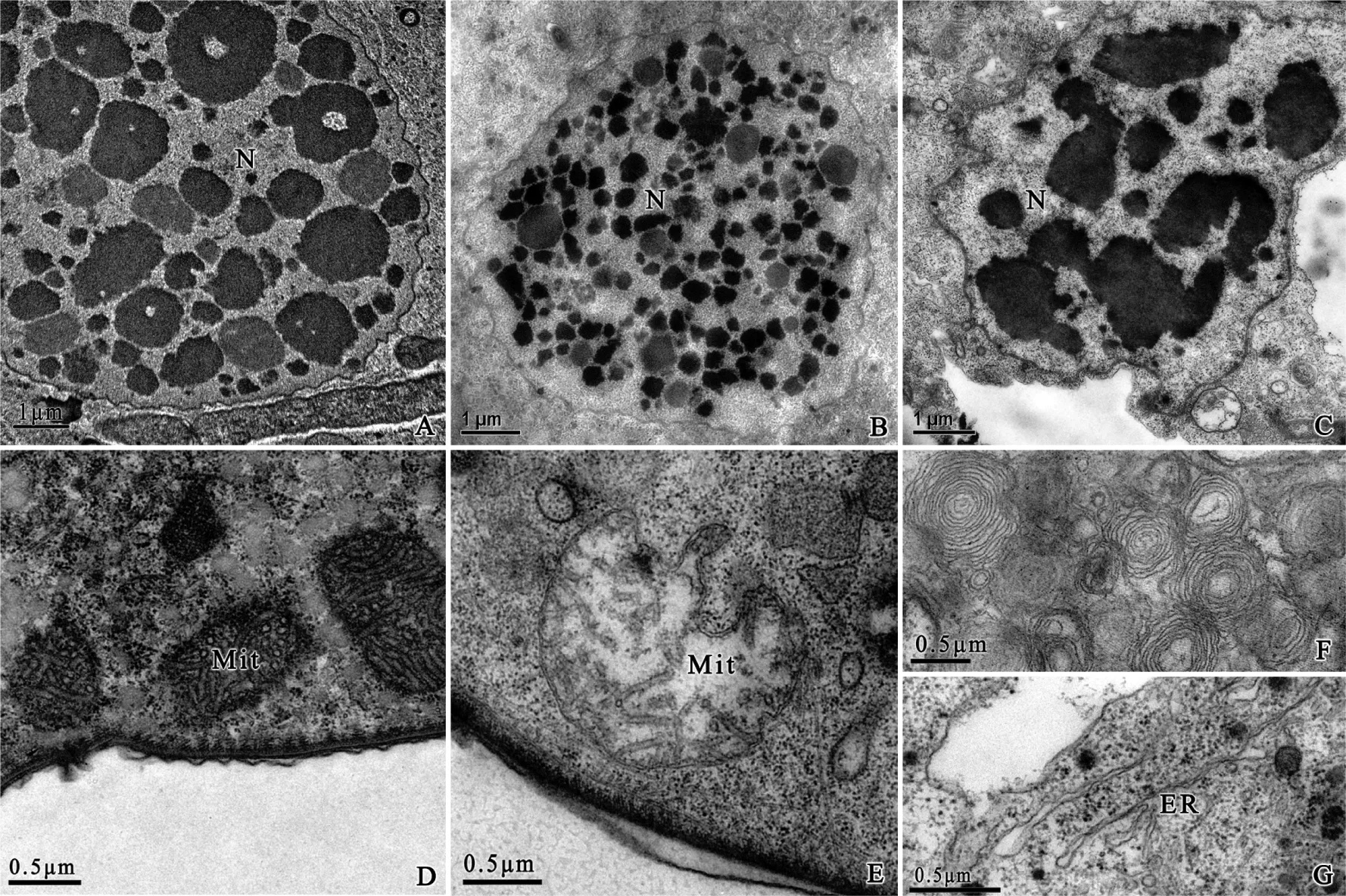
图5 处理组阔口游仆虫细胞超微结构
(A、B—25 nm TiO2处理组细胞核; C—5 nm TiO2处理组细胞核; D—25 nm TiO2处理组线粒体; E—5 nm TiO2处理组线粒体; F—5 nm TiO2处理组细胞内大量的多层膜状结构; G—5 nm处理组细胞内出现内质网)。
另外,各处理组背表膜下微管层连续出现倒“品”字形微管单元各缺失两根微管的现象(图6-A),腹表膜下微管层也出现局部微管缺失的现象(图6-B),细胞表膜下不再形成间隔一致有序的背腹表膜下微管层。

图6 处理组阔口游仆虫的背(A)腹(B)表膜下微管层
3 讨论
3.1 纳米TiO2进入阔口游仆虫细胞的方式
关于纳米TiO2侵入细胞方式的报道已有很多,其最常见的侵入方式为胞吞[8],也有报道纳米TiO2可直接穿过细胞膜进入细胞[9-10]。本实验结果中未发现有细胞表膜破损及表膜直接内吞纳米颗粒的现象,但在阔口游仆虫的各级消化泡中观察到有纳米TiO2的存在,推测纳米TiO2是经口通过阔口游仆虫的摄食进入细胞的。这可能与实验材料本身的特点有关,阔口游仆虫属高等单细胞原生动物,表膜由3层膜构成,结构厚实致密,表膜下又有复杂的微管类细胞骨架,故纳米TiO2很难通过穿膜或内吞途径进入阔口游仆虫。
3.2 纳米TiO2对阔口游仆虫细胞超微结构的影响
本研究发现纳米TiO2对阔口游仆虫细胞超微结构的影响是多方面的。观察发现纳米TiO2可直接穿破核膜及线粒体膜,导致二者超微结构发生明显变化,如细胞核核仁减少、染色质聚集浓缩及线粒体肿胀变形、外膜受损、内膜嵴状结构断裂瓦解等,这与前人关于纳米TiO2对细胞的靶作用部位及损伤效应的描述较为相似[11-13]。细胞核和线粒体等胞器的损伤,可能影响到细胞内微管基因的表达及能量的供应,进而阻碍微管蛋白的合成组装,导致阔口游仆虫背腹表膜下的微管层出现局部缺失。另外,细胞质出现空泡化,多层膜性结构以及大量只在特殊生理状态下才可见的内质网的出现,均表明纳米TiO2对阔口游仆虫细胞超微结构的损伤是广泛的,并且细胞在多种胞器受损、生命活动受阻的情况下,产生了诸如形成膜物质包围纳米材料的防御机制。
3.3 纳米TiO2对细胞损伤的粒径效应
目前很多分子实验发现纳米TiO2对细胞的损伤具有粒径效应[14],即粒径越小,对细胞的毒性作用越大,而从细胞超微结构方面去证实纳米材料的粒径效应鲜有报导,本研究电镜结果表明纳米TiO2对细胞结构的损伤确实表现出粒径效应。这可能是由于随着纳米颗粒粒径的减小,其比表面积增大,表面电子受体和供体活动位点增多,表面能和表面张力也急剧增加,从而表现出更加活跃的理化性质[15]。另外,在阔口游仆虫细胞中,小粒径的纳米颗粒可能具有更强的穿膜能力及转移活性[16],从而表现出对细胞超微结构更为严重的影响和损伤。
综上所述,纳米TiO2可直接穿过核膜及线粒体膜,导致阔口游仆虫的细胞核及线粒体受损,进而影响到细胞内各种活动功能的正常运行。但关于纳米TiO2对细胞器的具体损伤机制以及阔口游仆虫对纳米TiO2的防御机制还有待进一步的研究。
参考文献:
[1]Matthews R W. Purification of water with near-UV illuminated suspensions of titanium dioxide [J]. Water Research, 1990, 24(5):653-660.
[2]Lin Y M, Tseng Y H, Huang J H, et al. Photocatalytic activity for degradation of nitrogen oxides over visible light responsive titania-based photocatalysts[J]. Environ Sci & Technol, 2006, 40: 1616-1621.
[3]Matsunaga T, Tomoda R, Nakajima T, et al. Photoelectrochemical sterilization of microbial cells by semiconductor powders [J]. FEMS Microbiology Letters, 1985, 29(1/2): 211-214.
[4]Gurr J, Wang A S S, Chen C H, et al. Ultrafine titanium dioxide particles in the absence of photoactivation can induce oxidative damage to human bronchial epithelial cells [J]. Toxicology, 2005, 213(1/2):66-73.
[5]Rahman Q, Lohani M, Dopp E, et al. Evidence that ultrafine titanium dioxide induces micronuclei and apoptosis in Syrian Hamster Embryo Fibroblasts[J]. Environ Health Perspect, 2002, 110(8):797-800.
[6]顾福康, 倪 兵.包囊游仆虫休眠包囊的超微结构研究[J].实验生物学报, 1995, 28(2):163-172.
[7]Arregui L, Serrano S, Gunea A, et al. Microtubular element of the marine Antarctic ciliateEuplotesfocardii(Ciliophora, Hypotrichia)[J]. Archiv Fur Protistenkunde, 1994, 144(4): 357-364.
[8]杨勇骥, 汤 莹, 于 洋, 等.纳米材料侵入细胞的电镜研究[J].电子显微学报, 2008, 27(5): 400-403.
[9]Geiser M, Rutishauser B R, Kapp N, et al. Ultrafine particles cross cellular membranes by nonphagocytic mechanisms in lungs and in cultured cells[J]. Environ Health Perspect, 2005, 113(11):1555-1560.
[10]Long T C, Saleh N, Tilton R D, et al. Titanium dioxide (P25) produces reactive oxygen species in immortalized brain microglia (BV2): implications for nanoparticle neurotoxicity[J]. Environ Sci & Technol, 2006, 40:4346-4352.
[11]羊富光,汤 莹,于 洋, 等.二氧化钛纳米颗粒对人角质形成细胞超微机构的影响及毒性效应[J].解剖学杂志, 2009, 32(2):148-151.
[12]Amézage-Madrid P, Silveyra-Morales R, Córdoba-Fierro L, et al. TEM evidence of ultrastructural alteration onPseudomonasaeruginosaby photocatalytic TiO2thin films [J]. Photochem Photobiol B, 2003, 20:45-50.
[13]汤 莹,于 洋,雷长海, 等.二氧化钛纳米颗粒对小鼠单核巨噬细胞超微结构影响的电镜研究[J].电子显微学报, 2009, 28(6):539-542.
[14]Oberdörste G, Ferin J, Lehnert B E. Correlation between particle size,invivoparticle persistence and lung injury[J]. Environ Health Perspect, 1994, 102(Suppl.5):173-179.
[15]吴长江.不同纳米二氧化钛粒径的应用研究[J].广州化工, 2006, 34(1): 26-27.
[16]李俊纲,李晴暖,李文新.粒径小于3纳米的TiO2对小鼠的肺部损伤[J].纳米科技, 2006(6):17-21.
——水芹主要害虫识别与为害症状

