聚乙烯醇与聚丙烯酸对中温α-淀粉酶的影响
钱柿汝, 袁久刚, 姚金龙, 樊正国, 卢荣清, 王 强, 范雪荣
(1. 江南大学 生态纺织教育部重点实验室,江苏 无锡 214122;2. 江苏联发纺织股份有限公司 江苏省生态染整技术重点实验室,江苏 海安 226601)
众所周知,聚乙烯醇(PVA)和聚丙烯酸(PAA)均为比较重要的纺织上浆材料。PVA浆料具有很多优点,如黏度稳定、粘着力强、成膜性好、浆膜强度较大,弹性伸长、耐磨性和耐屈曲性好等,且其上浆性能优于原淀粉和变性淀粉。PAA浆料对亲水性纤维有良好的黏附性,能改善淀粉浆料的粘度热稳定性[1]。
经纱上浆织造成织物后需要退浆,α-淀粉酶可迅速将淀粉大分子降解成糊精、麦芽糖和葡萄糖等水溶性物质,将织物(经纱)上的淀粉浆料快速去除,具有能耗低、排污少、废水处理简单等优点[2-3]。此外,由于酶的专一性,淀粉酶退浆较碱退浆织物强力损伤小,因此淀粉酶退浆被印染企业广泛采用。但酶对反应环境的要求苛刻,对环境的变化敏感。当反应环境发生变化时,其构象和活力都会发生变化,导致其催化效率发生变化。研究表明,一些小分子多元醇[4]和表面活性剂[5-6]等低分子量物质和聚乙二醇、聚乙烯胺[7-8]等高聚物均会对酶的分子内结构和微环境等造成一定的影响,这些影响可以通过酶内氨基酸的内源性荧光及酶的二级结构的变化予以分析。大多数的酶分子中都含有芳香族氨基酸,色氨酸(Trp)、酪氨酸(Tyr)和苯丙氨酸(Phe)这3类氨基酸均同属于这一类氨基酸,这3类氨基酸所具有的的荧光特性之所以不同,主要是因为它们的侧链基团不同。这3类氨基酸所具有的荧光强度排列依次为:色氨酸、酪氨酸和苯丙氨酸。在现有的酶构象研究中,往往会根据芳香族氨基酸的荧光特性来推测酶分子的构象以及微环境的变化。Trp残基不但对微环境变化非常敏感,而且它在大部分蛋白质中的数量均较多,因此,往往选用Trp残基作为酶分子的内源性荧光探针,来反映处于不同环境下酶分子构象和微环境变化的信息。在淀粉酶退浆过程中,浆料组分中PVA/PAA的存在对淀粉酶的酶活、构象等有何影响,目前尚无相关文献报道。为此,本文研究了PVA/PAA对α-淀粉酶的活性、内源性荧光及二级结构的影响。
1 材料与方法
1.1 材料及仪器
玉米原淀粉,山东邹平天美纺织助剂有限公司;PVA-1799、PAA均为工业品,江苏联发纺织股份有限公司;α-淀粉酶(诺维信中温α-淀粉酶),酶活120000 U/mL,上海诺维信生物技术有限公司;3, 5-二硝基水杨酸、氢氧化钠、甘油、磷酸氢二钠、磷酸二氢钠、三氯乙酸,均为分析纯,国药集团化学试剂有限公司。
UV-2802S紫外可见分光光度计,上海尤尼科仪器有限公司;F-4600荧光分光光度计,日本HITACHI公司;DOS-450圆二色谱仪,法国Bio-Logic公司。
1.2 实验方法
1.2.1 α-淀粉酶活力测定
α-淀粉酶的活力采用DNS比色法测定[9]。1 mL适当浓度的酶液在60 ℃、pH值6的条件下,1 min分解产生1 μmol还原糖为一个活力单位(1 U)。在不同PVA、PAA浓度时测定α-淀粉酶的活力,PVA的浓度分别为5%、15%和25%,PAA的浓度分别为1.5%、2%和2.5%,以未加PVA、PAA的α-淀粉酶活力为100%。
1.2.2 荧光光谱的测定
在α-淀粉酶的0.1 M磷酸盐缓冲溶液中分别加入不同浓度的PVA或PAA溶液,PVA的浓度分别为5%、15%和25%,PAA的浓度分别为1.5%、2%和2.5%,混合均匀,25℃下以280 nm为激发波长,记录300~400 nm波长范围内的发射光谱。荧光发射谱的背景散射用缓冲溶液校正。
1.2.3 圆二色谱的测定
在α-淀粉酶的0.1 M 磷酸盐缓冲溶液中分别加入不同浓度的PVA或PAA溶液,PVA的浓度分别为5%、15%和25%,PAA的浓度分别为1.5%、2%和2.5%,α-淀粉酶的浓度为0.01 g/L,混合均匀后,在25 ℃和氮气保护下于190~260 nm范围内扫描圆二色谱。圆二色谱用平均残基摩尔椭圆度表示,单位为deg·cm2/dmol,二级结构的计算采用K2D方法。
2 结果与讨论
2.1 PVA/PAA对α-淀粉酶活性的影响
在α-淀粉酶水解体系中,分别加入不同浓度的PVA或PAA,其酶活性变化如图1和图2所示。

图1 不同浓度PVA对α-淀粉酶活性的影响

图2 不同浓度PAA对α-淀粉酶活性的影响
从图1、图2可以看出,PVA或PAA均使得α-淀粉酶的活性降低,且PVA或PAA的浓度越高,酶活性降低越多。这可能是PVA或PAA会使得酶分子的空间构象发生扭曲,使酶活性逐渐降低。为了进一步研究α-淀粉酶活性降低的原因,本文分别采用荧光色谱法和圆二色谱法研究了PVA/PAA对α-淀粉酶内源性荧光及对酶二级结构的影响。
2.2 PVA/PAA对α-淀粉酶内源性荧光的影响
PVA/PAA的浓度对α-淀粉酶的内源性荧光的影响如图3和图4所示。
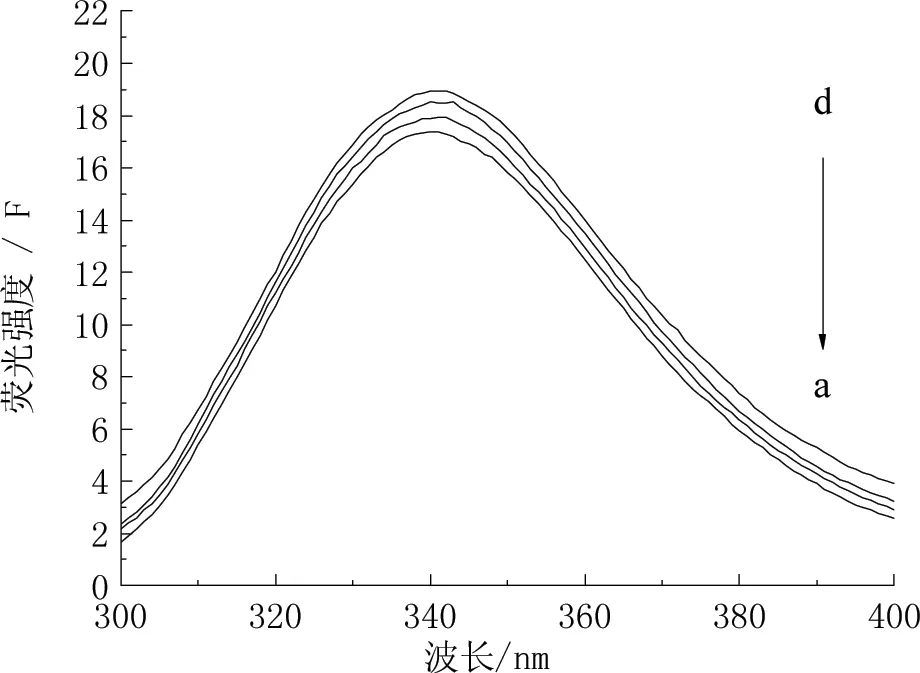
图3 PVA浓度对α-淀粉酶内源性荧光的影响
a-d: PVA的浓度依次为0%、5%、15%和25%。

图4 PAA浓度对α-淀粉酶内源性荧光的影响
a-d: PAA的浓度依次为0%、1.5%、2%和2.5%。
由图3可知,PVA浓度的增强使得α-淀粉酶的内源性荧光强度也会稍有增强。这一现象表明可能是PVA使α-淀粉酶芳香氨基酸残基周围环境的极性减小[10],或者是α-淀粉酶的空间结构由于PVA的作用而变得松散,使得原处于淀粉酶分子内疏水腔中的色氨酸(Trp)暴露在α-淀粉酶分子的表面,进而荧光强度增强[11]。此外,在PVA溶液中,色氨酸残基的吲哚基团上的-N-H可能会与PVA分子中带有的羟基形成分子间氢键,使得荧光体的结构刚性增强,受激发后产生π→π*跃迁,荧光量子效率增大,荧光增强[11]。由图4可知,PAA的浓度越大,荧光强度的减弱程度越为明显,由此可知,PAA对淀粉酶有荧光猝灭作用,分析原因可能是Trp残基所处微环境的极性增大,使Trp残基在溶剂环境中暴露程度降低[12]。此外,随着PVA或PAA浓度的增加,最大吸收波长(λmax)均发生红移,由最大波长337 nm红移至340 nm,说明PVA或PAA的作用使得α-淀粉酶部分肽键间疏水作用减弱,肽键羰基n→π*跃迁能量减少,肽键伸展[7]。由此可见,PVA或PAA的存在会使得α-淀粉酶分子中色氨酸残基的微环境发生改变,使α-淀粉酶活性降低。
2.3 PVA/PAA对α-淀粉酶二级结构的影响
酶活性变化通常伴随着酶的二级结构和活性构象的改变。圆二色谱(CD光谱)是分析蛋白质二级结构常用的工具[13-15],可以准确地检测到二级结构的变化信息。PVA、PAA对α-淀粉酶二级结构的影响如图5和图6所示。从图5和图6可以看出,PVA或PAA的存在,改变了α-淀粉酶的次级结构组成,具体体现在α-螺旋、β-折叠和无规则卷曲的质量组成均发生变化,且随着PVA或PAA浓度的增加,α-螺旋、β-折叠和无规则卷曲的质量组成的变化越明显。

图5 PVA浓度对α-淀粉酶二级结构的影响
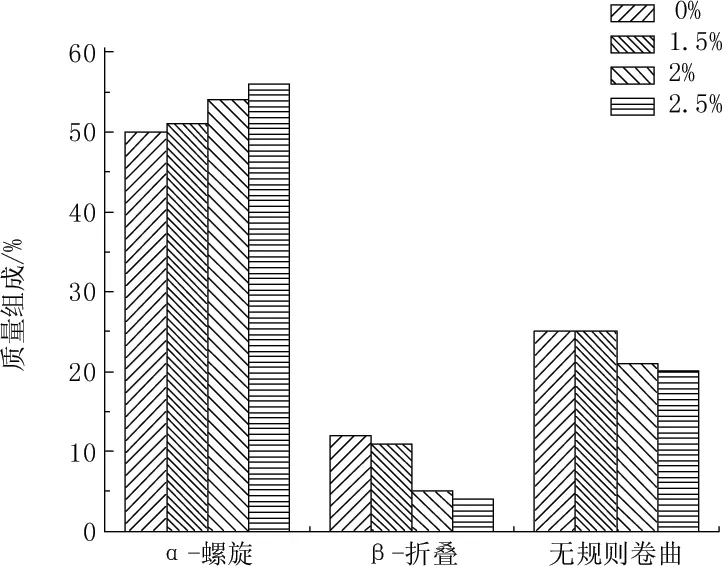
图6 PAA浓度对α-淀粉酶二级结构的影响
一个由8个α-螺旋和8个β-折叠交替出现形成的(β/α)8桶形结构组成了α-淀粉酶的催化区域(CD),由此可知,α-淀粉酶是α/β结构模体的酶。酶的天然构象以及酶的特定功能域对酶的活性保持十分重要,而酶的特定功能域的形成以及酶的构象的变化又与适当的α-螺旋含量和一定的α/β比率密切相关[15]。图5中α-淀粉酶的α-螺旋的含量会随着PVA含量的增加而逐渐减小,而当α-螺旋度的构象过小时,可能会使酶蛋白质的氢键结构和其他结构遭到破坏而产生酶结构不可逆的变化。图6中随着PAA含量的增加,α-螺旋的含量也在逐渐增大,由于α-螺旋结构紧密的特殊性,酶的构象中α-螺旋过大,则不利于酶形成活性中心,从而使底物不能与之结合,使酶活性丧失[16]。此外,α-淀粉酶的天然构象与α/β的比率也密切相关,特定的α/β 比率决定天然构象。图7、图8分别表示了PVA和PAA对α-淀粉酶α-螺旋/β-折叠比率的影响。
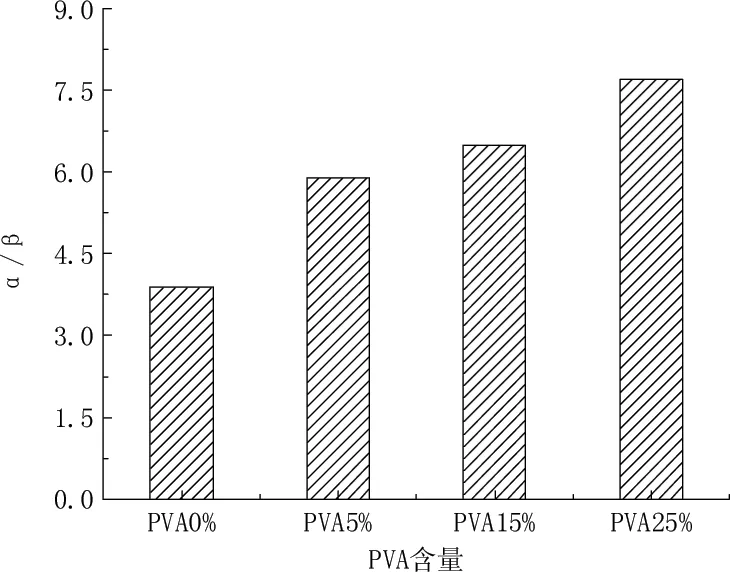
图7 PVA含量对α-淀粉酶二级结构中α-螺旋/β-折叠比率的影响

图8 PAA含量对α-淀粉酶二级结构中α-螺旋/β-折叠比率的影响
结合图1、图2可知,PVA或PAA的浓度越大,α-淀粉酶的相对酶活越低,α-螺旋/β-折叠比率变化越大。酶分子的折叠或去折叠会随着α/β的比率变化而变化,α/β的比率变化越大,折叠或去折叠的变化就会越大,总体上就会呈现出越多的错误折叠,最终不能形成酶的天然构象,从而使酶失去应有的活性,即酶的天然构象改变越多,活性中心或是键合位点就越少,酶的活性就越低[16]。
3 结论
PVA和PAA均能使α-淀粉酶的活性降低,并能改变α-淀粉酶的内源性荧光和二级结构,且PVA和PAA的浓度越高,酶活性越低,酶的内源性荧光和二级结构的变化越大。
参考文献:
[1]范雪荣, 顾蓉英, 王 强.聚丙烯酸浆料对淀粉浆液浆膜性能的影响[J]. 纺织学报, 2004, 25(2): 37-39.
[2]Chand N, Nateri A S, Sajedi R, et al. Enzymatic desizing of cotton fabric using a Ca2+-independent α-amylase with acidic pH profile[J]. Journal of Molecular Catalysis B: Enzymatic, 2012, 83: 46-50.
[3]Sharma A, Satyanarayana T. Cloning and expression of acid stable, high maltose-forming, Ca2+-independent α-amylase from an acidophileBacillusacidicolaand its applicability in starch hydrolysis[J]. Extremophiles, 2012, 16: 515-522.
[4]Combes D, Graber M, Ye W N. Stabilizing effect of polyhydric alcohols[J]. Annals of the New York Academy of Sciences, 1990, 613: 559-563.
[5]Tanaka A, Hoshino E. Thermodynamic and activation parameters for the hydrolysis of amylose with Bacillus α-amylase in a diluted anionic surfactant solution[J]. Journal of Bioscience and Bioengineering, 2002, 93: 485-490.
[6] Hirai M, Kawai-Hirai R, Hirai T, et al. Structural change of jack bean urease induced by addition of surfactants studied with synchrotron-radiation small-angle X-ray scattering[J]. European Journal of Biochemistry, 1993, 215: 55-61.
[7]王 峰, 梁力曼, 顾正彪, 等. 聚乙二醇、聚乙烯胺与淀粉酶相互作用荧光光谱[J]. 应用化学, 2010, 27(1): 96-100.
[8]Boeris V, Farruggia B, Nerli B, et al. Protein-flexible chain polymer interactions to explain protein partition in aqueous two-phase systems and the protein-polyelectrolyte complex formation[J]. International Journal of Biological Macromolecules, 2007, 41: 286-294.
[9]Decker L A. Worthington enzyme manual[M]. New Jersey : Worthington Bioghhemical Corporation, 1977.
[10]Konsula Z, Liakopoulou K M. Hydrolysis of starches by the action of an α-amylase fromBacillussubtilis[J]. Process Biochemistry, 2004, 39(11):1745-1749.
[11]潘宏程, 蒋治良, 袁伟恩, 等. 人血清蛋白-丙酮(乙醇)体系的荧光光谱及共振散色光谱特性[J]. 应用化学, 2003, 20(7): 661-663.
[12]Efink M R. In protein fluorescence[M]. New York: Kluwer Academic Publishers, 2002: 1.
[13]Johnson W C. Analyzing protein circular dichroism spectra for accurate secondary structures [J]. Protein, 1999, 35: 307-312.
[14]Adler A J, Greenfield N, Fasman G D. Complexes of deoxyribonucleic acid with lysine-rich (f1) histone phosphorylated at two separate sites: circular dichroism studies[J]. Arch Biochem Biophys, 1972, 153(2):769-777.
[15]Chen Y H, Yang J T, Martinez H M. Determination of the secondary structures of proteins by circular dichroism and optical rotatory dispersion[J]. Biochemistry, 1972, 11(22):4120-4131.
[16]沈 琼, 黄 滨, 邵嘉量, 等. 运用圆二色谱研究酶与化合物相互作用的机理[J]. 中山大学学报, 2006, 45(4): 62-64.

