紫色马铃薯类黄酮3′, 5′-羟化酶基因(StF3′5′H)的克隆及分析
李 军, 龚一富, 胡朝阳, 王何瑜
(宁波大学海洋学院 教育部应用海洋生物技术重点实验室, 浙江 宁波 315211)
花青素,作为一种重要的植物类黄酮类色素,是植物体内重要的次生代谢产物,对植物自身生理活动具有许多重要的生物学功能,如赋予植物、花卉及水果紫色、红色及蓝色等鲜艳的颜色,吸引昆虫帮助植物传播花粉,保护植物免受紫外线的伤害[1]以及抵御病源微生物的入侵[2]。紫色土豆花青素具有很强的抗氧化性[3],具有清除氧自由基[4]、抗炎和抗癌[5]等作用,目前已作为一种天然保健品而广受关注。类黄酮3′,5′-羟化酶(flavonoid 3′,5′-hydroxylase, F3′5′H)作为细胞色素P450酶(cytochrome P450, CYP)家族的成员[6],是花青素生物合成途径中的一个关键酶, 紫色土豆中F3′5′H基因的克隆及分析研究将对揭示F3′5′H蛋白在紫色土豆花青素合成中的作用具有重要理论意义,可为开展紫色土豆花青素代谢工程奠定理论基础。目前,已从茄子(Daturastramonium)[7]、矮牵牛(Pctuniahybrida)[8-9]、洋桔梗(Eustomagrandiflorum)[10]、番茄(Solanumlycopersicum)[11]、箭叶淫羊藿(Epimediumsagittatum(Sieb.etZucc.)Maxim.)[12]、非洲紫罗兰(SaintpauliaionanthaH.Wendl.)[13]、野生大豆(Glycinesoja)[14]、山葡萄(VitisamurensisRupr)[15]等植物中克隆了F3′5′H基因序列。目前NCBI网站上已公布至少38种植物约58条F3′5′H基因序列[16]。许多研究表明,花青素生物合成受到外界因素的调控,如干旱、低温、强光、低氮、芸苔素、赤霉素、蔗糖等[17-21]。但目前紫色土豆花青素合成途径中的F3′5′H基因的分离及鉴定研究国内外未见报道,且目前关于植物花青素生物合成的相关基因表达、信号转导及调控的研究主要集中在花上,但对于块茎等其他部位的花青素积累鲜有报道。紫色土豆生长在地下,紫色土豆花青素的合成和积累的调控研究将填补地下花青素积累机制的空白,对探明地下部分花青素积累的分子机制研究提供基础和参考,因此,本研究拟克隆紫色土豆StF3′5′H基因序列,并研究赤霉素和蔗糖等因子对紫色土豆花青素含量的影响,并通过测定StF3′5′H基因表达来探讨花青素积累的机理,为下一步更全面更深入开展地下部分花青素积累的分子机制提供参考。
1材料与方法
1.1 紫色土豆F3′5′H基因cDNA序列的克隆
本研究所用紫色土豆试管苗由宁波大学海洋学院植物组织培养实验室培养并保存。紫色土豆总RNA提取采用BIOZOL法(BioFlux,日本),cDNA第一链的合成采用AMV反转录酶(TaKaRa,日本),合成的第一链cDNA混合物作为扩增紫色土豆F3′5′H基因核心序列的模板。分析其他植物F3′5′H基因核苷酸序列,设计一对简并引物StF3′5′H-F和StF3′5′H-R (表1),用于StF3′5′H核心序列的扩增。
根据测序结果,分别设计扩增5′-UTR和3′-UTR的引物:StF3′5′H 5-1 和StF3′5′H 5-2 以及StF3′5′H 3-1 和StF3′5′H 3-2 (表1),按照RACE试剂盒 (Clontech, USA)说明书进行5′-RACE和3′-RACE扩增。PCR扩增测序后用Vector NTI Suite 8.0软件拼接出StF3′5′H基因的cDNA全长序列。用StF3′5′H-F (表1)和oligo(dT)17为引物,使用one-step RT-PCR Kit (TaKaRa, 日本) 进行cDNA全长克隆,验证已获得的序列。

表1 StF3′5′H基因的引物序列
1.2 StF3′5′H基因的生物信息学分析
应用Vector NTI Suite 8.0软件的ASSEMBLE程序拼接紫色土豆F3′5′H基因的核心片段序列、5′末端序列和3′末端序列,得到紫色土豆F3′5′H基因的cDNA全长序列;利用ProtParam (http://expasy.org/tools/protparam.html)程序预测StF3′5′H蛋白的理论等电点和分子量。利用Vector NTI Suite 8.0软件包中的Align X程序对紫色土豆F3′5′H蛋白序列与其它植物的F3′5′H蛋白序列进行多重序列比对;使用Clustal X软件和MEGA 5.0中的Neighbor-Joining(临位相连法)构建紫色土豆F3′5′H蛋白和其它植物F3′5′H蛋白序列的系统发生进化树。
1.3 StF3′5′H基因组成型表达分析
分别提取紫色土豆块茎、根、茎、叶柄、叶轴和叶片的RNA,以及蔗糖和赤霉素处理24 h后的紫色土豆试管苗RNA。设计一对特异性引物StF3′5′H-F1和StF3′5′H-R1,选用actin为内参,引物序列为actinF 和 actinR (表1),按one-step RT-PCR试剂盒说明书进行PCR扩增,扩增循环数为28个。PCR产物于用1%琼脂糖凝胶电泳分离PCR产物,然后密度扫描分析产物条带。
1.4 不同浓度蔗糖和赤霉素对紫色土豆花青素含量的影响
将长势健壮且大小基本相同的试管小苗分别移栽到添加有不同浓度蔗糖或赤霉素的MS培养基中培养,蔗糖浓度设置5个梯度,分别是0 g/L、15 g/L、30 g/L、60 g/L和120 g/L。赤霉素设置5个梯度,其浓度分别是0 mg/L、0.5 mg/L、1.0 mg/L、2.0 mg/L和4.0 mg/L,培养30 d后剪取紫色土豆试管苗,测定其花青素含量。花青素含量测定方法为:精确称取0.1 g紫色土豆试管苗,加石英砂充分研磨后加入10 mL含0.1% HCl的酸性乙醇,在28℃提取18 h,然后10 000 r/min离心10 min,吸取上清,用可见光分光光度计分别测定530 nm和657 nm下样品的吸光值A530和A657,花青素含量计算公式为:Q=A530-0.25A657(mg/g·FW)[22]。
2 结果与分析
2.1StF3′5′H基因cDNA全长序列
采用RACE技术扩增得到StF3′5′H基因核心片段、5′末端序列和3′末端序列,拼接得到StF3′5′H基因的cDNA全长为1854 bp(图1)。ORF分析表明,StF3′5′H基因ORF长为1530 bp,ORF两端分别含有239 bp 3′UTR和85 bp 5′UTR,共编码509个氨基酸,预测编码产物分子量大小为56.95 kD,等电点(pI)为8.31。
2.2StF3′5′H基因生物信息学分析
使用BlastP (http://www.ncbi.nlm.nih.gov) 以及Vector NTI Suite 8.0 软件对StF3′5′H cDNA核苷酸序列及其编码的蛋白质进行相似性分析,结果表明,紫色土豆F3′5′H的cDNA序列与其它种土豆(AY675558.1和AY675561.1)、番茄(AK328022.1)、蓝花茄(AF313490.1)和茄子(X70824.1))的相似度分别为97%、94%、90%和89%。紫色土豆F3′5′H蛋白的氨基酸序列与其它被子植物的F3′5′H蛋白具有较高的相似性,与番茄(Solanumlycopersicum)、瓜叶菊(Pericalliscruenta)、长春花(Catharanthusroseus)、葡萄(Vitisvinifera)和仙客来(Cyclamenpersicum)的氨基酸相似性分别为94%、86%、76%、75%和75%,表明所克隆的序列为植物F3′5′H家族成员。同源性分析显示(图2),紫色土豆F3′5′H蛋白与其它物种中F3′5′H蛋白的保守结构域基本保持一致,这些氨基酸的序列差异主要体现在N端,其中部和C端序列高度保守。
使用Clustal X软件和MEGA5.0软件分析植物F3′5′H蛋白的系统进化(图3)。结果表明,紫色土豆F3′5′H蛋白与其它品种土豆、山葡萄、葡萄及仙客来的F3′5′H蛋白亲缘关系较近,聚为一类。
2.3 StF3′5′H基因组织表达差异性

图1 土豆StF3′5′H的核苷酸序列及推导的氨基酸序列
Fig 1 cDNA sequence and predicted amino acid sequence of StF3′5′H
加粗、下划线表示起始密码子(ATG);加粗、斜体表示终止密码子(TGA);阴影部分表示poly (A)尾巴;双下划线表示预测的poly (A)尾巴加尾信号。
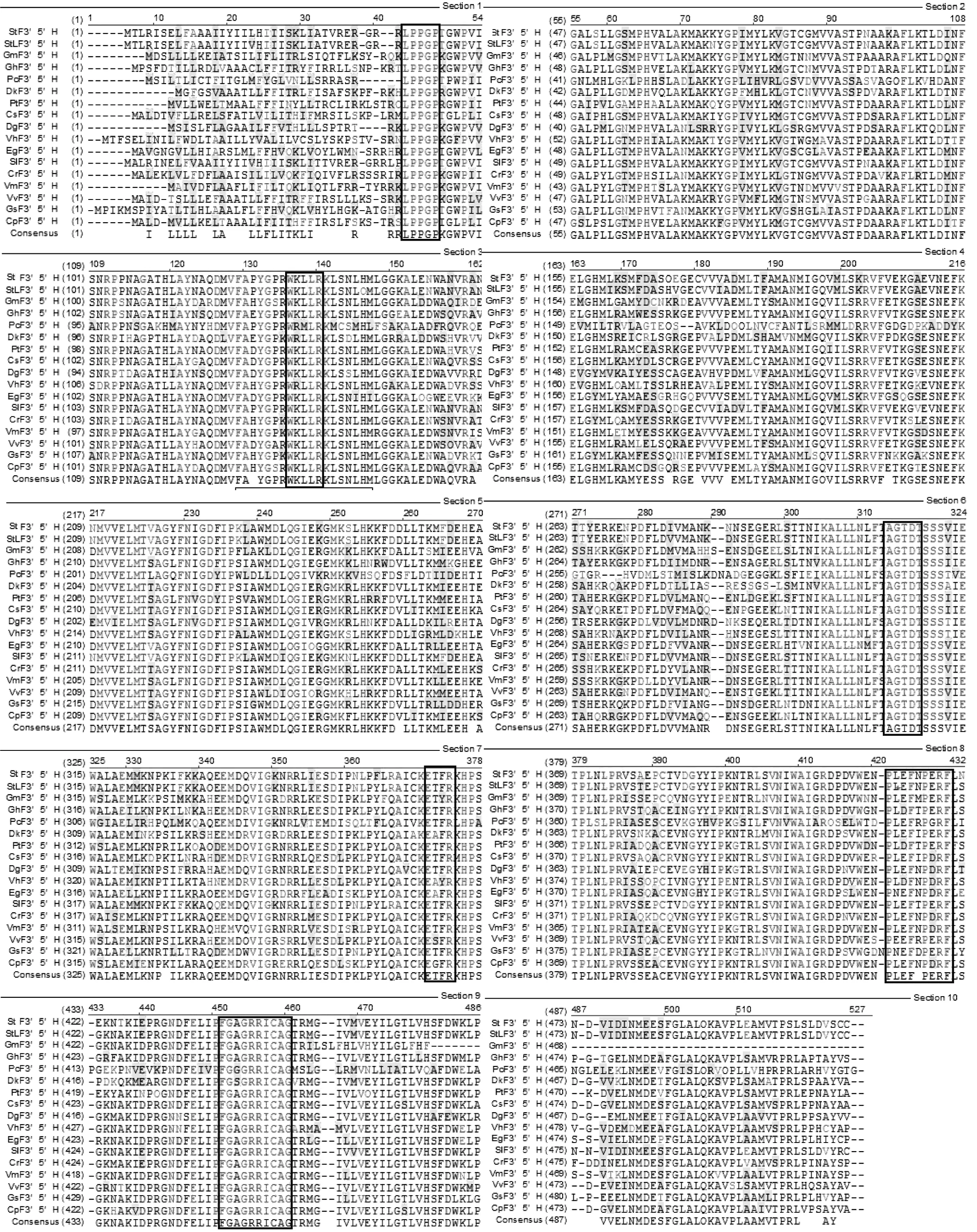
图2 紫色土豆F3′5′H与其它F3′5′H的氨基酸序列比对Fig 2 Alignment of deduced amino acid sequences of StF3′5′H with other F3′5′H proteinsMotifs are boxed;StF3′5′H: 紫色土豆 Purple Solanum tuberosum; StLF3′5′H: 土豆Solanum tuberosum L; GmF3′5′H: 大豆Glycine max; GhF3′5′H: 陆地锦Gossypium hirsutum; PcF3′5′H: 瓜叶菊Pericallis cruenta; DkF3′5′H: 柿子Diospyros kaki; PtF3′5′H: 毛果杨populus trichocarpa; CsF3′5′H: 茶树Camellia sinensis; DgF3′5′H: 大花飞燕Delphinium grandiflorum; VhF3′5′H: 美女樱Verbena hybrida; EgF3′5′H: 洋桔梗Eustoma grandiflorum; SlF3′5′H: 番茄Solanum lycopersicum; CrF3′5′H: 长春花Catharanthus roseus; VmF3′5′H: 蔓长春花Vinaca major Linn; VvF3′5′H: 葡萄Vitis vinifera; GsF3′5′H: 野生大豆Glycine soja; CpF3′5′H: 仙客来Cyclamen persicum.
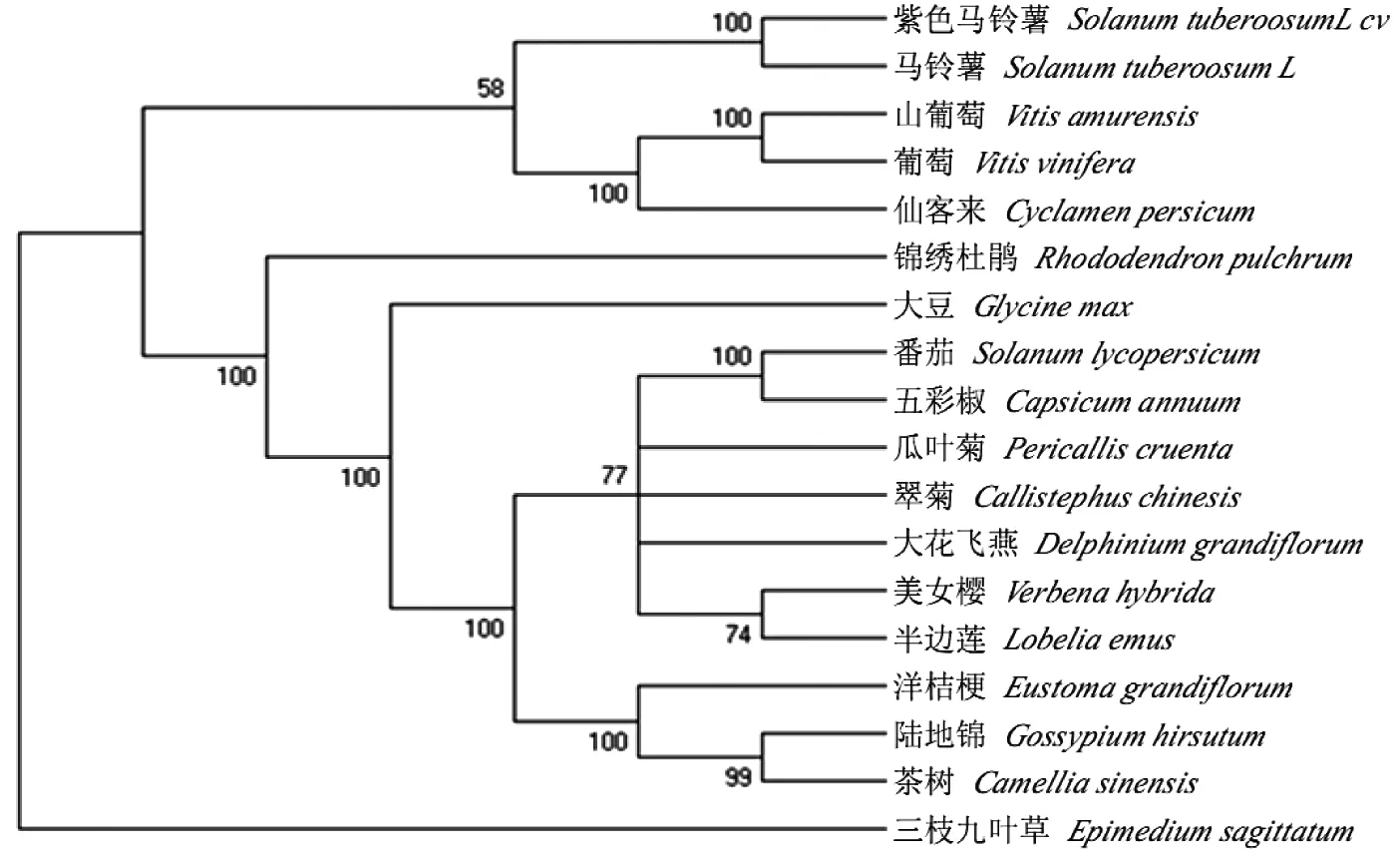
图3 F3′5′H蛋白家族系统进化树
Fig 3 Molecular phylogenetic tree of the deduced amino
acid sequences of F3′5′H family members

图4 紫色土豆F3′5′H基因组织表达分析
采用半定量RT-PCR技术分析StF3′5′H基因在紫色土豆不同组织中(块茎、根、茎、叶柄、叶轴和叶片)的表达情况。结果表明(图4),StF3′5′H基因在不同组织中表达存在差异性,StF3′5′H基因在根、茎和叶柄中表达量较高,其中叶柄表达量最高,根次之,茎最低。而StF3′5′H基因在块茎、叶轴和叶片中几乎检测不到。
2.4 赤霉素和蔗糖对紫色土豆花青素积累和StF3′5′H基因表达的影响
研究不同浓度赤霉素对紫色土豆花青素积累和StF3′5′H基因表达的影响,结果表明(图5A),随着赤霉素浓度的增加,紫色土豆花青素含量呈先上升后下降的趋势,赤霉素处理组花青素含量均显著高于未处理对照组,说明赤霉素能促进紫色土豆花青素的积累。当赤霉素浓度为1.0 mg/L时,紫色土豆花青素含量达到最大值,为2.90 mg/g·FW,约为未处理对照组的2.4倍。StF3′5′H基因表达分析表明(图5A),不同浓度赤霉素处理组StF3′5′H基因表达量均显著高于未处理组,表明赤霉素能诱导StF3′5′H基因表达,但不同浓度赤霉素处理组间StF3′5′H基因表达量差异不显著,与花青素含量不成正相关。
研究不同浓度蔗糖对紫色土豆花青素积累和StF3′5′H基因表达的影响,结果表明(图5B),随着蔗糖浓度的增加,紫色土豆花青素含量呈逐渐上升的趋势,蔗糖处理组花青素含量均显著高于未处理对照组,说明蔗糖能显著促进紫色土豆花青素的积累。当蔗糖浓度为120 g/L时,紫色土豆花青素含量达到最大值,为4.8 mg/g·FW,约为未处理对照组花青素含量的7.1倍。StF3′5′H基因表达分析表明(图5B),不同浓度蔗糖处理组StF3′5′H基因表达量均显著高于未处理组,表明蔗糖能显著诱导StF3′5′H基因的表达,当蔗糖浓度为120 g/L时,StF3′5′H基因表达量最高。比较不同浓度蔗糖处理条件下紫色土豆StF3′5′H基因表达量和花青素含量之间的相关性,结果表明,StF3′5′H基因表达量越高,花青素含量就越高,StF3′5′H基因表达越低,花青素含量也较低,StF3′5′H基因表达量与花青素积累之间呈正相关,表明StF3′5′H基因是紫色土豆花青素生物合成途径中的关键酶。
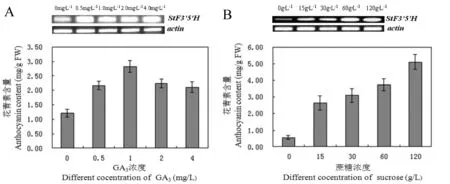
图5 诱导剂(GA3和蔗糖)诱导(24 h)下的StF3′5′H基因表达和花青素积累Fig 5 Expression profiles of StF3′5′H and anthocyanin accumulation after induced by elicitors (GA3 and sucrose)
A—不同浓度赤霉素处理24 h后StF3′5′H的表达及花青素的积累;B—不同浓度蔗糖处理24 h后StF3′5′H的表达及花青素的积累。
3讨论
植物生长调节物质赤霉素对植物的生长发育(如种子的萌发、茎的伸长、花的发育等)以及花青素的积累具有重要调节作用[23]。赤霉素是否对花青素积累具有促进作用,前人有两种截然不同的观点,有的研究表明赤霉素促进花青素的积累,而部分研究者的结果表明赤霉素抑制花青素的生物合成。前人研究表明,赤霉素对非洲菊[24]、玫瑰花[25]、长春花[26]、莲雾[27]等花器官中花青素的积累具有促进作用,而赤霉素对草莓果实[28]、玉米叶片[29]和低光照下生长的拟南芥[30]等非花器官中花青素的积累具有抑制作用。本研究结果表明,赤霉素能显著促进紫色土豆非花器官花青素的积累,与前人在花器官中得出的结论一致,但与非花器官中得出的结论相反,说明赤霉素对紫色土豆与草莓、玉米等植物花青素积累的机制可能不一样。
蔗糖不仅可以作为植物生长发育的能源物质,同时还可以作为信号传导物质,在植物生命周期的各个阶段起到初级信使的作用[31-33]。前人研究表明,蔗糖能诱导花青素生物合成途径中相关基因的表达,并促进植物花青素的积累,如蔗糖促进了矮牵牛[34]、拟南芥等[35]花青素含量的积累及其合成基因的表达。本研究表明,蔗糖能显著促进紫色土豆花青素生物合成基因的表达及其含量的积累,且花青素积累与合成基因表达呈正相关,这与前人研究结论一致,说明赤霉素是通过诱导花青素生物合成基因的表达来促进花青素的积累的。蔗糖是如何通过调控花青素生物合成基因表达,或者是否调控其它途径,如离子通道、ROS等,目前还不清楚。蔗糖调控花青素积累涉及到复杂的代谢网络,为了更好地理解和弄清楚蔗糖调控花青素生物合成的分子机制,可以采用转录组学、蛋白组学和代谢组学技术进一步探究花青素生物合成调控分子机制。
4 结论
从紫色土豆中克隆得到花青素合成关键基因F3′5′H,该基因的cDNA全长1854 bp,包含1530 bp ORF、编码509个氨基酸。该基因推测编码的氨基酸与其它植物的F3′5′H蛋白相似性很高。半定量RT-PCR分析表明StF3′5′H基因在不同组织中的表达具有差异性,结果表明该基因在根、茎和叶柄中的表达量较高,其中在叶柄中表达最强,而在块茎、叶轴中和叶片中几乎检测不到StF3′5′H基因的表达。赤霉素和蔗糖都能促进StF3′5′H的表达进而促进花青素的积累,但赤霉素的促进作用在不同浓度组之间差别不大,而蔗糖的促进作用则随着其浓度的增加而不断增加,StF3′5′H基因表达量和花青素含量都不断增加。说明该基因可能参与调控紫色土豆中花青素的合成。
参考文献:
[1]Cain C C, Saslowsky D E, Walker R A, al. Expression of chalcone synthase and chalcone isomerase proteins inArabidopsisseedling expression of chalcone synthase and chalcone isomerase proteins inArabidopsisseedlingsgs[J]. Plant Molecular Biology, 1997, 35: 377 381.
[2]Dixon R A, Paiva N L. Stress-induced phenylpropanoid metabolism[J]. Plant Cell, 1995, 7(7): 1085-1097.
[3]Potapovich A I, Kostyuk V A. Comparative study of antioxidant properties and cytoprotective activity of flavonoids[J]. Biochemistry (Moscow), 2003, 68: 514-519.
[4]Pignol B, Etienne A, Crastes de Paulet A, et al. Role of flavonoids in the oxygen-free radical modulation of immune response[J]. Progress in Clinical and Biological Research, 1988, 280: 173-182.
[5]Middleton E, Kandaswami C, Theoharides T C. The effects of plant flavonoids on mammalian cells: implications for inflammation, heart disease, and cancer[J]. Parmacological Rviews, 2000, 52: 673-751.
[6]Werck-Relchhart D, Feyereisen R. Cytochromes P450: a success story[J]. Genome Biology, 2000, 1(6): 30031-30039.
[7]Toguri T, Umemoto N, Kobayashi O, et al. Activation of anthocyanin synthesis genes by white light in eggplant hypocotyls tissues. And identification of an inducible P-450 cDNA[J]. Plant Molecular Biology, 1993, 23: 933-946.
[8]Toguri T, Azuma M, Ohtani T. The cloning and characterization of a cDNA encoding a cytochrome P450 from the flowers ofPctuniahybrida[J]. Plant Science, 1993, 94: 119-126.
[9]Holton T, Brugliera F, Lester D R, et al. Cloning and expression of cytochrome P450 genes controlling flower colour[J]. Nature, 1993, 366(18): 276-279.
[10]Nielsen K M, Podivinsky E. cDNA cloning and endogenous expression of flavonoid 3′5′-hydroxylase from petals of Lisianthus (Eustomagrandiflorum)[J]. Plant Science, 1997, 129: 167-174.
[11]Jung C S, Griffiths H M, De Jong D M, et al. The potatoPlocus codes for flavonoid 3′,5′-hydroxylase[J]. Theoretical and Applied Genetics, 2005, 110: 269-275.
[12]Huang W, Sun W, Wang Y. Isolation and molecular characterisation of flavonoid 3′-hydroxylase and flavonoid 3′, 5′-hydroxylase genes from a traditional Chinese medicinal plant,Epimediumsagittatum[J]. Gene, 2012, 497(1): 125-130.
[13]Sato M, Kawabe T, Hosokawa M, et al. Tissue culture-induced flower-color changes in Saintpaulia caused by excision of the transposon inserted in the flavonoid 3′, 5′ hydroxylase (F3′5′H) promoter[J]. Plant Cell Rep, 2011, 30 (5): 929-939.
[14]Takahashi R, Morita Y, Nakayama M, et al. An active CACTA-family transposable element is responsible for flower variegation in wild soybeanGlycinesoja[J]. Plant Genome, 2012, 5: 62-70.
[15]刘海峰, 付 阳, 王 军. 山葡萄中类黄酮3′5′-羟化酶基因(F3′5′H)cDNA的克隆和分析[J]. 延边大学农学学报, 2013, 35(1): 1-5.
[16]陈啸天, 高丽萍, 赵 磊, 等. 茶树类黄酮3′5′-羟化酶在大肠杆菌的表达和优化[J]. 安徽农业大学学报, 2012, 39(5): 707-713.
[17]宋 明, 孙梓健, 汤青林, 等. 环境胁迫下大头芥花青素积累及其相关结构基因的表达[J]. 中国蔬菜, 2012, 6: 27-34.
[18]刘荣直. 光信号和GAs在低氮诱导的拟南芥花青素积累中的作用[D]. 兰州: 兰州大学, 2013.
[19]袁利兵. 芸苔素影响细胞分裂素诱导拟南芥花青素积累的研究[D]. 长沙: 湖南农业大学, 2012.
[20]Guo R F, Yuan G F, Wang Q W. Sucrose enhances the accumulation of anthocyanins and glucosinolates in broccoli sprouts[J]. Food Chemistry, 2011, 129: 1080-1087.
[21]胡朝阳, 周友凤, 龚一富, 等. 紫色马铃薯查尔酮合成酶基因(CHS)的克隆及分析[J]. 中国农业科学, 2012, 45(5): 832-839.
[22]Dedaldechamp F, Uhel C, Macheix J J. Enhancement of anthocyanin synthesis and dihydroflavonol reductase (DFR) activity in response to phosphate deprivation in grape cell suspensions[J]. Phytochemistry, 1995, 40: 1357-1360.
[23]Gomi K, Matsuoka M. Gibberellin signalling pathway[J]. Current Opinion in Plant Biology, 2003, 6: 489-493.
[24]吕长平, 陈海霞, 陈 建. 外源GA3对非洲菊舌状花着色的影响[J]. 中国农学通报, 2012, 28(22): 212-215.
[25]Zieslin N, Biran I, Halevy A H. The effect of growth regulation on the growth and pigmentation of ′Baccara′ rose flowers[J]. Plant Cell Physiol, 1974, 15: 341-349.
[26]Ohlsson A B, Berglund T. Gibberellic acid-induced changes in glutathione metabolism and anthocyanin content in plant tissue[J]. Plant Cell Tiss Org, 2001, 64: 77-80.
[27]Moneruzzaman K M, Hossain Abms, Mormaniza O, et al. Growth, yield and quality responses to gibberellic acid (GA3) of appleSyzygiumsamarangensevar jambu air madu fruit grown under field conditions[J]. African Journal of Biotechnology, 2011, 10(56): 11911-11918.
[28]Mart nez G A, Chaves A R, Aón M C. Effect of exogenous application of gibberellic acid on color change and phenylalanine ammonia-lyase, chlorophyllase, and peroxidase activities during ripening of strawberry fruit (FragariaxananassaDuch.)[J]. Journal of Plant Growth Regulation, 1996, 15(3): 139-146.
[29]Kim J S, Lee B H, Kim S H, et al. Response to environmental and chemical signals for anthocyanin biosynthesis in non-chlorophyllous corn (ZeamaysL.) leaf[J]. Jourmal of Plant Biology, 2006, 49: 16-25.
[30]Jiang C F, Gao X H, Liao L L, et al. Phosphate starviation root architecture and anthocyanin accumulation responses are modulated by the gibberellin-DELLA signaling pathway inArabidopsis[J]. Plant Physiol, 2007, 145: 1460-1470.
[31]Smeekens S. Sugar-induced signal transduction in plants[J]. Annual Review of Plant Physiology and Plant Molecular Biology, 2000, 51: 49-81.
[32]Rolland F, Baena-Gonzalez E, Sheen J. Sugar sensing and signaling in plants: conserved and novel mechanisms[J]. Annual Review of Plant Biology, 2006, 57: 675-709.
[33]Rook F, Bevan M W. Genetic approaches to understanding sugar response pathways[J]. Journal of Experimental Botany, 2003, 54: 495-501.
[34]Weiss D. Regulation of flower pigmentation and growth: multiple signalling pathways control anthocyanin synthesis in expanding petals[J]. Physiol Plantarum, 2000, 110: 152-157.
[35]袁利兵, 张 琨, 彭志红, 等. 拟南芥psc1突变体降低蔗糖诱导的花青素积累[J]. 湖南农业大学学报:自然科学版, 2011, 37(2): 139-142.

