蜂猴属(Nycticebus)D-loop控制区和Cyt b基因遗传学研究
朱万龙, 章迪, 高文荣, 王政昆
(云南师范大学生命科学学院, 昆明 650500)
关于蜂猴属(Nycticebus)的属内分类关系一直存在着不同的观点。一些形态学家,如Dao[1],Groves[2],Petter和Petter-Rousseaus[3],Hill[4],Nowak[5],Ma和Wang[6],Groves[7]等支持蜂猴属内存在一至三个物种的观点。根据形态学信息,Petter和Petter-Rousseaus[3],Hill[4],Weisenseel等[8]将蜂猴描述为一个物种,即蜂猴(Ncticebuscoucang)。Bonhote在1907年将倭蜂猴(N.pygmaeus)描述为一个独立的物种[9]。Dao于1960[1]年描述了另一个越南物种,即,间蜂猴(N.intermedius),认为它是体型非常小的倭蜂猴和体型大的蜂猴之间的中间类型,而 Groves[2]研究表明间蜂猴只是倭蜂猴的成体形式。到2001年Groves[10]认为蜂猴属由3个物种组成,即N.coucang,N.pygmaeus和N.bengalensis,而N.coucang又分为3个亚种,即N.coucangcoucang,N.c.menagensis和N.c.javanicus,但是Java亚种的分类地位一直存在争议,Supriatna和Hendras[11]认为Java应该是一个独立的物种,而非N.coucang的亚种,因此认为蜂猴属由4个物种组成。目前最流行的观点是由Ellerman和Morrison-Scott[12]提出的,蜂猴属由两个物种组成,即蜂猴(N.coucang)和倭蜂猴(N.pygmaeus),但是至今为止学者们尚无统一的意见。
然而,以前有关蜂猴属的分类关系主要是集中在形态学上的不同,比如身体大小、皮毛颜色、头骨特征等。由于蜂猴属物种和亚种水平的分类界限不清,使得除了形态学特征以外的其它分类特征具有更重要的价值。近年来,随着分子生物学技术的迅速发展,分子标记技术成为研究种群遗传结构的重要工具,已经渗入到保护生物学、种群遗传学、进化生物学等领域。在哺乳动物的进化研究领域中,线粒体DNA是一种广泛使用的分子标记,其特点是进化速度快、母系遗传和非重组变异等[13]。线粒体DNA中的细胞色素b(Cytb)基因适合于种群水平差异的检测,普遍地用于动物的系统进化和分类研究[14],线粒体控制区(displacement loop region, D-loop),是线粒体基因组中最主要的一段非编码区,适合于检测种群内及种群间的遗传变异[14]。
蜂猴属的蜂猴(Nycticebuscoucang)和倭蜂猴(Ncticebuspygmaeus)都是国家一级保护动物,并且2000年IUCN已将倭蜂猴列为易危物种(vulnerable)[15],并被列入CITES附录Ⅱ。因此,关于蜂猴属(Nycticebus)的遗传多样性研究及其保护亟待进行。本研究测定了蜂猴属(Nycticebus)线粒体DNA 中的D-loop控制区部分序列和细胞色素b基因全序列(1140 bp),旨在探讨蜂猴属内物种之间的进化关系,并对蜂猴属物种的遗传多样性进行分析。
1研究方法
1.1实验动物
实验所用材料来自昆明动物园笼养倭蜂猴和云南大围山自然保护区的粪便样品,然后置于冰箱-20℃冷冻保存。其余部分序列来自GenBank(见表1和表2)。
1.2方法
1.2.1粪便DNA的提取
参考钟华等[16]提出的用预冷的丙酮洗脱可以除去粪便中含有的大量PCR抑制物,并提取倭蜂猴的粪便DNA。
1.2.2引物设计
Cytb基因的引物设计先采用Irwin等[17]报道的哺乳动物细胞色素b通用引物:
L14724:5′-CGAAGCTTGATATGAAAAACCATC GTTG-3′
H15915:5′-CGGAATTCCATTTTTGGTTTACAAGAC-3′
然后再根据已经测出的倭蜂猴Cytb基因序列,利用primer 5.0软件设计倭蜂猴的专一性引物为:
WFHCYTB—F:5′-AGACTCATGACTAACATTCGA-3′
WFHCYTB—R:5′-TAGGGCTGTGTCTTCATTTGAG-3′
D-loop控制区的引物采用Chen等[64]的报道:
L15996 :5′-CTCCACCATGAGTAGCACCCAAAGC-3′
H16498 :5′-CCTGAAGTAGGAACCAGATG-3′
1.2.3PCR扩增
1)用dddH2O将合成的引物稀释为溶度10 pmol/μL备用。
2)取200 μL的PCR小管至于冰盒中,编号备用。
3)Cytb基因和D-loop控制区的引物都先在下面的反应体系中进行扩增,然后再根据结果进行优化,总体积为50 μL 的PCR反应体系各成分如下:ddH2O,38.5 μL;10×PCR Buffer,5 μL;MgCl2(25 mmol/ L),2 μL;dNTP Mixture(10 mmol/L,pH值8.0),1 μL;Primer 1(10 pmol/μL),1 μL;Primer 2(10 pmol/μL),1 μL;Template(10 ng/μL),1 μL;Taq enzyme(4 U/μL),0.5 μL。
4)调整好反应程序,把PCR反应管置于PCR仪上进行扩增,反应条件设定为:94℃预变性5 min;94℃变性1 min,48~55℃退火1 min,72℃延伸1 min,30个循环;72℃延伸10 min;4℃终止反应。
5)反应结束后,将PCR产物放置于4℃待电泳检测或-20℃长期保存。
6)电泳检测:取5 μL PCR产物加入1 μL 6×Loading Buffer,混匀后点样于1.5%琼脂糖凝胶上,稳压100V,电泳50 min,将电泳结果用凝胶成像系统分析并拍照保存。
7)根据电泳检测的结果,如果扩增出较好地目的片段,且没有杂带,那么这对引物的反应条件就不再进行优化;如果未扩增出目的片段或有较多杂带,那么就需要在PCR反应条件的基础上,通过调节退火温度、循环次数、镁离子浓度、dNTP 浓度、Taq酶和模板的浓度进行PCR反应条件的优化,直至得到最佳的PCR效果。
1.2.4 PCR的纯化与测序
PCR 产物用1.5 %的琼脂糖电泳检测,在紫外透射仪上观察,并割下亮带。将割下的胶用Glassmilk DNA 纯化回收试剂盒(北京博大泰克生物基因技术有限责任公司的产品)进行纯化回收,回收产物送大连宝生物工程有限公司测序(测序使用试剂:ABI BigDye3.1;测序仪器:ABI 3730XL)。
1.2.5 统计处理
D-loop控制区部分序列和Cytb基因的测定结果使用DNASTAR软件包的Editseq、Seqman、Megalign软件进行排序分析,将正反两向序列进行核对,并进行人工的检查和校正。用DNASP 4.0计算多态位点以及统计单倍型数目。用MEGA4.0进行初始的序列比较,碱基组成分析和变异计算。利用Mega4.0软件中的邻接法(Neighbor-Joining, NJ)、最大简约法(Maximum Parsimony, MP)和最小进化法(Minimum Evolution, ME)构建的分子系统树,重复抽样1000次[18],3种方法结果一致,因此结果中只显示NJ法构建的系统树。

表1本研究中D-loop控制区所使用的序列
2结果
2.1D-loop控制区和Cytb基因的PCR产物电泳图
D-loop控制区的扩增片段为400 bp左右,Cytb基因的扩增片段为1140 bp左右,结果见图1和图2。
2.2 D-loop控制区序列及其变异情况
测定了来自蜂猴属(Nycticebus)7个个体的样品的mtDNA D-loop 5′ 控制区的部分序列,该序列邻近tRNA-Pro基因,排序后得到的序列长度约为400 bp。其中两条蜂猴序列(编号为Ncou1和Ncou2),连同来自GenBank的孟加拉蜂猴的同源序列(编号为Nben1~Nben9)分析发现了22个变异多态位点,包括11个简约信息多态位点和11个单核苷酸变异位点。多态位点数(S)为22,核苷酸多样性(Pi)为0.01665,平均核苷酸差异数(K)为6.509。而另外的5条倭蜂猴序列(编号为N1~N5)和来自GenBank的倭蜂猴的同源序列(编号为Npgy1~Npgy10)分析发现了9个变异多态位点,包括3个简约信息多态位点和6个单核苷酸变异位点。S为9, Pi为0.00516, K为1.924。
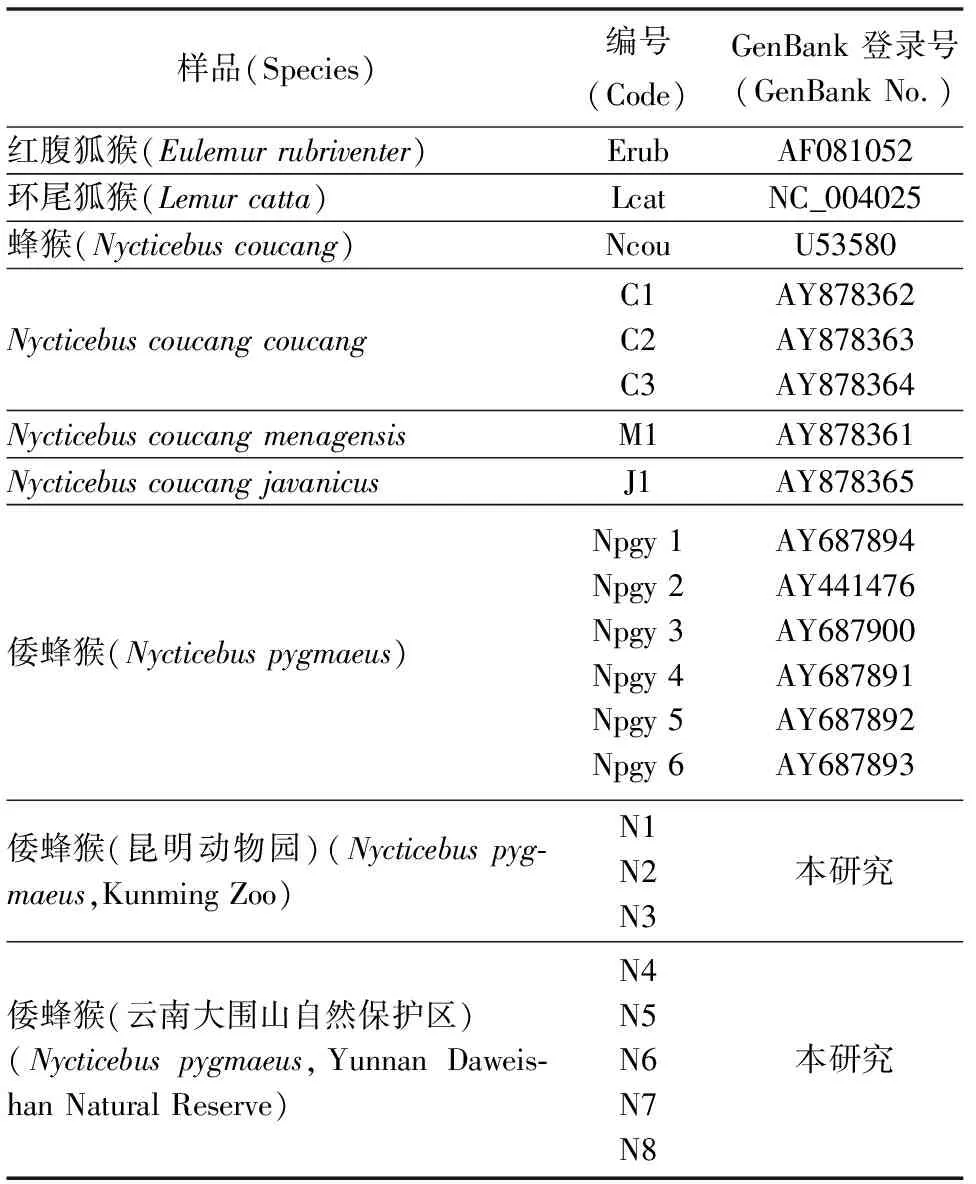
表2 本研究Cyt b基因检测的物种
图1 D-loop控制区基因片段的扩增结果(1.5%的琼脂糖凝胶电泳)
Fig 1 A gene segment amplified from D-loop control region(1.5% agarose gel)
2.3Cytb基因序列及其变异情况
对本研究测定的8个倭蜂猴样本Cytb基因序列(编号为N1~N8)和来自GenBank的倭蜂猴的同源序列(编号为Npgy1~Npgy6)进行多态性统计分析得出S为1,Pi为0.00128,K为0.495,共发现核苷酸变异位点1个,简约信息位点1个,没有发现单核苷酸多态位点。
图2 Cyt b基因片段的扩增结果(1.5% 的琼脂糖凝胶电泳)
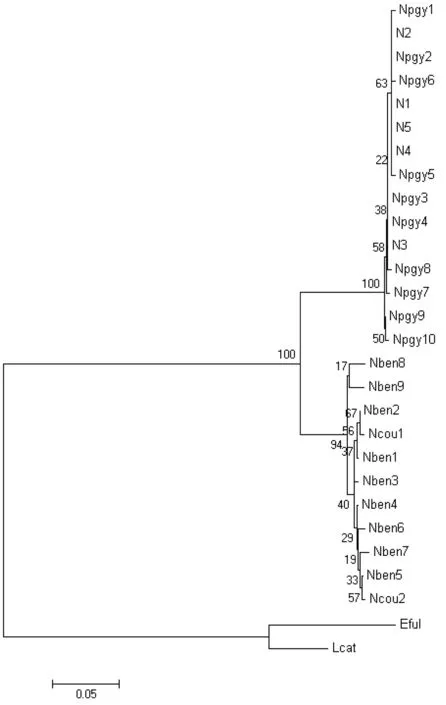
图3 基于线粒体D-Loop控制区构建的NJ树
2.4系统进化树
基于本研究所得到的D-loop控制区序列和在GenBank上所查的序列构建的分子系统树(图3),结果显示,本研究所测定的样品与已报道的倭蜂猴个体聚成一支,证明所测定的样品是真正的倭蜂猴个体。N.bengalensis和N.coucang聚在一个分支。拓扑图还提示,蜂猴属由两支组成,且分支置信度较高,即自举检验值(Bootstrap)为1000次自举检测得到的对该支的支持百分数较高。同样,基于本研究所得到的Cytb基因序列和在GenBank上所查的序列构建的分子系统树(图4),结果显示,蜂猴属的物种主要分为两个类群,本研究得到的8个样品和已报道的倭蜂猴个体聚在一起形成一支,其它的聚为一支,它包括除了倭蜂猴(N.pygmaeus)之外的其它分类单位。而且在后一个进化枝中,又分为两个亚进化枝,其中一支仅由N.coucangjavanicus组成,另一支由N.coucangcoucang,N.coucangmenagensis和N.coucang组成,但是这三者的分辨力不强。

图4 基于线粒体Cyt b基因全序列构建的NJ树
3讨论
3.1 遗传多样性分析
本研究主要基于线粒体DNA中的D-loop控制区和Cytb基因对蜂猴属的遗传多样性进行探讨。基于D-loop控制区部分序列对两条蜂猴序列,连同来自GenBank的孟加拉蜂猴的同源序列遗传变异分析表明,其多态位点数为22,核苷酸多样性为0.01665,平均核苷酸差异数为6.509。而对5条倭蜂猴序列和来自GenBank的倭蜂猴的同源序列分析仅仅发现多态位点数9,核苷酸多样性为0.00516,平均核苷酸差异数为1.924。分析数据表明,虽然倭蜂猴的样本大小相比之蜂猴的样本大小较大,但是倭蜂猴的多态水平反之却比蜂猴的多态水平低得多。假定这两个物种之间具有相似的突变速率,蜂猴的多态水平增加可能由群体的结构特征所产生,也可能由来自其他栖息地群体的可能的基因交流所造成。
3.2 分子系统发育分析
有关蜂猴属内物种之间的分类进化关系一直都没有统一的意见,由于形态学上的相似性导致了其在物种和亚种水平界定上的困难。随着分子生物学的发展,生物进化的研究也从宏观趋向微观。Chen等[19]对蜂猴属的核型进行了研究;Zhang等[20]对蜂猴属的线粒体DNA进行了RFLP分析;Wang等[21]对蜂猴属的核糖体DNA进行了分析研究。到2001年吕雪梅等[22]测定分析了蜂猴属的细胞色素b基因的全序列。本研究基于D-loop控制区部分序列和Cytb基因序列构建的分子系统树(图3和图4)可以看出,本研究测定的倭蜂猴样品与已报道的倭蜂猴个体聚成一支,说明它很可能是真正的倭蜂猴个体。而且无论是基于D-loop控制区部分序列构建的邻接树,还是基于Cytb基因序列构建分子系统树,都清晰地表明这些序列聚成的分支与其它分类支都是分开的,而且分支置信度为100%。因此本研究认为倭蜂猴是完全独立的物种。这与Chen等[23]的观点是一致的。
孟加拉蜂猴最初被命名为N.coucang的一个亚种,但是Groves[7]年将其作为一个独立的物种。根据本研究的系统发育分析,N.bengalensis样本与N.coucang的两个样本也是共同聚成一个进化枝,而且自举检验值较高。因此并不认为孟加拉蜂猴是一个独立的物种。根据Groves[10]的观点,N.coucang包含3个亚种,N.scoucangcoucang,N.c.menagensis和N.c.javanicus,它们之间通过形态学的特征很难完全地辨别区分,而且第3个Java亚种的分类地位一直存在争议,Supriatna和Hendras[11]认为Java亚种应该是一个独立的物种,因此认为蜂猴属由4个物种组成。然而,本研究基于细胞色素b基因序列构建的分子系统树并不支持这一观点,N.c.javanicus虽然首先和其它两个亚种分开,但这3个亚种还是共同聚在一起形成一个亚进化分支。也就表明了N.c.javanicus很可能还是N.coucang的一个亚种,并没有进化形成一个独立的物种。
总之,本研究通过对蜂猴属的D-loop控制区部分序列和细胞色素b基因全序列的分析,结果支持Ratajszczak[9]和Groves[2]的观点,即认为蜂猴属由两个单系群组成:第一群由N.pygmaeus聚成,第二群由N.coucang聚成。该结果也提供了新的分子遗传证据,支持蜂猴属由N.coucang和N.pygmaeus两物种组成。
参考文献:
[1]Dao V T. Sur une nouvelle espece deNycticebusauVuetnam[J]. Zool Anz, 1960, 164: 240-243.
[2]Groves C P. Systematics of the genusNycticebus[C]. Biegert J, Leutenegger W, Proceedings of the Third International Congress of Primatology, Zurich 1970, Vol.1: Taxonomy, Anatomy, Reproduction, 1971, 1: 44-53.
[3]Petter J J, Petter-rousseaux A. Classification of the pxosimians[M]. Doyle G A, Martin R D. The study of Prosimian Behavior, New York: Academic Press, 1979.
[4]Hill W C O. Primates: comparative anatomy and taxonomy I-Strepsirhini [M]. Edinburgh: The Edinburgh University press. 1953.
[5]Nowak R M. Walker′s mammals of the world[M]. Baltimore: The John Hopkins University Press, 1991, 404-406.
[6]Ma S, Wang Y. The recent distribution, status and conservation of primates in China[J]. Acta Theriologica Sinaca, 1988, 8: 250-260.
[7]Groves C. Systematics of Tarsiers and Lorises[J]. Primates, 1998, 39: 23-27.
[8]Weisenseel K, Lzard M K, Nash L T. et al. A comparison of reproduction in two species ofNycticebus[J]. Folia Primatol, 1998, 69: 321-324.
[9]Ratajszczak R. Taxonomy, distribution and status of the lesser slow loris and their implications for captive management[J]. Folia Primatol, 1998, 69: 171-174.
[10]Groves C P. Primate taxonomy[M]. Wanshington: Smithsonian Institute Press. 2001.
[11]Supriatna J, Hendras E. Panduan lapangan primate Indonesia[M]. Jakarta Indonesia: Yayasan Obor Indonesia, 2000.
[12]Ellerman J R, Morrison-Scott T C S. Checklist of Palaearctic and Indian mammals[M]. London: British Museum (Natural History), 1951, 1758-1945.
[13]Bucklin A, Guarnierii, Gillicuddy M. Spring evolution ofPseudocalanus. spp. Abundunce on Georges Bank based on molecular discrimination ofP.moultoniandP.newmani[J]. Deep-Sea Res Part Ⅱ-Top. Stud Oceanogr, 2000, 48: 589-608.
[14]Kochzius M, Blohm D. Genetic population structure of the lionfishPteroismiles(Scorpaenidae, Pteroinae) in the Gulf of Aqaba and northern Red Sea[J]. Gene, 2005, 347: 295-301.
[15]IUCN Red List of threatened species. www.iucnredlist.org, downloaded on 9th May 2006[R]. 2006.
[16]钟 华, 赖旭龙, 魏荣平. 一种从大熊猫粪便中提取DNA的改进方法[J]. 动物学报, 2003, 49 (5): 670-674.
[17]Irwin D M, Kcher T D, Wilson A C. Evolution of the cytochrome b gene of mammals[J]. J Mo1 Evoo1, 1991, 32: 128-144.
[18]Nei M, Kumar S. Molecular evolution and phylogentics[M]. New York: Oxford University Press. 2000.
[19]Chen Z P, Zhang Y P, Shi L M, et al. Studies on the chromosomes of genusNycticebus[J]. Primates, 1993, 34: 47-53.
[20]Zhang Y P, Chen Z P, Shi L M. Phylogeny of the slow lorises (genusNycticebus): an approach using mitochondrial DNA restriction enzyme analysis[J]. International J Primatology, 1993, 14 (1): 167-175.
[21]Wang W, Su B, Lan H. Interspecific differentiation of the slow lorises (genusNycticebus) inferred from ribosomal DNA restriction maps[J]. Zool Res, 1996, 17 (1): 89-93.
[22]吕雪梅, 王应祥, 张亚平.蜂猴线粒体细胞色素b基因变异特点及系统发育分析[J]. 动物学研究, 2001 22(2): 93-98.
[23]Chen J H, Pan D, Groves C. Molecular phylogeny ofNycticebusinferred from mitochondrial genes [J]. International Journal of Primatology, 2006, 27(4): 1187-1200.
——和田盘羊

