石菖蒲、当归挥发油的提取及β-环糊精包合工艺研究
杨玉霞,于秀华,刘竞研,赵雅蔚,姜秀艳, 郑菊花,尹建元,赵芸浩,李政
(1.吉林大学a.药学院;b.化学院,长春130012;2.东北师范大学附属中学,长春130021)
石菖蒲是天南星科植物石菖蒲(AcorustatarinowiiSchott)的干燥根茎,具有芳香开窍、醒神益智的功效[1]。其主要活性成分为石菖蒲挥发油,包括甲基丁香酚、α-细辛醚、β-细辛醚、γ-细辛醛等物质[2];当归为伞形科植物当归[Angelicasinesis(Oliv.)Diels]的干燥块根,具有活血补血、补气调经等功效[3]。挥发油是其重要有效成分,主要有藁苯内酯、丁烯基酞内酯等[4]。
中药挥发油气味特异,难溶于水,挥发性强,稳定性差,对光敏感。β-环糊精(β-CD)具有环形筒状结构,内部以氧原子为主,具有疏水性;外部以羟基为主,具有亲水性[5]。β-环糊精在中药制剂中常用于挥发油的包合,以增加其稳定性。
目前已有石菖蒲、当归挥发油单独提取及β-环糊精包合工艺研究报道[6,7],但尚未见有关于石菖蒲、当归混合挥发油的提取及包合工艺的研究报道。本试验对石菖蒲、当归混合挥发油的提取方法、包合工艺条件及包合物验证方法进行了较为系统地研究,以期获得最佳提取方法及包合工艺。
1 仪器与试药
1.1仪器
DF-101S集热式恒温加热磁力搅拌器(上海豫康科教仪器设备有限公司);KDM型电子调温电热套(金坛市金祥龙电子有限公司);ZK-820型真空干燥箱(上海实验仪器厂有限公司);SHB-ⅢA 型循环水式多用真空泵(上海豫康科教仪器设备有限公司);CAMAG型薄层色谱扫描仪(瑞士CAMAG公司);硅胶G薄层板(青岛海洋化工集团);Lambda 25 UV/VIS Spectrometer(美国Perkin-Elmer公司);Nicolet iS5傅立叶变换红外光谱仪(上海莱睿科学仪器有限公司)。
1.2试药
石菖蒲、当归药材均购自长春市仙草医药药材有限公司,经吉林大学天然产物研究教研室尹建元教授鉴定为湖南产天南星科植物石菖蒲和甘肃产伞形科植物当归。β-环糊精(分析纯,天津市科密欧化学试剂有限公司);乙酸乙酯(色谱纯,天津市光复精细化工研究所);其它试剂均为分析纯。
2 方法与结果
2.1挥发油提取条件筛选
按处方设计称取石菖蒲、当归药材共计100g,按《中国药典》2010年版一部附录XD挥发油测定法(甲法)提取,收集挥发油,用无水硫酸钠脱水,得淡黄色的混合挥发油,密闭保存备用。
根据影响挥发油得率的主要影响因素[8],选择药材的粉碎度、提取时间和浸泡时间3个因素为试验因素,设计正交试验表L9(34)进行试验,按设计条件测定挥发油提取率。正交试验设计及结果见表1、表2、表3。
表1蒸馏工艺考察因素及水平表
Table1Thefactor-leveloforthogonaldesign

水平Level因素 Factor粉碎度AShatterdegrees提取时间B(h)Extractiontime浸泡时间C(h)Dippingtime1药材饮片Medicinalslices4002粗粉10目Coarsepowder10Mu6053细粉40目Finepowder40Mu810
表2蒸馏工艺L9(34)正交实验结果
Table2Orthogonaldesignandresultsofextractionprocedure
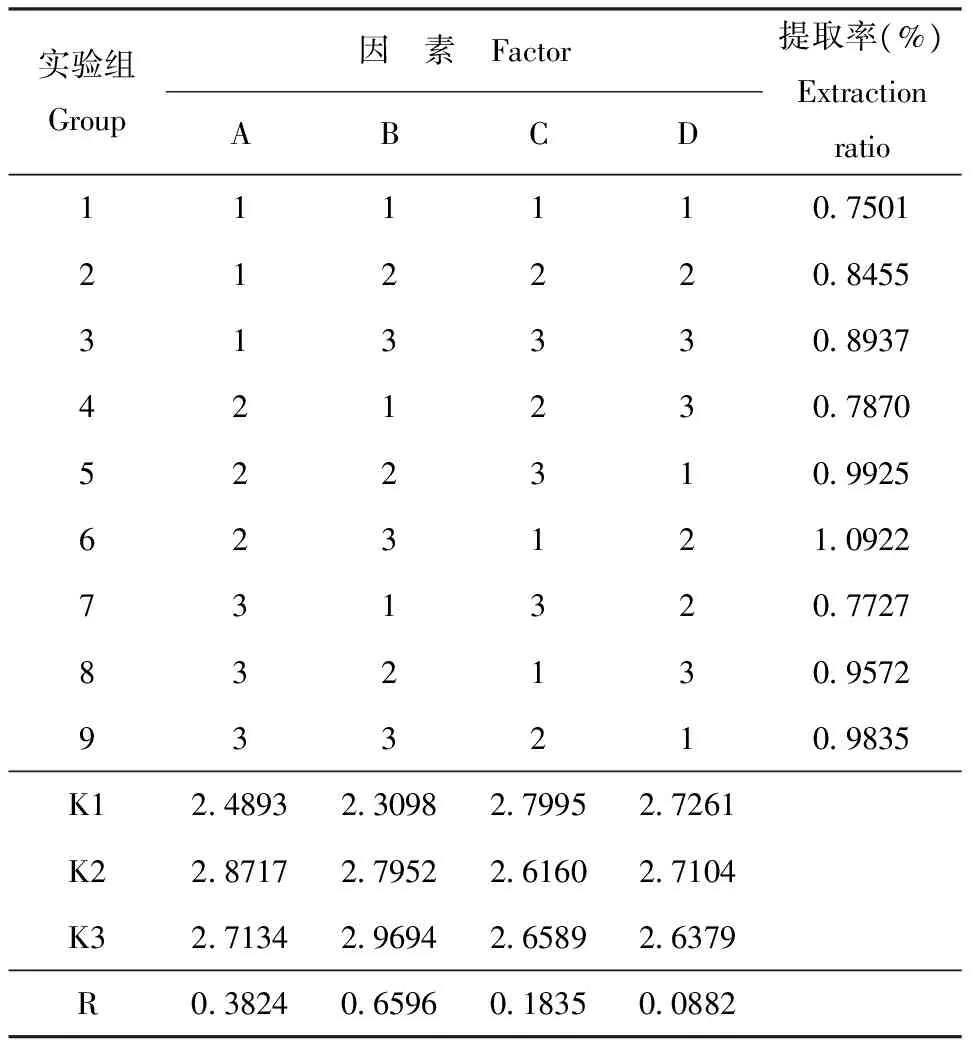
实验组Group因 素 FactorABCD提取率(%)Extractionratio111110750121222084553133308937421230787052231099256231210922731320772783213095729332109835K124893230982799527261K228717279522616027104K327134296942658926379R03824065960183500882
表3蒸馏工艺方差分析
Table3
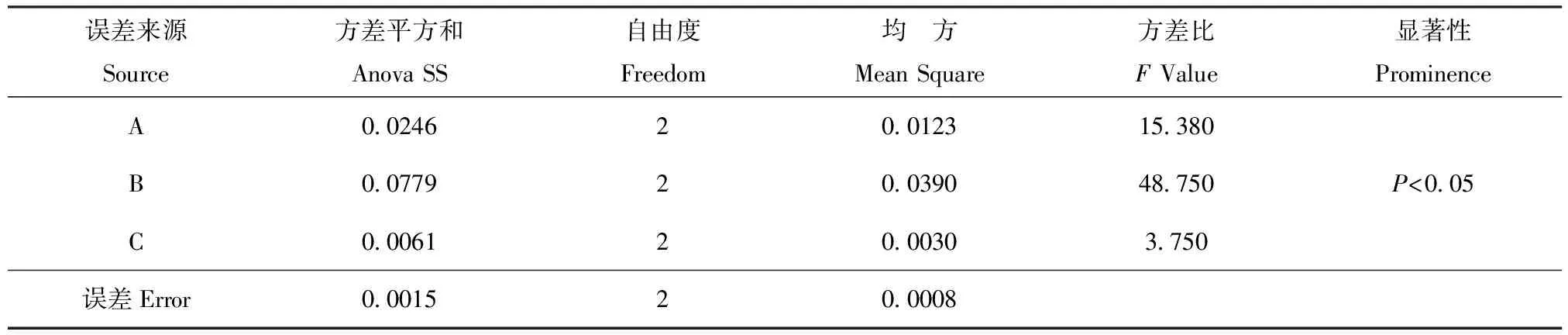
Variance analysis of extraction procedure
注:F0.05(2,2)=19.00。Note:F0.05(2,2)=19.00.
由各表分析可知,各因素作用的主次为B>A>C(表2)。方差分析表明,B因素对挥发油的提取率影响显著,A、C因素的影响不显著(表3)。因此,可确定最佳提取工艺条件为A2B3C1,即药材粉碎度粗粉10目、无需浸泡、提取时间8h。以上最佳工艺进行验证实验3次得提取率分别为1.1533%、1.1051%、1.0984%,挥发油的平均提取率为1.1189%(n=3),因此,确定该工艺为最佳提取条件。
2.2挥发油包合工艺筛选
2.2.1包合物的制备经查阅文献[5],采用饱和水溶液法制备混合挥发油包合物,即取一定量β-CD,加蒸馏水适量配成饱和溶液,加入1mL混合挥发油(预先配成50%的无水乙醇溶液),于磁力搅拌器上恒温搅拌一定时间,冷却至室温,置冰箱中冷藏24h,抽滤,用石油醚洗涤滤渣3次(每次10mL),滤渣置真空干燥箱中50℃干燥4h,即得。
2.2.2包合物评价指标的测定取干燥包合物,置500mL圆底烧瓶中,加入蒸馏水300mL,采用挥发油测定法(中国药典2010版一部附录XD)收集挥发油,计算包合物的挥发油包合率[9]。同时,取混合挥发油1mL,置500mL圆底烧瓶中,加入蒸馏水300mL,收集挥发油,计算挥发油空白回收率为81%。
2.2.3正交试验优选包合工艺条件经预实验,选择挥发油与β-CD的投料比、包合温度、包合时间作为考察因素,以挥发油包合率作为评价指标,用L9(34)正交表进行试验。所选因素水平及正交试验见表4、表5。
表4混合挥发油β-CD包合工艺因素水平

Table 4The factor-level table of orthogonal design
分析可知,各因素作用的主次为B>A>C(表5)。方差分析表明,B因素为显著因素(表6)。因此,确定最佳包合工艺条件为A2B3C2,即混合挥发油与β-环糊精的投料比为1∶8、包合温度为60℃、搅拌时间2h。以上最佳工艺进行验证实验3次得包合率分别为80.28%、82.15%、82.08%,包合率平均达81.50%(n=3),因此,确定该条件为最佳包合工艺。
表5混合挥发油β-CD包合工艺正交试验结果
Table5Orthogonaldesignandresultsofinclusionprocedure

实验组Group因 素 FactorABCD包合率(%)Inclusionrate111114897212225875313337346421235126522315305623128112731324540832134944933217535K118118145631795317737K218543161241853618527K317019229931719117416R1524843013451111
2.3包合物的定性分析
2.3.1薄层色谱鉴别量取当归、石菖蒲及二者混合的挥发油各0.05mL,置于5mL量瓶中,加乙酸乙酯至刻度,摇匀,作为对照品溶液Ⅰ、溶液Ⅱ、溶液Ⅲ。取包合物1g,共2份,一份加乙酸乙酯5mL,超声处理30min,过滤,取续滤液作为包合物供试品溶液Ⅳ;另一份加石油醚5mL,冷浸1h,过滤,取续滤液作为包合物供试品溶液Ⅴ[10]。取β-CD 1g,按供试品溶液Ⅳ的方法制备阴性对照品溶液Ⅵ。吸取对照品溶液Ⅰ、溶液Ⅱ、溶液Ⅲ各2μL,吸取包合物供试品溶液Ⅳ、溶液Ⅴ及阴性对照品溶液Ⅵ各5μL,点于同一以羧甲基纤维素钠为黏合剂的硅胶G薄层板上,以正己烷-乙酸乙酯(17∶3)为展开剂展开,取出,晾干,置于365nm紫外光灯下检视(图1)。
表6混合挥发油β-CD包合工艺正交试验方差分析

Table 6Variance analysis of β-CD inclusion procedure
注:F0.05(2,2)=19.00。Note:F0.05(2,2)=19.00.

结果显示,供试品溶液Ⅳ在与对照品色谱相应的位置具有相同的荧光斑点,而供试品溶液Ⅴ与阴性对照品溶液Ⅵ色谱中均未见任何斑点,表明当归、石菖蒲挥发油进入了β-CD分子内部,形成了新的包合物,而且β-CD对挥发油没有干扰,包合前、后挥发油成分基本不变。
2.3.2紫外光谱分析量取β-CD、包合物各0.5g,加5mL乙酸乙酯,超声30min,过滤,滤液置100mL容量瓶中,加乙酸乙酯稀释至刻度,作为样品1、样品2。取石菖蒲、当归混合挥发油10mg,置100mL容量瓶中,加乙酸乙酯稀释至刻度,作为样品3。以乙酸乙酯为空白,在190nm~800nm范围内进行紫外光谱扫描(图2)。

结果显示,β-CD的乙酸乙酯溶液无混合挥发油的特征吸收,而经超声破坏的包合物与混合挥发油显示的吸收谱图峰形一致,说明混合挥发油-β-CD包合物已形成,包合前、后化学成分基本不变。
2.3.3红外光谱分析分别取包合前、后的混合挥发油、β-CD、包合物作为样品,采用KBr压片法进行红外光谱扫描(图3)。在包合前挥发油图谱中3440.66cm-1处为石菖蒲、当归2种挥发油的叠加吸收峰。石菖蒲挥发油化学成分较复杂,其在2932.80cm-1、1511.36cm-1、1213.94cm-1、1.07.47cm-1处有尖峰,当归挥发油在1767.21cm-1处有尖峰。
包合物的图谱中观察不到这些特征峰,证明包合过程中形成新物象。β-CD在3422.70cm-1处有宽峰,1029.24cm-1处有尖峰;包合物3422.70cm-1峰移至3400.36cm-1,峰变窄,1030.49cm-1处尖峰也变窄,说明混合挥发油和环糊精之间产生作用。包合前、后的挥发油红外图谱比较说明,包合前、后混合挥发油的主要化学成分未发生显著变化。
3 讨论
β-环糊精可选择性地与多种芳香化合物形成环糊精包合物,它的包合作用在增加药物的溶解度、稳定性、掩盖药物的臭味等方面具有良好效果[11]。本实验利用β-环糊精对挥发油进行包合可有效减少挥发油在制剂生产贮存运输过程中受光线高温的影响,明显提高药物制剂的稳定性,改善药物溶解度,提高生物利用度,促进药物疗效的发挥。
本实验采用水蒸汽蒸馏法提取石菖蒲、当归混合挥发油,得到最佳提取工艺,即将药材粉碎为粗粉10目、无需浸泡、提取时间8h。本研究单独提取当归、石菖蒲药材的出油率分别为0.4357%、1.1316%,而混合挥发油提取率达到1.1189%,按处方量计算,混合提取比单独提取出油率增加,还节省成本。因此,本研究采用混合提取挥发油的方法。
本实验采用饱和水溶液法得到最佳包合工艺,即挥发油与β-环糊精的投料比为1∶8、包合温度60℃、搅拌时间2h。包合物包合率平均达81.50%(n=3),验证实验表明本工艺重现性好、质量稳定。
本实验采用薄层、紫外、红外法对包合物的验证结果表明,包合前、后挥发油的主要化学成分未发生显著变化,并且挥发油与β-环糊精形成新的稳定化合物。

[1]李艳艳,姜志恒,尹建元.两种石菖蒲挥发油主成分及其含量的比较[J].特产研究,2011,39(1):44-45.
[2]刘春海,刘西京,杨华生.石菖蒲挥发油的GC-MS分析[J].中医药学刊,2006,24(7):1280-1281.
[3]Chen J T,Yang C R.Researches in Angelica L[J].Nat Prod Res Dev,2004,16:359-365.
[4]李曦,张丽宏,王晓晓,等.当归化学成分及药理作用研究进展[J].中药材,2013,36(6):41-42.
[5]郝晶晶,李海亮,龚慕辛.挥发油环糊精包合技术的研究进展及存在问题分析[J].中国实验方剂学杂志,2013,19(2):352-356.
[6]柯瑜,倪健,姚珏成.石菖蒲挥发油提取及包合工艺的优选[J].中成药,2006,28(9):1271-1274.
[7]李元波,殷辉安,周琳.当归挥发油的提取与β-环糊精包合工艺研究[J].天然产物研究与开发,2006,18(5):836-840.
[8]王晓丽,黄海涛,蔡德富.石菖蒲挥发油β-环糊精包合物的制备[J].齐齐哈尔医学院学报,2011,32(2):169-172.
[9]陈秋实,张洪,吴杰.薄荷挥发油的提取及其β-环糊精包合物制备工艺研究[J].云南中医学院学报,2008,31(1):13-16.
[10]杜帆,夏新华,赵碧清.环糊精包合桂枝、当归混合挥发油的工艺研究[J].中成药,2012,34(8):1604-1606.
[11]左晶,刘文波.β-环糊精包合复方上感胶囊挥发油制备工艺的研究[J].时珍国医国药,2010,21(8):1551-1552.

