二十二碳六烯酸对白介素1β诱导的动脉平滑肌细胞增殖和迁移的影响及机制探究
拓步雄 李超民 叶明霞 刘 薇 李 慧
解放军第四五一医院心血管内科,陕西西安710054
二十二碳六烯酸对白介素1β诱导的动脉平滑肌细胞增殖和迁移的影响及机制探究
拓步雄 李超民 叶明霞 刘 薇 李 慧▲
解放军第四五一医院心血管内科,陕西西安710054
目的探讨二十二碳六烯酸(DHA)对白介素1β(IL-1β)诱导的动脉平滑肌细胞增殖和迁移的影响及机制。方法血管平滑肌细胞(VSMCs)培养及传代后,分为对照组、IL-1β组、DHA组、IL-1β和DHA处理组四组,其中对照组细胞加入50μL磷酸盐缓冲液(PBS);IL-1β组细胞加入10 ng/mL IL-1β;DHA组细胞加入80μmol/L DHA;IL-1β和DHA处理组加入10 ng/mL IL-1β和80μmol/L DHA,培养48 h后,噻唑蓝(MTT)法和Transwell法检测VSMCs的增殖和迁移情况;qRT-PCR和Western blotting技术检测基质金属蛋白酶(MMP)-2、MMP-9、组织金属蛋白酶抑制剂(TIMP)-1、TIMP-2和Notch3的表达情况。结果VSMCs的增殖率和迁移能力经IL-1β处理后显著增高,而IL-1β和DHA处理组显著低于IL-1β处理组(F=25.537,P=0.003);MMP-2、MMP-9、TIMP-1、TIMP-2的表达量经IL-1β处理后显著增高,而经IL-1β和DHA共处理后显著低于IL-1β组(MMP-2:F= 34.286,P=0.000;TIMP-2:F=21.034,P=0.009;MMP-9:F=31.732,P=0.000;TIMP-1:F=18.213,P=0.021);IL-1β组细胞Notch3表达量显著降低,IL-1β和DHA处理组中Notch3的表达水平则显著高于IL-1β处理组(F=39.235,P= 0.000)。结论DHA可通过Notch信号通路抑制VSMCs的增殖和迁移。
二十二碳六烯酸;白介素1β;基质金属蛋白酶-2;基质金属蛋白酶-9;组织金属蛋白酶抑制剂-1;组织金属蛋白酶抑制剂-2;Notch3
血管壁结构的改变是高血压病理改变的普遍特征。目前普遍认为,高血压基本病理改变是血管重塑。动脉壁中膜肥厚是高血压血管壁增厚的主要原因,这与血管平滑肌细胞(vascular smooth muscle cells,VSMCs)的增殖和迁移密切相关。研究表明多不饱和脂肪酸如二十碳五烯酸和二十二碳六烯酸(Docosahexaenoic Acid,DHA)可降低心血管疾病的发病率和病死率[1]。DHA除了具有很好的降血脂作用外,还可以通过影响内皮细胞和VSMCs的生物学行为进而调节血压。在炎性反应中DHA可降低VSMCs的增殖和迁移[2-3]。研究表明,在高血压、血管再狭窄和动脉粥样硬化过程中VSMCs的增殖和迁移与基质金属蛋白酶(matrixmetalloproteinase,MMP)降解细胞外基质密切相关[4]。当血管损伤后炎症因子高表达,上调MMP-2和MMP-9,使细胞外基质大量降解,加速了VSMCs向血管内膜迁移,导致血管壁增厚,引起血压上升,血栓形成[5-6]。目前,有关DHA的降血压机制的研究尚不多见。本文通过研究DHA对VSMCs增殖及迁移的影响,以及对基质金属蛋白酶及其抑制剂含量的变化探讨了DHA对高血压的影响及机制。

表1 引物列表
1 材料与方法
1.1 材料与仪器
雄性SD大鼠,山东绿叶制药有限公司动物实验中心提供,合格证号:20030020;干粉培养基(DMEM),美国Gibco公司生产;Trizol,加拿大Invitrogen公司提供;Quantscript RT kit,总RNA提取试剂盒购自于Takara公司;琼脂糖购自于BioWest公司;RIPA裂解液,购自于美国Millipore公司;DHA、噻唑蓝(MTT)、二甲基亚砜(DMSO)和胰蛋白酶购自于Sigma公司;水套式二氧化碳孵箱,美国Nuaire公司生产;超净工作台,苏州净化设备公司生产;PCR仪:MJResearch INC生产。
1.2 方法
1.2.1 细胞培养8周龄的雄性大鼠,颈椎脱臼处死,取胸主动脉,放入磷酸盐缓冲液(PBS)中清洗。剥去动脉外膜及内膜,取血管的中层组织洗净后剪成1mm2大小的组织块,按组织贴块法接种于200mL/L胎牛血清的DMEM培养液中,于5%CO2、37℃下培养24 h。待细胞达到80%的融合后,用2.5 g/L的胰蛋白酶消化传代。
1.2.2 实验分组处理消化细胞并收集细胞悬液,将细胞以1×105/孔接种于24孔细胞培养板中,然后将细胞随机分为四组:对照组细胞加入50μLPBS培养48 h; IL-1β组细胞加入10 ng/mL IL-1β共培养48 h;DHA组细胞加入80μmol/L DHA培养48 h;IL-1β和DHA处理组细胞加入10 ng/mL IL-1β和80μmol/L DHA培养48 h。
1.2.3MTT检测细胞增殖细胞增殖采用MTT法进行检测。细胞消化后通过计数板计数,将细胞以1×104/孔的密度接种至96孔培养板中。接种12 h后,按上述分组方法进行培养。每组做6个重复。培养48 h后每孔加入5 g/L的MTT 20μL,37℃恒温箱中培养4 h,去上清,每孔加入200μL DMSO,振摇20 min,用紫外分光光度计测定570 nm下的光密度值(OD)。
1.2.4 Transwe l l法检测细胞侵袭在24孔Transwell上室聚碳酸酯膜(膜孔径8μm)上涂1 g/L的matrigel 70μL,37℃,60 min使之在微孔滤膜上重组为基底膜结构。取对数生长期的VSMCs,以DMEM培养液[不加胎牛血清(FBS)],调整细胞悬液中细胞数为l×105/mL,取200μL细胞悬液接种于Transwell上室内,下室加入10%FBS的DMEM培养液500μL,37℃,5%CO2培养24 h后,将滤膜上层细胞用棉签抹去,滤膜以甲醇固定,然后用结晶紫染色15min。100倍光镜下选择膜上、下、左、右、中5个不同视野的穿过膜细胞数,求平均值。
1.2.5 qRT-PCR检测VSMCs细胞分组处理48 h后,利用PBS清洗细胞3遍,然后胰酶消化收集细胞,依据试剂盒说明,采用Trizol(Invitrogen,CA)抽提法提取总RNA,提取出的RNA用紫外分光光度计测OD值,以确定RNA的浓度和纯度;采用Quantscript RT kit反转录合成cDNA,PCR扩增。PCR扩增条件:94℃,1.5min;94℃,1 min;64℃,1 min;72℃,1 min 40个循环,最后在72℃下延伸10 min,同样的方法扩增内参基因三磷酸甘油醛脱氢酶(GAPDH)。引物信息见表1。
1.2.6 Wes te rn b l ot t ing检测蛋白表达细胞分组处理48 h后,利用PBS清洗细胞3遍,然后胰酶消化收集细胞,用RIPA细胞蛋白裂解液提取细胞中的蛋白,二辛可酸(BCA)法测定蛋白浓度。蛋白样品经SDS-PAGE电泳,上样量为40μg/行,电泳完毕后,电转移至PVDF膜进行如下处理:牛血清白蛋白(BSA)封闭过夜,一抗(1∶1000比例稀释)室温抚育2 h,磷酸盐吐温缓冲液(PBST)洗涤3次,辣根过氧化物酶(HRP)-IgG(1∶100比例稀释)室温抚育2 h,PBST洗涤3次,电化学发光(ECL)显色,暗室曝光。
1.3 统计学方法
采用统计软件SPSS 13.0对实验数据进行分析,计量资料数据以均数±标准差(x±s)表示,两两比较采用t检验。以P<0.05为差异有统计学意义。
2 结果
2.1 VSMCs的增殖情况
MTT法检测VSMCs的增殖情况,结果显示,DHA组VSMCs的相对增殖率与对照组比较,差异无统计学意义(P>0.05);而IL-1β组VSMCs的相对增殖率显著增高(P<0.05);IL-1β和DHA共处理组VSMCs的相对增殖率与IL-1β组VSMCs的相对增殖率相比显著下降(P<0.01)。见图1。
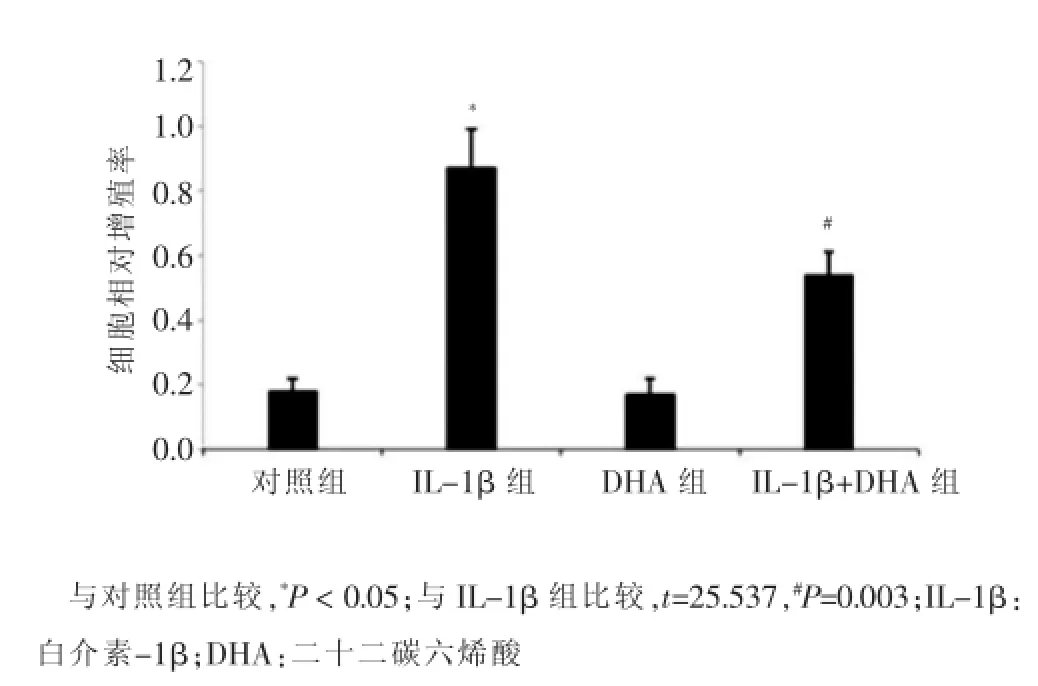
图1 不同处理组血管平滑肌细胞的相对增殖率
2.2 VSMCs的迁移情况
Transwell法检测VSMCs的迁移,结果显示,DHA组VSMCs的穿膜均数为(18.24±5.31)个,与对照组[(22.17±4.58)个]比较,差异无统计学意义(P>0.05);IL-1β组VSMCs的穿膜均数高达(64.72±21.35)个,显著高于对照组,差异有统计学意义(P<0.05);当经IL-1β处理的VSMCs与DHA共培养时,VSMCs的穿膜数量为(38.94±8.45)个,显著低于IL-1β组VSMCs的穿膜数量,差异有统计学意义(P<0.05)。
2.3 VSMCs中MMP-2、TIMP-2、MMP-9和TIMP-1的表达
Western blotting检测MMP-2、TIMP-2、MMP-9及TIMP-1在VSMCs中的表达,结果显示,与对照组比较,DHA组VSMCs中MMP-2、TIMP-2、MMP-9、TIMP-1的表达量和MMP-2/TIMP-2、MMP-9/TIMP-1的比值改变不显著,差异无统计学意义(P>0.05);而IL-1β组的VSMCs中MMP-2、TIMP-2、MMP-9、TIMP-1的表达量和MMP-2/TIMP-2、MMP-9/TIMP-1的比值显著增高,差异有统计学意义(P<0.05)。当经IL-1β处理的VSMCs与DHA共培养48 h后,细胞中的MMP-2、MMP-9的表达量和MMP-2/TIMP-2、MMP-9/TIMP-1的比值与IL-1β组相比有显著降低,差异有统计学意义(P<0.05)。见图2、3。
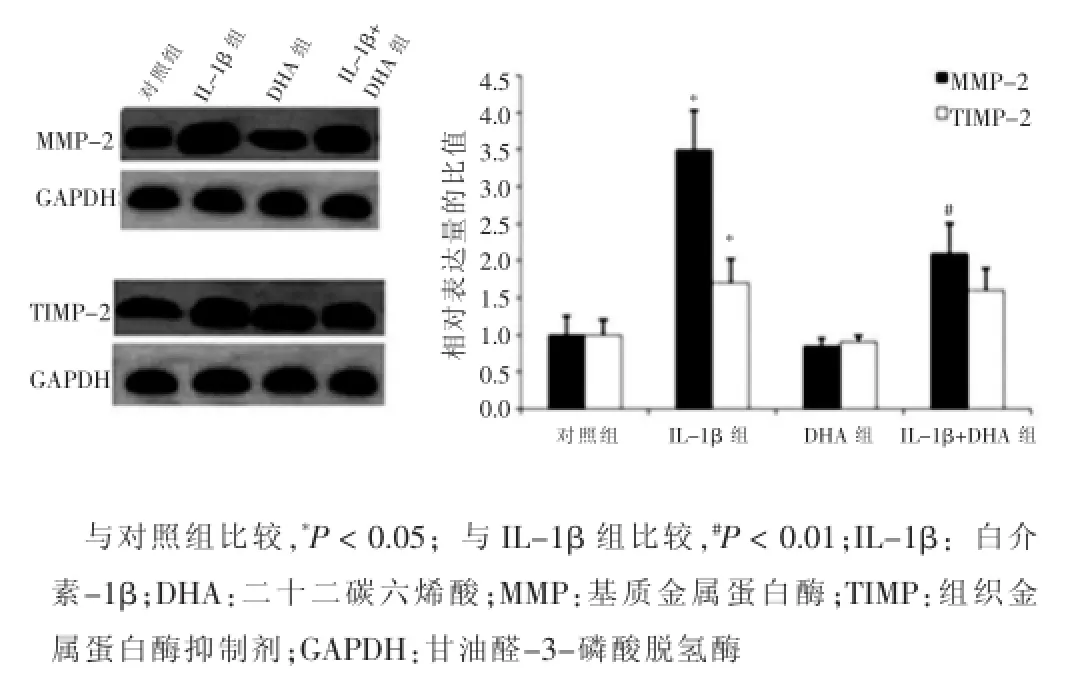
图2 不同处理组血管平滑肌细胞中MMP-2和TIMP-2的表达
2.4 Notch信号通路关键调控因子Notch3在VSMCs中的表达
DHA组VSMCs中Notch3的表达量与对照组比较,差异无统计学意义(P>0.05);Notch3在IL-1β组VSMCs中的表达量显著低于对照组,差异有统计学意义(P<0.05);当经IL-1β处理的VSMCs与DHA共培养48 h后,VSMCs中的Notch3表达量与IL-1β组相比显著增高,差异有统计学意义(P<0.05),提示DHA对VSMCs增殖和迁移的抑制作用是通过Notch信号通路实现的。见图4。
3 讨论

图3 不同处理组血管平滑肌细胞中MMP-9和TIMP-1的表达
VSMCs是构成血管壁的重要组成成分,其增殖过度是导致多种心血管疾病,尤其是高血压、动脉粥样硬化、血管再狭窄等的关键环节[7-8]。正常成熟的血管中VSMCs处于分化状态,当局部血管在炎症因子等刺激作用下损伤后,局部释放大量细胞因子和生长因子,使位于中膜的VSMCs表型发生改变,导致细胞收缩功能消失,并由中膜向内膜迁移、增殖,同时分泌大量的细胞外基质(extra-cellularmatrix,ECM)。本实验用炎症因子IL-1β对VSMCs进行了处理,诱导VSMCs细胞发生炎性反应,引起其大量增殖,然后用DHA进行处理,比较不同处理组VSMCs中MMP-2和MMP-9及其抑制剂的表达差异,并对Notch信号途径中的主要调控因子Notch3进行了检测,探讨DHA对VSMCs增殖和迁移的影响及机制。
MMPs是一类可降解ECM的锌蛋白酶家族,以酶原的形式分泌,由其他蛋白酶或炎症因子激活,在组织重构及ECM的动态平衡中发挥着重要作用[9]。TIMPs是MMPs的主要抑制剂,主要由肌成纤维细胞、VSMCs、激活的星形胶质细胞等分泌,其分泌为基本的生理所需,随MMPs的表达而表达,二者维持在一定的比例,调节ECM的动态平衡,若二者的比例失衡,将引起多种病理反应。本研究发现经IL-1β诱导的VSMCs的增殖及迁移能力显著增高,且MMP-2、MMP-9、TIMP-1和TIMP-2的表达量显著上调,MMP-2/TIMP-2、MMP-9/TIMP-1的比值均显著增高,比例失调。与DHA共培养后VSMCs的增殖及迁移能力显著下降,MMP-2和MMP-9的表达量及MMP-2/TIMP-2、MMP-9/TIMP-1的比值都表现为显著下调。说明VSMCs的增殖及迁移与MMP-2/TIMP-2、MMP-9/TIMP-1的比例失衡具有相关性,DHA可以降低MMP-2和MMP-9的表达量,从而降低MMP-2/TIMP-2、MMP-9/TIMP-1的比值,对抑制VSMCs的增殖及迁移发挥重要的作用。
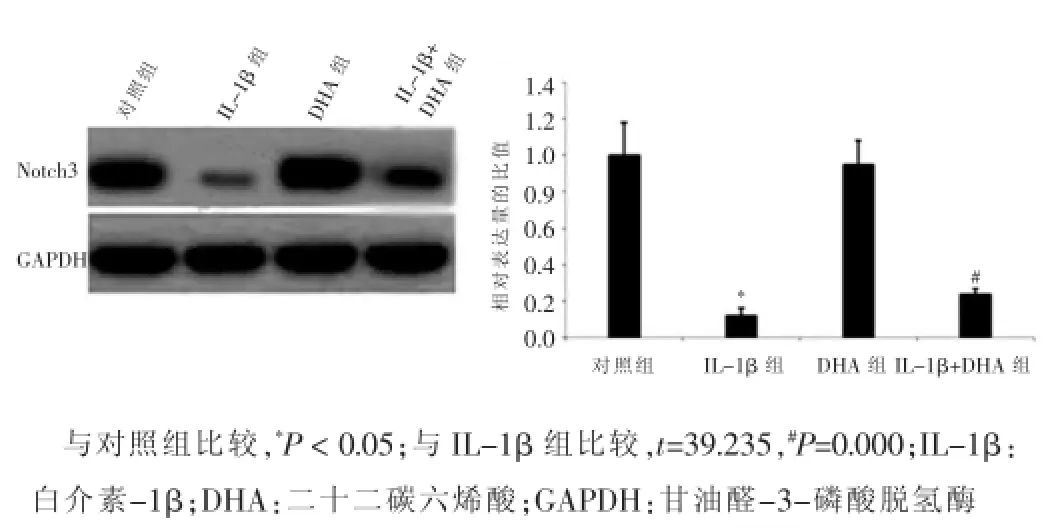
图4 不同处理组血管平滑肌细胞中Notch3的表达
Notch信号通路一条最初发现于果蝇、高度保守的信号转导途径,广泛存在于各种生物体内。Armulik等[10]的研究发现Notch信号通路在调节VSMCs形态和功能中发挥重要作用。本研究发现:经IL-1β处理的VSMCs中低表达Notch3;经IL-1β处理的VSMCs与DHA共培养后Notch3的表达量表现为显著增高,VSMCs的增殖和迁移能力也显著降低,说明Notch3在DHA抑制平滑肌细胞增殖和迁移中发挥重要作用。
DHA对VSMCs生理功能的调节作用已被多个研究所报道[11-12]。有研究认为ω-3不饱和脂肪酸特别是DHA一方面极易与膜磷脂或三酰甘油相融合并增加VSMCs膜固醇类的流动从而对与胞膜密切相关的信号分子产生影响[13],而另一方面对细胞膜离子通道进行调控,最终调节细胞内的信号转导[14]。
综上所述,本研究发现DHA可以降低炎性反应所引起的VSMCs中MMP-2和MMP-9的高表达,调节MMP-2/TIMP-2、MMP-9/TIMP-1的比例,抑制VSMCs的增殖和迁移,在高血压的病理过程中发挥重要作用。同时,本研究发现DHA发挥调节作用的过程中Notch3起到了关键性的作用,此结果提示DHA作用的发挥可能是通过Notch信号通路实现的。
[1]NO authors.Dietary supplementation with n-3 polyunsaturated fatty acids and vitamin E after myocardial infarction:results of the GISSI-Prevenzione trial.Gruppo Italiano per lo Studio della Sopravvivenza nell'infarto miocardico[J].Lancet,1999,354(9177):447-455.
[2]Abeywardena MY,Head RJ.Longchain n-3 polyunsaturated fatty acids and blood vessel function[J].Cardiovasc Res,2001,52(3):361-371.
[3]Robinson JG,Stone NJ.Antiatherosclerotic and antithrombotic effects of omega-3 fatty acids[J].Am J Cardiol,2006,98(4A):39-49.
[4]Galis ZS,Khatri JJ.Matrixmetalloproteinases in vascular remodeling and atherogenesis:the good,the bad,and the ugly[J].Circ Res,2002,90(3):251-262.
[5]Bond M,Chase AJ,Baker AH,etal.Inhibition of transcription factor NF-kappaB reducesmatrixmetalloproteinase-1,-3 and-9 production by vascular smoothmuscle cells[J]. Cardiovasc Res,2001,50(3):556-565.
[6]WangM,Zhao D,SpinettiG,et al.Matrixmetalloproteinase 2 activation of transforming growth factor-beta1(TGF-beta1)and TGF-beta1-typeⅡreceptor signaling within the aged arterialwall[J].Arterioscler Thromb Vasc Biol,2006,26(7):1503-1509.
[7]Hattori Y,Hattori S,Sato N,et al.High-glucose-induced nuclear factorκB activation in vascular smooth muscle cells[J].Cardiovase Res,2000,46(1):188-197.
[8]赵娟,王红,于伞鑫,等.Urantide对大鼠血管平滑肌细胞增殖的影响[J].吉林大学学报:医学版,2011,37(6):1079-1082.
[9]Oheake Y,Tojo H,SeikiM.Multifunctional roles of MTl-MMP in myofiber formation and morphostaticmaintenance of skeletalmuscle[J].JCell Sic,2006,119(18):3822-3832.
[10]Armulik A,Abramsson A,Betsholtz C.Endothelial/pericyteinteractions[J].Circ Res,2005,97(6):512-523.
[11]Botham KM,Wheeler-Jones CP.Postprandial lipoproteins and the molecular regulation of vascular homeostasis[J]. Prog Lipid Res,2013,52(4):446-464.
[12]Song J,Kwon N,Lee MH,etal.Association of serum phospholipid PUFAswith cardiometabolic risk:beneficial effect of DHA on the suppression of vascular proliferation/ inflammation[J].Clin Biochem,2014,47(6):361-368.
[13]Dusserre E,PulciniT,Bourdillon MC,etal.ω-3 Fatty acids in smooth muscle cell phospholipids increase membrane cholesterol efflux[J].Lipids,1995,30(1):35-41.
[14]Hirafuji M,Machida T,Hamaue N,et al.Cardiovascular protective effects of n-3 polyunsaturated fatty acids with special emphasis on docosahexaenoic acid[J].JPharmacol Sci,2003,92(4):308-316.
Effect and mechanism study of Docosahexaenoic Acid for vascular smooth muscle cells proliferation and m igration induced by IL-1β
TUO Buxiong LIChaomin YEMingxia LIUWei LIHui▲
Department of Cardiology,the 451st Hospital of PLA,Shaanxi Province,Xi′an 710054,China
Objective To study the effect and mechanism study of Docosahexaenoic Acid(DHA)for vascular smooth muscle cells(VSMC)proliferation and migration induced by interleukin(IL-1β).Methods Subcultured VSMCswere divided into four groups:control group,DHA group,IL-1βgroup and IL-1βcombined with DHA group.Cells were cocultured with 50μL PBS in control group,with 10 ng/mL IL-1βin IL-1βgroup,with 80μmol/L DHA in DHA group,with 10 ng/mL IL-1βand 80μmol/L DHA in IL-1βcombined with DHA group for 48 h.MTT and Transwell methodswere used to detect VSMCs proliferation andmigration.qRT-PCR and Western blottingmethodswere used to measure the expression ofmatrixmetalloproteinase(MMP)-2,MMP-9,tissue inhibitor ofmetalloproteinase(TIMP)-1, TIMP-2 and Notch3.Results The proliferation and migration of VSMCs significantly increased in IL-1βgroup,while the proliferation andmigration ability of VSMCs significantly decreased compared with IL-1βgroup(F=25.537,P=0.003). In IL-1βgroup,the expression of MMP-2,MMP-9,TIMP-1 and TIMP-2 significantly increased(P<0.05),whereas the expression of MMP-2,MMP-9,TIMP-1 and TIMP-2 in IL-1βcombined with DHA group significantly decreased compared with IL-1βgroup(MMP-2:F=34.286,P=0.000;TIMP-2:F=21.034,P=0.009;MMP-9:F=31.732,P=0.000; TIMP-1:F=18.213,P=0.021).The expression of Notch3 in IL-1βgroup was significantly lower,while in the IL-1β combined with DHA group the expression of Notch3 was significantly higher than that in the IL-1βgroup(F=39.235, P=0.000).Conclusion DHA can inhibit VSMCs proliferation and migration through the Notch signaling pathway.
Docosahexaenoic Acid;IL-1β;MMP-2;MMP-9;TIMP-1;TIMP-2;Notch3
R544.1
A
1673-7210(2014)09(c)-0021-05
2014-05-25本文编辑:卫轲)
▲通讯作者

