3-甲基腺嘌呤对人耐药大肠癌SW480细胞增殖及自噬活性的影响
胡万乐,王玲琴,陈苏苹,陈荣
(温州医科大学附属第二医院 中西医结合肛肠外科,浙江 温州 325027)
3-甲基腺嘌呤对人耐药大肠癌SW480细胞增殖及自噬活性的影响
胡万乐,王玲琴,陈苏苹,陈荣
(温州医科大学附属第二医院 中西医结合肛肠外科,浙江 温州 325027)
目的:研究自噬抑制剂3-甲基腺嘌呤(3-MA)对耐5-氟尿嘧啶(5-Fu)结肠癌SW480细胞增殖及自噬活性的影响,探讨自噬抑制剂在逆转结直肠癌耐药中的作用。方法:浓度递增筛选法诱导耐5-Fu(100 μg/L)的SW480细胞株,用10 μmol/L浓度的3-MA处理后,再用5-Fu(浓度200μg/L)作用24 h。采用CCK-8法检测细胞增殖情况,流式细胞仪检测细胞凋亡率,丹酰戊二胺(MDC)染色和电镜检测细胞自噬活性变化。结果:3-MA对耐药细胞自噬活性的抑制率达89.7%,增殖抑制率为9.6%,凋亡率为5.7%,与对照组比较差异具有统计学意义(P<0.05)。经3-MA处理后,5-Fu对耐药SW480细胞增殖抑制率达71.6%±2.9%,凋亡率达36.6%±2.9%,而单用5-Fu细胞增殖抑制率仅为23.6%±2.9%,凋亡率仅为10.3% ±2.5%,3-MA预处理后5-Fu对耐药细胞的增殖抑制率及凋亡率均明显增强(P<0.05),自噬泡数量显著减少,自噬活性明显降低(P<0.05)。结论:3-MA单用时仅有较弱的抗肿瘤作用,与5-FU联用时耐药细胞的增殖及自噬活性被显著抑制,增强了SW480耐药细胞对5-Fu的敏感性,提高了化疗效果。
结直肠肿瘤;自噬;3-甲基腺嘌呤;氟尿嘧啶;耐药
自噬作为广泛存在于真核细胞中的一种生命现象,在许多重大疾病的发生发展中扮演重要角色。自噬活性对肿瘤的影响已在结肠癌[1]、神经胶质瘤[2]、肝癌[3]等多种肿瘤中得到证实。近年研究发现自噬与肿瘤耐药密切相关[4-5],我们前期研究也发现自噬活性的增强参与了SW480细胞对5-氟尿嘧啶(5-Fu)耐药的形成[6],但抑制自噬能否逆转肿瘤细胞的耐药,目前鲜见报道。因此,我们在前期诱导的耐5-Fu结肠癌SW480细胞的基础上,引入自噬抑制剂3-甲基腺嘌呤(3-methyladenine,3-MA),探讨抑制自噬活性对耐药肿瘤细胞生存率的影响,为自噬抑制剂在临床中的应用提供实验依据。
1 材料和方法
1.1 细胞及主要试剂人大肠癌SW480耐5-Fu细胞株为本课题组前期通过5-Fu浓度递增法诱导产生,能耐受浓度为100 μ g/L的5-Fu,在此浓度中SW480有持续的活性并且能稳定增殖。5-Fu购自德国默克公司;3-MA购自美国Gibco公司;丹酰戊二胺(MDC)购自美国Sigma公司;CCK-8试剂盒和Annexin V-FITC细胞凋亡检测试剂盒购自中国南京凯基生物科技公司;胎牛血清(优级)购自杭州四季青生物工程材料有限公司。
1.2 方法
1.2.1 细胞培养及分组:细胞在含10% FBS的DMEM高糖培养基中,培养条件为37 ℃,5% CO2,饱和湿度,待细胞达到80%的生长面积时,按不同处理因素分为4组:对照(TR)组:为耐药细胞,用培养液作为对照药;5-Fu单药(TR+5-Fu)组:只加5-Fu处理,5-Fu的终浓度为200μ g/L;3-MA单药(TR+3-MA)组:只加3-MA培养,3-MA浓度为10 μ mol/L;联合用药(TR+3-MA+5-Fu)组:用10μ mol/L浓度的3-MA处理1 h后,再加入5-Fu(终浓度为200 μ g/ L)培养24 h。
1.2.2 细胞增殖活性的检测:挑选处于对数生长期生长状态良好、存活率高(90%以上)且致密度约为70%~80%的耐药SW480细胞,吸出培养液,PBS洗1次,0.25%胰酶消化,制成单细胞悬液,每组6个复孔,按1×105个/孔接种细胞于96孔板上,培养24 h后,分别加入相应的试剂(其中3-MA浓度为10 μmol/L,5-Fu终浓度为200 μ g/L),TR组加入相同体积的培养液。加入后37 ℃培养箱培养,加药24 h后每孔加入10 μ L CCK-8试剂,37 ℃继续孵育培养3 h,酶标仪测450 nm光吸收值(OD值)。细胞增殖率(%)=(加药孔OD值-空白孔OD值)/(对照孔OD值-空白孔值OD值)×100%;细胞增殖抑制率(%)=1-细胞增殖率(%)。
1.2.3 细胞凋亡检测:取对数生长期的SW480细胞,经消化后制成单细胞悬液,按5×106个/孔接种细胞于96孔板上,细胞贴壁后,按实验分组用药物处理后12 h,PBS洗涤2次后,离心弃去上清后,加入500μ L染色缓冲液(binding buffer),然后加入5μ L Annexin V-FITC试剂和10μ L PI,混匀,室温下避光孵育15 min,上流式细胞仪检测。
1.2.4 细胞透射电镜检测:将待检细胞用PBS洗2次,用细胞刮刀将其刮下,制成悬液放置于玻璃试管内,离心(3 000 r/min,10 min)成团,去上清液后加入2.5%戊二醛固定10 min左右,去上清,然后和少量抗凝血清混合均匀,离心成团,去上清液,沿管壁轻轻滴入2.5%戊二醛,置于4 ℃下固定1 h,用带勾的解剖镊勾出细胞团,切成1 mm3大小的组织块。组织块经前固定、漂洗、后固定、漂洗、块染、梯度脱水、浸透、包埋聚合等程序处理后,用Power Tome-XL型超薄切片机切片,每个样品厚50~60 nm,然后枸橼酸铅染色,最后用日本日立株式会社透射电子显微镜 H-7500观察拍片(镜下见膜泡结构包裹细胞内含物的为自噬体,其中含有变性的胞质成分及被消化降解后形成的产物)。
1.2.5 MDC染色鉴定SW480细胞自噬体形成:6孔板中置入预先处理过的无菌盖玻片,将制备好的细胞悬液加入6孔板中,使得每个孔中细胞量约为1× 105/2 mL培养基,放置于37 ℃、5% CO2的培养箱中培养24 h。6孔板中每孔加入2μ L MDC染料,用锡箔纸包好,放入37 ℃、5% CO2的培养箱中培养20 min;取出6孔板,用PBS轻柔地流水冲洗3次;然后4%的多聚甲醛(PFA)2 mL室温固定15 min;去除PFA,细胞用PBS清洗1次;用注射器针头勾起盖玻片,在已经滴加甘油(配制甘油,甘油与10× PBS以 9:1的比例混合,即将PBS稀释为1×)的载玻片上将盖玻片沿45 ℃角缓缓放下,使细胞层置于中间,避免气泡产生。最后荧光显微镜观察MDC染色情况(镜下自噬体呈明显的胞浆点状荧光分布)。
1.3 统计学处理方法采用SPSS16.0软件和Origin6.1统计软件进行统计分析和作图。每次随机试验独立重复3次,所有数据均用±s表示,用单因素方差分析比较不同条件下的组间差异。P<0.05为差异有统计学意义。
2 结果
2.13 -MA对细胞增殖的影响单独应用3-MA对耐药细胞增殖活性影响较小,细胞增殖抑制率为9.6%,与TR组比较差异具有统计学意义(P<0.05),表明3-MA本身有较弱的细胞抑制作用。当3-MA与5-Fu联合应用时,细胞增殖抑制率达到71.6%±2.9%,较单独应用5-Fu(为23.6%±2.9%)显著增高,P<0.05(见图1)。

图1 3-MA对各组细胞增殖的影响
2.23 -MA对细胞凋亡的影响单独应用3-MA对耐药细胞凋亡影响较小,凋亡率为5.7%,与TR组比较差异具有统计学意义(P<0.05),表明3-MA本身有较弱的抗肿瘤作用。但当3-MA与5-Fu联合应用时,细胞凋亡率达到36.6%±2.9%,较单独应用5-Fu(为10.3%±2.5%)显著增高,P<0.05(见图2)。

图2 3-MA对各组细胞凋亡的影响
2.33 -MA对自噬的影响耐药细胞每个高倍镜下平均15个自噬泡,TR+5-Fu组平均14个自噬泡,差异无统计学意义(P=0.83);TR+3-MA组每个高倍镜下平均约1.5个,与TR+3-MA+5-Fu组的2个比较差异无统计学意义(P=0.78)。但TR+3-MA组及TR+3-MA+5-Fu组与TR组及TR+5-Fu组比较差异均具有统计学意义(P<0.05)(见图3-4)。
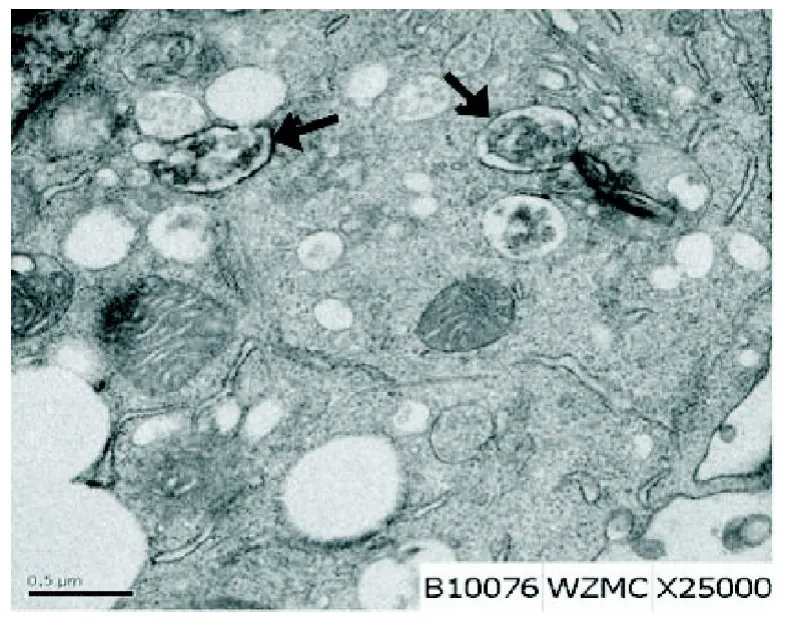
图3 电镜下典型自噬体(图中黑色箭头所示)
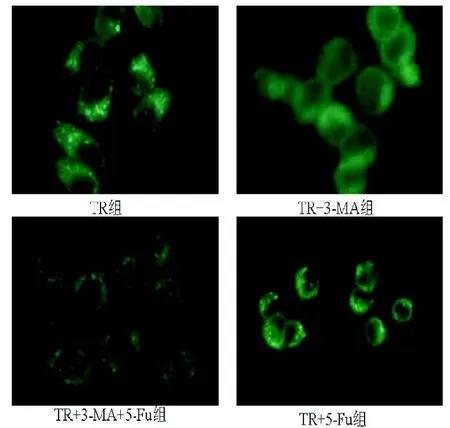
图4 MDC染色下不同组细胞自噬水平(×400)
3 讨论
自噬作为耐药细胞生存的重要机制,信号调控十分复杂,在整个过程中关键分子是位于启动阶段的I I I型PI3K和Tor/mTor激酶:I I I型PI3K通过磷酸化磷脂酰肌醇来募集胞浆中含FYVE或PX结构域的蛋白质,用于自噬体膜的形成,3-MA通过抑制该激酶可有效抑制自噬活性[7];mTOR通过调控核糖体蛋白质S6(p70S6)的活性从而发挥控制细胞自噬活性的作用[8],而雷帕霉素能通过抑制该激酶活性,达到促进自噬的目的[9]。实验证明,无论是通过基因敲除、沉默还是自噬抑制剂处理,抑制细胞自噬通路都可以极大地增强肿瘤细胞对抗肿瘤药物和放疗射线的敏感性,使肿瘤细胞的死亡率增加[1,10-11]。然而抑制自噬能否逆转肿瘤细胞的耐药特性,目前研究较少。
我们在前期诱导的耐5-Fu结直肠癌细胞株基础上,引入自噬抑制剂3-MA抑制耐药细胞的自噬活性,研究自噬抑制剂对耐药细胞化疗敏感性的影响,结果发现:单独使用3-MA对耐药细胞增殖活性影响较小,增殖抑制率为9.6%,对耐药细胞凋亡的影响也较小,凋亡率为5.7%,而3-MA与5-Fu联合使用时,肿瘤细胞的增殖抑制率和凋亡率均显著升高,分别达71.6%±2.9%和36.6%±2.9%,远远高于单用5-Fu组。以上结果提示,自噬抑制剂3-MA仅有较弱的抗肿瘤作用,仅仅抑制耐药细胞的自噬活性达不到杀死肿瘤细胞的目的,但3-MA具有较强的增敏作用,能逆转肿瘤细胞的耐药,与Ahn等[12]的研究结果一致。
3-MA与5-Fu联合应用时,一方面当耐药细胞的自噬功能被抑制后,肿瘤细胞赖以生存的核苷、氨基酸和脂肪酸等大分子物质循环利用减少,当一些生长发育关键分子合成受阻时耐药细胞的生存能力显著下降,从而走向死亡;另一方面当PI3K/Akt通路被抑制后,磷酸化的Akt蛋白显著下降,信号通路下游的一些关键蛋白如YB-1[13]表达降低,以及重要的信号通路如VEGF-C/NRP、p38、p53等受到抑制,在5-Fu的作用下促进了细胞的死亡。我们的实验结果表明自噬抑制剂3-MA增强了5-Fu的化疗敏感性,抑制肿瘤细胞自噬活性,促进细胞凋亡,是一种潜在的化疗增敏剂,也从反面证实自噬在肿瘤细胞耐药形成过程中起保护作用。
综上所述,自噬在结直肠癌细胞耐药获得过程中起到了保护作用,抑制自噬,可以提高耐药肿瘤细胞对化疗的敏感性,但自噬在肿瘤耐药形成过程中的具体机制及自噬抑制剂在临床上的应用有待进一步研究。
[1]Shi Y, Tang B, Yu PW, et al. Autophagy protects against oxaliplatin-induced cell death via ER stress and ROS in Caco-2 cells[J]. PLoS One, 2012, 7(11): 51076.
[2]Fu J, Liu ZG, Liu XM, et al. Glioblastoma stem cells resistant to temozolomide-induced autophagy[J]. Chin Med J (Engl), 2009, 122(11): 1255-1259.
[3]Cui J, Gong Z, Shen HM. The role of autophagy in liver cancer: molecular mechanisms and potential therapeutic targets[J]. Biochim Biophys Acta, 2013, 1836(1): 15-26.
[4]汪鑫, 刘天助, 郭洪波, 等. 恶性胶质瘤耐药细胞通过Beclin 1上调自噬抵抗替莫唑胺化疗[J]. 中华神经医学杂志, 2013, 12 (8): 757-762.
[5]苑博, 康劲松, 杨晓春, 等. 自噬在紫杉醇诱导人卵巢癌顺铂耐药细胞死亡中的作用[J]. 中国实验诊断学, 2013, 17(1): 46-48.
[6]胡万乐, 何占红, 蒋芳, 等. 5-Fu诱导人大肠癌SW480细胞株耐药与自噬活性的变化[J]. 中国中西医结合外科杂志, 2013, 19(3): 279-284.
[7]Hirosako K, Imasato H, Hirota Y,et al. 3-Methyladenine specifically inhibits retrograde transport of cation-independent mannose 6-phosphate/insulin-like growth factor II receptor from the early endosome to the TGN[J]. Biochem Biophys Res Commun, 2004, 316(3): 845-852.
[8]Mizushima N, Klionsky DJ. Protein turnover via autophagy: implications for metabolism[J]. Annu Rev Nutr, 2007, 27: 19-40.
[9]Loewith R, Jacinto E, Wullschleger S, et al. Two TOR complexes, only one of which is rapamycin sensitive, have distinct roles in cell growth control[J]. Mol Cell, 2002, 10 (3): 457-468.
[10]Groves B, Abrahamsen H, Clingan H, et al. Aninhibitory role of the G-protein regulator AGS3 in mTOR-dependent macroautophagy[J]. PLoS One, 2010, 26, 5(1): e8877.
[11]Broadley K, Larsen L, Herst PM, et al. The novel phloroglucinol PMT7 kills glycolytic cancer cells by blocking autophagy and sensitizing to nutrient stress[J]. J Cell Biochem, 2011, 112(7): 1869-1879.
[12]Ahn JH, Lee M. Suppression of autophagy sensitizes multidrug resistant cells towards Src tyrosine kinase specific inhibitor PP2[J]. Cancer Lett, 2011, 310(2): 188-197.
[13]龙璐璐, 许文林, 沈慧玲, 等. YB-1抑制三氧化二砷诱导的胃癌细胞自噬机制[J]. 山东医药, 2012, 52(13): 4-6.
(本文编辑:丁敏娇)
Effect of 3-methyladenine on autophagy and cell proliferation in 5-Fu-resistant colon cancer cell line SW480
HU Wanle, WANG Lingqin, CHEN Suping, CHEN Rong.Traditional Chinese with Combined Western Medicine Anorectal, the Second Affiliated Hospital of Wenzhou Medical University, Wenzhou, 325027
Objective:To investigate the effects of 3-methyladenine on chemotherapy sensitivity of 5-Furesistant colon cancer cell line SW480 and reversing the 5-Furesistant in colon cancer.Methods:Stepwise 5-Fu selection was used to establish the 5-Fu resistant colon cancer cells (100 μg/L). The cells were dealed with 3-methyladenine (10 μmol/L) fistly and 5-Fu (200 μg/L) for 24 hours. Cell proliferation inhibition rate was measured with CCK-8. Apoptosis rate was detected with flow cytometer. Autophagic vacuoles in cells were observed by means of transmission electron microscopy and monodansylcadaverine (MDC).Results:The inhibition rate of 3-methyladenine in the 5-Fu resistant cell autophagy activity was 89.7%, cell proliferation was 9.6%, but apoptosis rate was just 5.7%, were obviously higher than that in 5-Fu resistant cells (P<0.05). After dealing with 3-methyladenine(10 μmol/L) fistly and 5-Fu (200 μg/L) for 24 hours, the level of cell proliferation inhibition rate was 71.6%±2.9% and the apoptosis rate was 36.6%±2.9%, while dealing with 5-Fu (200 μg/L) for 24 hours, the level of cell proliferation inhibition rate was 23.6%±2.9% and the apoptosis rate was 10.3%±2.5%. After dealing with 3-methyladenine, the cell proliferation inhibition rate and apoptosis rate were markedly higher than that of 5-Fu only.Conclusion:The anticancer capacity of 3-methyladenine in colon cancer is weak, but it can reverse the 5-Fu-resistant in colon cancer partly, 5-Fu-induced apoptosis in 5-Fu resistant colon cancer cells may be enhanced by the inhibitor of autophagy.
colonrectal neoplasms; autophagy; 3-methyladenine; fluorouracil; drug resistance
R632.5
A
1000-2138(2014)03-0189-04
2013-10-25
温州市科技计划基金资助项目(Y2012 0012)。
胡万乐(1978-),女,浙江温州人,主治医师。通信作者:陈荣,主任医师,副教授,Email:cr13806887833@ 163.com。

