豚鼠卵巢组织片和分离的窦前卵泡玻璃化冷冻效果比较
张悦,陈文铭,谢迟迟,谢双双,孙君慧,徐芝慧,刘军,周颖
(1.广西医科大学附属第一医院 生殖医学研究中心,广西 南宁 530021;2.温州医科大学附属第一医院 生殖医学中心,浙江 温州 325015;3. 澳大利亚莫纳什大学 医学研究所,克莱顿 3800)
豚鼠卵巢组织片和分离的窦前卵泡玻璃化冷冻效果比较
张悦1,陈文铭2,谢迟迟2,谢双双2,孙君慧2,徐芝慧2,刘军3,周颖2
(1.广西医科大学附属第一医院 生殖医学研究中心,广西 南宁 530021;2.温州医科大学附属第一医院 生殖医学中心,浙江 温州 325015;3. 澳大利亚莫纳什大学 医学研究所,克莱顿 3800)
目的:比较分析不同玻璃化冷冻配方对豚鼠卵巢组织片和单个窦前卵泡形态、存活率及体外发育能力的影响。方法:取5周龄雌性豚鼠卵巢,实验分新鲜对照组、组织片A液毒性组、组织片B液毒性组、卵泡A液毒性组和卵泡B液毒性组,及相应的冻融组,即组织片A液冻融组、组织片B液冻融组、卵泡A液冻融组、卵泡B液冻融组,共9组行毒性试验和冷冻保存。各组卵巢组织片行HE染色形态学观察,分离窦前卵泡经锥虫蓝染色活力测试并行体外培养。结果:A液冻融组和B液冻融组豚鼠卵巢组织片HE染色光镜观察可见大部分卵泡形态正常,A液组和B液组异常窦前卵泡数与新鲜对照组比较差异有统计学意义(P<0.05);在分离的窦前卵泡锥虫蓝染色活力测试中,冻融卵巢组织片A 组的卵泡复苏率(为66.1%)显著低于(P<0.05)冻融卵泡B液组(为78.5%)和新鲜对照组(为87.5%);其余组别之间差异无统计学意义。体外培养卵泡发育情况组织片冷冻组比卵泡冷冻组差,以A液组尤甚,第6天存活卵泡数目不足(为20.0%),与新鲜对照组(为60.0%)及卵泡B液冻融组(为50.0%)相比较差异有统计学意义(P<0.05)。结论:玻璃化冷冻法能较好地冷冻保存豚鼠卵巢组织片和分离的窦前卵泡,而单个豚鼠窦前卵泡玻璃化冷冻优于卵巢组织片的玻璃化冷冻;B液较A液更适合豚鼠卵巢卵泡的玻璃化冷冻保存。窦前卵泡的体外培养证明玻璃化冷冻复苏卵泡具有一定的继续发育能力。
玻璃化;冷冻保护剂;豚鼠;窦前卵泡
随着人类辅助生殖技术的发展,通过冷冻保存卵巢组织或卵泡经体外培养及体外成熟技术获得大量成熟并具有受精能力的卵母细胞已成为可能。这可以帮助因疾病必须切除卵巢,或必须行放、化疗可能损伤卵巢功能[1]的女性患者保存生育能力[2-3]。窦前卵泡是潜在的获得卵母细胞的巨大的来源,而豚鼠窦前卵泡的发育与人相似[4]。且豚鼠体积小,繁殖快,可大量获取实验所需材料。因此研究豚鼠窦前卵泡的冷冻保护将对保存女性生殖能力及濒危物种有巨大的意义。本研究比较分析豚鼠卵巢组织片和分离的窦前卵泡玻璃化冷冻效果,为筛选更为适合豚鼠卵泡冷冻保存的玻璃化方案提供实验依据。
1 材料和方法
1.1 实验试剂L-15(Sigma,L4386),胎牛血清(FBS,Sigma,ZLI-9039),I型胶原酶(Sigma,C0130),DNA酶I(Sigma,DN-25),α-MEM(Gibco,12571),二甲基亚砜(DMSO,Sigma,D-2650),乙二醇(EG,Sigma,E-9129),蔗糖(Sigma,S1888),Ficoll-70(Sigma,06841),重组人FSH(r-hFSH,Merck Serono),锥虫蓝(Sigma,T8154)。
A液组的平衡液(ES液)为7.5% DMSO+7.5% EG +L-15,冷冻液(VS液)成分为15% DMSO+15% EG +L-15;B液组中ES液为10% EG+4.5% Ficoll-70+ 0.075 mol/L蔗糖,VS1液为20% EG+9.0% Ficoll-70+0.15 mol/L蔗糖,VS2液为40% EG+18% Ficoll-70+0.3 mol/L蔗糖,A、B两液组的解冻液均为含1 mol/L、0.5 mol/L及0.25 mol/L蔗糖的L-15。
卵泡酶解液组成为2.5 mg/mL I型胶原酶+100 μg/mL DNA酶I+PBS。
1.2 卵巢的获取和处理5周大150 g雌性豚鼠30只,购自上海生旺实验动物有限责任公司。颈椎脱臼处死豚鼠,使用无菌取材器械剖腹取出卵巢,放入预冷的取材液中,30 min内送回实验室。 在净化工作台中,将卵巢移入盛有取材液(L-15+10% FBS)的培养皿(Falcon,353037)中,置于体视显微镜下,用显微器械剔除血管及卵巢周围结缔组织。
1.2.1 卵巢组织片:实验分新鲜对照组、组织片A液毒性组、组织片B液毒性组、组织片A液冻融组、组织片B液冻融组。毒性试验为毒性组与冷冻组在相同条件下平衡于冷冻液和解冻液中,但不经历冷冻与解冻过程。每组随机挑取半片卵巢放入甲醛固定,其余备用。
1.2.2 分离窦前卵泡:分新鲜对照组、卵泡A液毒性组和卵泡B液毒性组、卵泡A液冻融组、卵泡B液冻融组。将卵巢片转入含1 mL酶解液的培养皿(Falcon,353037)中,置于38.5 ℃,5% CO2的培养箱中孵育30 min后,加入等体积胎牛血清终止酶解。细胞悬液50 g离心5 min,吸取上清液丢弃,加等量基础培养液重悬细胞。挑取基膜完整的窦前卵泡(颗粒细胞2~5层)移入预先平衡的培养皿(Falcon,353002)覆盖有矿物油(Sigma,33076)的30 μL基础液微滴中存放于38.5 ℃,5% CO2的培养箱中。
1.3 冷冻与解冻及毒性试验
1.3.1 分离窦前卵泡玻璃化冷冻与解融及毒性试验:选取每半卵巢用消毒刀片切成4~6块大小相近的组织片,酶解加机械法分离获得的窦前卵泡分5组,标记为卵泡A液冻融组与卵泡B液冻融组、卵泡A液毒性组、卵泡B液毒性组及新鲜卵泡对照组。卵泡A液冻融组:将卵泡用巴氏吸管吸取移至ES液滴中停留10 min,然后分别移至VS液滴停留3 min。再将窦前卵泡置于载杆亲水端,立即投入液氮,最后移入液氮灌保存。卵泡B液冻融组:窦前卵泡移至ES冷冻液滴停留7 min。再分别过VS1、VS2冷冻液滴停留2 min、1 min。移至载杆,投入液氮做好标记。液氮储存至少1周后进行解冻,卵泡解冻:将载杆从液氮中取出,载有卵泡的一端迅速浸入解冻液中,分别经过1 mol/L、0.5 mol/L、0.25 mol/L蔗糖L-15溶液,每次5 min。卵泡毒性试验A液、B液组不进行液氮冷冻,仅经过相应冷冻液和解冻液浸泡过程。各组卵泡均移入预先平衡的培养皿(Falcon,353002)覆盖有矿物油(Sigma,33076)的30 μL基础液微滴中存放于38.5 ℃,5% CO2的培养箱中。
1.3.2 卵巢组织片玻璃化冷冻与解融及毒性试验:将卵巢用无菌镊子夹到清洁消毒过的纱布上,用消毒刀片切成4~6块大小相近的组织片。随机平均分配所有组织片为5组,分别标记为组织片A液冻融组、组织片B液冻融组及组织片A液毒性组、组织片B液毒性组和新鲜组织片对照组。组织片A液冻融组:室温下将组织块移入平衡液ES中停留10 min,然后移入VS冷冻液中3 min,之后取出卵巢组织片置于纱布上吸去表面冷冻液,放入1.8 mL冷冻管(预先做好标记)中,4~6片/管,浇上液氮,立即投入液氮进行冷冻保存。组织片冷冻B液组:室温下将卵巢组织片移入ES液中停留7 min 随后移入VS1液、VS2液中逗留2 min、1 min,余操作步骤A组。液氮储存至少1周后解冻。从液氮罐中取出冷冻管,先于室温下放置1 min,再放至37 ℃水浴中轻轻摇晃至液氮出现部分溶化,用无菌镊子取出组织片分别经过1 mol/L、0.5 mol/L及0.25 mol/L蔗糖L-15溶液,每次5 min。组织片毒性A、B组不进行液氮冷冻,仅经过相应冷冻液和解冻液浸泡过程。将各组组织片取2~3小块放入甲醛中固定,其余移至加有1 mL酶解液的3037培养皿中分离窦前卵泡,将卵泡移入预先平衡的培养皿(Falcon,353002)覆盖有矿物油的30μ L基础液微滴中,存放于38.5 ℃,5% CO2的培养箱。
1.4 锥虫蓝卵泡活力测试由5 μL 4%锥虫蓝溶液+100 μL L-15液组成染液,用移液器在培养皿(Falcon,353002)上制成15~18个200μL锥虫蓝微滴,上面覆盖组织培养油。将各组基膜完整的窦前卵泡移入200μ L染液中室温下染色15 min后转移入事先制成的20μ L染液观察滴中,每个观察滴含5个窦前卵泡。400倍显微镜下(德国蔡司,Axio106)观察卵泡着色情况。20 min内由两人分别镜检评估,死细胞染成蓝色,活细胞未染色(见图1)。卵泡活力分级按照Jewgenow等[5]所采用的标准:I级0~3个(<10%)颗粒细胞着色,并且卵细胞不明显着色;I I级4~15个(10%~50%)颗粒细胞着色,卵细胞不明显着色;I I I级0~3个(<10%)颗粒细胞着色,卵细胞明显着色;IV级4~15个(10%~50%)颗粒细胞着色,卵细胞明显着色;V级>50%颗粒细胞着色。结果判定:I级和I I级为活的卵细胞,I级和I I I级为活的颗粒细胞。锥虫蓝染色卵泡存活率及复苏率计算公式:存活率=[活卵泡数/(死卵泡数+活卵泡数)]×100%;复苏率=(冷冻复苏后卵泡存活率/新鲜卵泡存活率)×100%。

图1 显微镜下分离卵泡锥虫蓝染色结果(×400)
1.5 窦前卵泡的体外培养选取各组中锥虫蓝活力试验的I级和I I级卵泡进行体外培养,将存活的窦前卵泡移入96孔培养板中,每孔含300μL培养液(1 mL ITS+10 unit r-hFSH 20 μL+5% FBS 5 mL+1 mL双抗+94 mL α-MEM/100 mL),每孔移入1个卵泡。培养板置于38.5 ℃,100%湿度,5% CO2培养箱中进行培养6 d。加入卵泡日为培养第0天,分别于第2、第4、第6天,即隔日换一半培养液(150 μL)。每次换液后在倒置显微镜下观察,判断并记录卵泡存活数、死亡卵泡数和异常卵泡数。窦前卵泡发育过程中的质量评估标准:健康的卵泡呈圆形或椭圆形,基底膜完整,部分可见圆而明亮的卵母细胞,颗粒细胞密而紧凑,无致密体,呈持续生长判为存活正常卵泡。凡出现基膜出现缺口、立体结构塌陷、卵母细胞和颗粒细胞结构异常判为结构异常卵泡。如果胞质不匀色暗,呈现大量异常颗粒样物质或卵母细胞和颗粒细胞降解、严重皱缩、生长停滞视为死亡卵泡。
1.6 组织形态学检查卵巢组织片新鲜对照组、玻璃化A液冻融组、玻璃化B液冻融组随机挑取纵切的半片卵巢置于固定液(4%多聚甲醛)中固定24 h,脱水、石蜡包埋,4μ m厚连续切片60张,行苏木精伊红(HE)染色,每隔5张切片在高倍光镜(× 400)下,选择相对卵泡密度高的视野观察玻片,并拍照片记录。每个标本共计数10个高倍光镜视野,计数含卵细胞核的窦前卵泡总数及正常、异常卵泡数,卵泡分类按照Sadeu等[4]分类标准。
1.7 统计学处理方法采用SPSS16.0软件。用卡方检验和单因素方差分析(one way ANOVA)比较,P<0.05为差异有统计学意义。
2 结果
2.1 卵泡分离与锥虫蓝染色活力测试毒性试验各组分离的卵泡大部分为存活卵泡,其中新鲜对照组分离的窦前卵泡存活率最高,组织片毒性组和卵泡毒性组比较新鲜对照组卵泡存活率稍低,但差异无统计学意义(P>0.05)(见表1)。

表1 毒性试验各组分离窦前卵泡数及锥虫蓝活力测试结果
各冻融实验组分离的卵泡存活率低于新鲜对照组,差异有统计学意义(P<0.05)(见表2)。而组织片冻融组中,A液组与B液组之间差异无统计学意义(P>0.05),在卵泡冻融组中,A液组与B液组差异也无统计学意义(P>0.05),但卵泡A、B冻融组卵泡复苏率显著高于组织片A、B冻融组卵泡复苏率,差异有统计学意义(P<0.05)。

图2 细胞培养中形态记录图(×400)

表2 冻融实验各组分离窦前卵泡数及锥虫蓝活力测试结果
2.2 窦前卵泡的体外培养如图2所示,随着体外培养时间的延长,各组均出现部分卵泡逐渐失去立体结构,卵泡塌陷,基膜破裂,卵母细胞与颗粒细胞分离,卵母细胞逸出,甚至结构解体死亡,正常卵泡存活数减少而异常卵泡数及死亡卵泡数逐渐增多。组织片A液、B液冻融组卵泡发育情况差,以A液冻融组尤甚,在第2天出现多数卵泡的卵母细胞与颗粒细胞分离卵母细胞排出、变黑现象,而在第4天过半卵泡出现死亡,第6天时存活卵泡数目不足20.0%。卵泡冷冻组的卵泡培养情况好于组织片冷冻组,相比较差异有统计学意义(P<0.05),其中卵泡B液冻融组第6天卵泡存活率达50.0%,与新鲜组比较差异无统计学意义(P>0.05)。各毒性组之间卵泡培养情况相类似,与新鲜对照组比较差异无统计学意义(P>0.05)(见图3-4)。

图3 毒性组窦前卵泡体外培养第2天到第6天卵泡存活率比较
2.3 卵巢组织形态学观察新鲜对照组、组织片A液冻融组和B液冻融组豚鼠卵巢组织切片HE染色均可见各级卵泡(见图5),卵巢皮质以窦前卵泡为主,大部分卵泡呈圆形或卵圆型,有完整的颗粒细胞层,色泽明亮,层次分明,颗粒细胞层周围光滑;少量卵泡表现为基底膜模糊或破损,卵泡细胞松散或游离到卵泡外,卵母细胞逸出卵泡,变形或崩解。A液冻融组和B液冻融组都保存大部分卵泡存活,两组之间的异常卵泡数差异无统计学意义(P>0.05),而与新鲜对照组比较,AB冻融组差异均具有统计学意义(P<0.05)。见表3。
3 讨论

图4 冻融组窦前卵泡体外培养第2天到第6天卵泡存活率比较
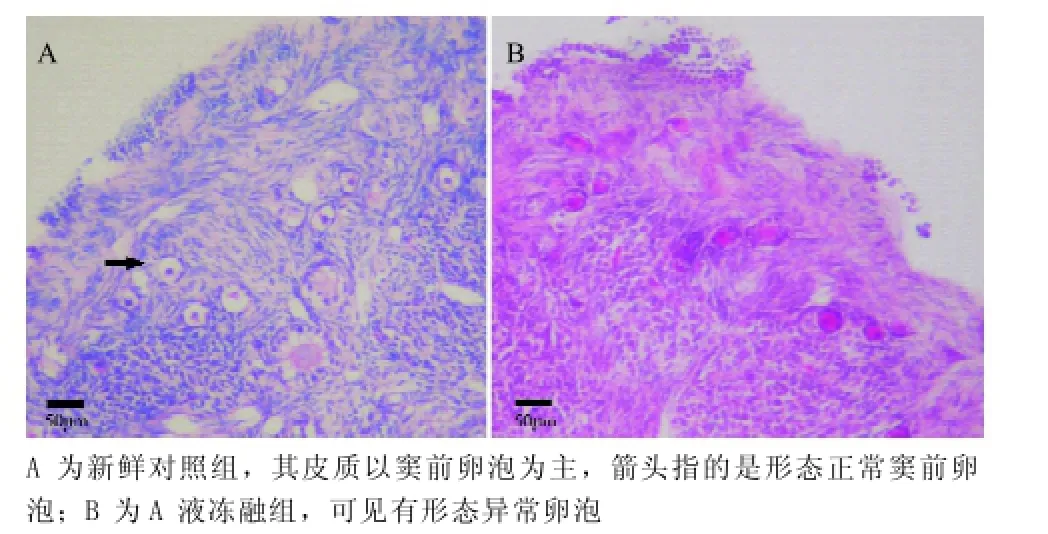
图5 豚鼠卵巢片组织切片HE染色(×200)

表3 各组卵巢组织切片HE染色窦前卵泡形态及计数比较
卵巢皮质的冷冻因其含有大量的原始卵泡,结构相对简单,更能耐受冷冻损伤而存在优势,且不延误肿瘤患者的最佳治疗时机,是癌症患者放化疗前生育力保存的主要方法,适合于生育年龄及青春期前的高治愈率女性癌症患者。与精子、胚胎等冷冻已存在较为标准和成熟的冷冻方案相比,多种细胞成分组成的卵巢组织结构复杂,因而冷冻更具有挑战性。目前卵巢组织冷冻保存方法主要有程序化冷冻方法和玻璃化冷冻法。前者应用低浓度冷冻保护剂在程序冷冻仪控制下缓慢降温使得细胞内水份与细胞外冷冻保护剂充分交换渗透达到保护细胞的作用,需要精密仪器的高昂费用,耗时耗人力,难以在基层医疗单位推广应用。玻璃化冷冻方法中高浓度冷冻保护剂渗透入细胞内以提高胞浆黏稠度,通过快速降温使细胞形成玻璃化态,减少甚至避免细胞内外冰晶形成,减轻溶质损伤,且无需精密仪器控制降温,操作简便,容易推广。传统的玻璃化冷冻是采用麦管封闭式装载卵巢组织,冷冻降温速度达1 500 ℃/min。如何提高冷冻降温速度是玻璃化技术的关键,因此人们通过改良方法如采用尼龙网、电镜铜网、开放拉细麦管(OPS)、cryoloop等开放系统装载卵巢组织,直接与液氮接触来加快冷冻降温速度达15 000 ℃/min,使组织细胞较好的形成“玻璃化”状态,尽量减少冰晶的形成。但这种改良方法不一,冷冻保护剂也五花八门,至今没有统一的冷冻保护剂和方法。玻璃化冷冻中采用的冷冻保护剂配方和降温速率是关键问题,在本实验中我们采用液氮直接覆盖玻璃化冷冻法(direct cover vitrification,DCV)[6-7]和两组玻璃化冷冻保护液,玻璃化冷冻A液(DMSO+EG)为常用冷冻保护剂配方,玻璃化冷冻B液(EG+Ficoll)[8]的实验研究较为少见,但都未见在豚鼠卵巢冷冻方面的应用。
本实验卵巢组织片固定切片HE染色结果显示冻融卵巢皮质以窦前卵泡为主,大部分窦前卵泡形态结构正常完好保存,其中A液冻融组复苏卵泡形态学结果与周新惠等[9]的大鼠卵巢组织使用相同浓度DMSO+EG进行冷冻保护效果相似。而A液与B液对豚鼠卵巢组织片冷冻效果也无明显差异,但A液冻融组与B液冻融组的异常卵泡率与新鲜对照组比较,差异有统计学意义(P<0.05),表明玻璃化冷冻过程对豚鼠卵巢卵泡的形态结构造成一定的影响,导致异常卵泡数的增加,可能原因是高浓度冷冻保护剂对卵泡的毒性损伤,因此如何减少其对细胞的损害,应该在不影响渗透效果的前提下,尽可能降低冷冻保护剂的浓度,缩短渗透时间,另一方面,很有可能是由于冷冻保护剂未能充分渗透入卵巢组织片因而对卵泡没有起到较好的保护效果导致异常卵泡增多。可以尝试通过增加组织片平衡时间实验来改善这一情况。因此如何寻找冷冻保护剂浓度与平衡时间的契合点是研究者努力的方向。
在卵泡锥虫蓝染色活力检测中,本研究的毒性试验数据表明,实验各组与新鲜对照组相比差异无统计学意义,说明玻璃化冷冻液的短时间渗透对卵泡的损害较轻微。而对于冷冻实验组而言,单个窦前卵泡冻融组对比组织片冻融组,其中卵泡B液冻融组卵泡存活率则明显高于组织片A液冻融组,差异有统计学意义。我们的实验结果与报道[10]研究结果一致:同种冷冻保护液同样浸液时间情况下,单个卵泡冷冻效果比卵巢组织片好,可能是由于卵巢组织体积相对大且致密,同样时间的冷冻保护剂渗透不够充分,而单个卵泡则能渗透充分,形成较好的脱水效果。
卵巢卵泡冷冻保存的目的是为了保持年轻女性癌症患者的生育力,需要将冻融卵巢卵泡进行体内(移植)或体外培养,获得有受精能力的卵母细胞,才有可能获得妊娠,恢复生育功能。因此应用窦前卵泡体外培养法来检测其体外发育能力是衡量卵巢/卵泡冷冻保存效果的不可或缺的指标之一[11]。本实验中豚鼠卵巢组织片冻融组的窦前卵泡培养效果不甚理想,而卵泡冻融组的窦前卵泡存活率也低于新鲜对照组,且培养仅6 d,绝大部分卵泡的立体结构丧失,卵泡存活率不超过50%。可能是培养条件的不适宜不同物种之间的差异或者培养方法(普通培养方法)的局限性等,其他学者也都有类似报道,冻融卵泡经培养后发育迟缓,存活率明显下降[12-13]。如何在体外培养过程中维持卵泡立体结构的完整性是研究者所面临的难题。有研究[14]发现窦前卵泡在体外培养期间颗粒细胞有逐渐与卵母细胞分离的趋势,导致卵泡结构崩解,这与我们的实验结果相似。多年来学者们运用了卵泡二维、三维培养法等试图维持颗粒细胞和卵母细胞间的结构完整性,取得一定的成功。这方面仍然值得我们进一步的研究,以找寻最优冷冻保存及培养方法,为现代女性生殖能力保存及物种保护方面提供实验依据。
本研究结果表明,玻璃化冷冻液毒性试验对卵泡并未造成明显的损害;而冻融过程导致豚鼠卵巢存活卵泡数量有所下降,可见冻融过程是造成豚鼠卵巢卵泡损害的主要原因。玻璃化冷冻法能较好地冷冻保存豚鼠卵巢组织片和分离的窦前卵泡,而单个豚鼠窦前卵泡玻璃化冷冻效果优于卵巢组织片的玻璃化冷冻;B液较A液更适合豚鼠卵巢卵泡的玻璃化冷冻保存。窦前卵泡的体外培养证明玻璃化冷冻复苏卵泡具有一定的继续发育能力。
[1]Decanter C, Robin G. Fertility preservation strategies in young women in case of breast cancer or hematologic malignancy[J]. Gynecol Obstet Fertil, 2013, 41(10): 597-600.
[2]Imesch P, Scheiner D, Xie M, et al. Developmental potential of human oocytes matured in vitro followed by vitrification and activation[J]. J Ovarian Res, 2013, 6(1): 30.
[3]Donnez J, Dolmans MM. Fertility preservation in women [J].Nat Rev Endocrinol, 2013, 9(12): 735-749.
[4]Sadeu JC, Adriaens I, Cortvrindt R, et al. Study of folliculogenesis in vivo in guinea pig[J]. Theriogenology, 2007, 68(9): 1228-1239.
[5]Jewgenow K, Penfold LM, Meyer HH, et al. Viability of small preantral ovarian follicles from domestic cats after cryoprotectant exposure and cryopreservation[J]. J Reprod Fertil, 1998, 112(1): 39-47.
[6]Chen SU, Chien CL, Wu MY, et al. Novel direct cover vitrification for cryopreservation of ovarian tissues increases follicle viability and pregnancy capability in mice[J]. Hum Reprod, 2006, 21(11): 2794-2800.
[7]Xu Z, Wang X, Wu Y, et al. Slow-controlled freezing versus speed-cooling for cryopreservation of whole guinea pig ovaries[J]. Theriogenology, 2012, 77(3): 483-491.
[8]Segino M, Ikeda M, Hirahara F, et al. In vitro follicular development of cryopreserved mouse ovarian tissue[J]. Reproduction, 2005, 130(2): 187-192.
[9]周新惠. 大鼠卵巢组织直接覆盖式玻璃化冷冻保存和自体移植的研究[D]. 浙江大学, 2009.
[10]Amorim CA, Rondina D, Rodrigues AP, et al. Cryopreservation of isolated ovine primordial follicles with propylene glycol and glycerol[J]. Fertil Steril, 2004, 81(Suppl 1): 735-740.
[11]Vanacker J, Luyckx V, Amorim C, et al. Should we isolate human preantral follicles before or after cryopreservation of ovarian tissue?[J]. Fertil Steril, 2013, 99(5): 1363-1368.
[12]Hovatta O, Wright C, Krausz T, et al. Human primordial, primary and secondary ovarian follicles in long-term culture: effect of partial isolation[J]. Hum Reprod, 1999, 14(10): 2519-2524.
[13]Abir R, Roizman P, Fisch B, et al. Pilot study of isolated early human follicles cultured in collagen gels for 24 hours [J]. Hum Reprod, 1999, 14(5): 1299-1301.
[14]Murray A, Spears N. Follicular development in vitro[J]. Semin Reprod Med, 2000, 18(2): 109-122.
(本文编辑:吴健敏)
Comparative study between guinea pig ovarian fragments and isolated preantral follicles cryopreservation with vitrification
ZHANG Yue1, CHEN Wenming2, XIE Chichi2, XIE Shuangshuang2, SUN Junhui2, XU Zhihui2, LIU Jun3, ZHOU Ying2.1.The Reproductive Medicine Centre, the First Affiliated Hospital of Guangxi Medical University, Nanning, 530021; 2.Centre for Reproductive Medicine, the First Affiliated Hospital of Wenzhou Medical University, Wenzhou, 325015; 3.Monash Institute of Medical Research, Monash University, Clayton, 3800
Objective:To compare the follicle morphology, survival rate and in vitro growth potential of guinea pig ovarian fragments and isolated preantral follicles after vitrification.Methods:Five- weeks aged female guinea pigs were used. Two vitrification solutions (solution A and B) were applied to vitrify guinea pig ovarian fragments and isolated preantral follicles. The toxicity and cryopreservation efficiency of the two solutions were tested on both fragments and isolated preantral follicles. The ovaries were observed using hematoxylin and eosin staining; the viability of the follicles was evaluated by trypan blue. The isolated preantral follicle was cultured in vitro to evaluated the follicle development potential.Results:Based on morphological analyze, the majority follicles were normal in fragments cryopreservation, but the abnormal follicle were higher than fresh group, P<0.05. The recover rates of follicle after being thawed using trypan blue were 66.1% in solution A fragment vitrification group, significantly lower than that in solution B follicle vitrification group (78.5%) and fresh group (87.5%), P<0.05. No significance was found among other groups. During in vitro culture, the vitrifiedfragments showed poorer develop potential than follicle vitrification groups, typically solution A fragment group, and the follicle survival rate by day 6 was lower than (20.0%), significantly lower than fresh group (60.0%) and solution B follicle vitrification group (50.0%), P<0.05. Conclusion: The results show that the vitrification can preserve guinea pig ovarian fragments and isolated preantral follicles, the latter one achieved better results. Solution B was more efficient in preserving guinea pig follicles. The follicles show growth potential during in vitro culture after being thawed.
vitrification; cryoprotectant; guinea pig; preantral follicles
R318.52
A
1000-2138(2014)04-0252-06
2013-11-22
国家自然科学基金资助项目(30370749);浙江省自然科学基金资助项目(LY13C120002);浙江省科技厅科研基金资助项目(2003C33001);温州市科技局对外合作项目(H20080061)。
张悦(1988-),女,浙江东阳人,硕士生。
周颖,教授,Email:zy-yin@163.com。

