siRNA靶向沉默成纤维细胞激活蛋白α对胶质瘤细胞U87增殖的影响
陈渊,王伟,涂明,吴哲褒,郑伟明
(温州医科大学附属第一医院 神经外科,浙江 温州 325015)
siRNA靶向沉默成纤维细胞激活蛋白α对胶质瘤细胞U87增殖的影响
陈渊,王伟,涂明,吴哲褒,郑伟明
(温州医科大学附属第一医院 神经外科,浙江 温州 325015)
目的:探讨小分子干扰RNA(siRNA)靶向沉默成纤维细胞激活蛋白α(FAP-α)表达对神经胶质瘤细胞株U87增殖的影响。方法:实验分为空白对照组(Blank组)、阴性对照组(NC组)和siRNA组,通过脂质体将siRNA转染至胶质瘤细胞株U87,使用Western blot法检测FAP-α基因的蛋白水平,同时检测NC组和siRNA组Bcl-2、caspase-3的表达变化,使用Real-time PCR法检测FAP-α和增殖核抗原(PCNA)的mRNA水平,CCK-8法评价转染后NC组和siRNA组细胞的增殖能力。结果:①转染48 h后,siRNA组细胞FAP-αmRNA、蛋白的表达明显低于NC组和Blank组,差异有统计学意义(P<0.01),siRNA组较NC组caspase-3蛋白表达增加(P<0.05);Bcl-2蛋白表达明显降低(P<0.01),siRNA组较NC组PCNA mRNA表达明显下降(P<0.01)。②转染后48、72和96 h siRNA组U87细胞吸光度值低于NC组,差异有统计学意义(P<0.01)。结论:应用siRNA沉默FAP-α基因的表达,可以抑制胶质瘤细胞U87的增殖,诱导胶质瘤细胞的凋亡。
神经胶质瘤;小分子干扰RNA;成纤维细胞激活蛋白α;细胞增殖
神经胶质瘤是中枢神经系统中最常见的恶性肿瘤之一,其生长快,生存率极低,目前的治疗方法难以取得满意的疗效[1-2]。近来的研究发现,成纤维细胞激活蛋白α(fibroblast activation protein alpha,FAP-α)选择性表达于90%以上恶性上皮性肿瘤,在肿瘤的生长、增殖、侵袭和转移中发挥重要的作用[3]。目前关于FAP-α在中枢神经系统肿瘤中研究较少,特别是胶质瘤,关于其在胶质瘤中的作用尚未有明确的结论,本实验拟通过脂质体将小分子干扰RNA(siRNA)转染至胶质瘤细胞株U87,靶向沉默FAP-α的表达,来探讨其对U87细胞增殖的影响,为胶质瘤的基因治疗提供一定的实验依据。
1 材料和方法
1.1 材料人神经胶质瘤细胞株U87由吴哲褒教授馈赠,DMEM培养基、胎牛血清、Opti-MEM购自美国Gibco公司;Trizol、Lipofectamine 2000购自美国invitrogen公司;反转录试剂盒购自Fermentas公司;SYBR Green Real time PCR Master Mix-Plus购自TOYOBO公司;CCK-8试剂盒购自DOJINDO公司;FAP-α抗体购自Abgent公司;caspase-3、Bcl-2购自CST公司;GAPDH、辣根过氧化物酶标记羊抗兔Ig-G(H+L)购自Bioworld公司;siRNA序列为:5’-GGUGGAUUCUUUGUUUCAATT-3’,5’-UUGAAACAAAGAA UCCACCTT-3’;阴性对照非特异性RNA序列为:5’-UU CUCCGAACGUGUCACGUTT-3’,5’-ACGUGACACGUUCGGAG AATT-3’,均由上海吉玛公司合成;相应PCR引物设计见表1。

表1 基因的引物序列
1.2 方法
1.2.1 细胞培养和转染:U87细胞用含有10%血清、100 U/mL青霉素、100 U/mL链霉素的高糖DMEM培养基培养于37 ℃、5% CO2的培养箱内。将U87细胞分为3组,分别为空白对照组(Blank组)、阴性对照组(NC组)和siRNA组。接种于培养板,待生长融合至70%~80%时用Lipofectamine 2000进行转染,具体步骤按说明书操作。
1.2.2 Real-time PCR实验:将转染后48 h各组细胞分别用Trizol法提取总RNA,反转录合成cDNA,进行Real-time PCR。反应条件:95 ℃,3 min,一个循环;95 ℃,15 s,60 ℃,1 min,40个循环。每个标准模板均生物学重复3次,目的基因的mRNA相对表达水平用2-ΔΔCt表示,其中ΔΔCt=[Ct目的基因(待测样品)-Ct内参照(待测样品)]-[Ct目的基因(校正样品)-Ct内参照(校正样品)]。
1.2.3 Western blot实验:各组细胞转染48 h后分别提取总蛋白,BCA法蛋白测定。SDS-PAGE电泳后,电转仪将蛋白转移至PVDF膜上,5%牛奶室温封闭2 h后,加入相应一抗,抗体稀释度为GAPDH(1:5 000)、FAP-α(1:1 000)、Bcl-2(1:1 000)、caspase-3(1:1 000),4 ℃孵育过夜,加入相应二抗,室温孵育1 h,ECL化学发光试剂盒显影。用Gel-Pro软件分析,以同一样品中目的蛋白与内参灰度值的比值作为蛋白的相对定量。实验重复3次。
1.2.4 CCK-8实验:将转染的细胞以合适的密度接种于96孔板,实验分为2组:NC组和siRNA组,每组设5个复孔,另设置5个调零孔,转染后时间设置为0 h,分别在24、48、72和96 h采用CCK-8检测细胞增殖能力,具体操作步骤按说明书进行。实验重复3次。
1.3 统计学处理方法采用SPSS19.0统计学软件。定量资料用±s表示,组间比较采用单因素方差分析或t检验,组间两两比较用LSD-t检验。P<0.05为差异有统计学意义。
2 结果
2.1 转染后U87胶质瘤细胞FAP-αmRNA和蛋白的表达转染Blank组、NC组和siRNA组FAP-αmRNA表达分别为:1.01±0.17、0.87±0.17、和0.14 ±0.01,差异有统计学意义(P<0.01),转染siRNA组FAP-αmRNA表达水平明显低于NC组和Blank组,差异有统计学意义(P<0.01),见图1。转染Blank组、NC组和siRNA组FAP-α蛋白表达分别为:0.74±0.01、0.73±0.04、和0.21± 0.05,差异有统计学意义(P<0.01),转染siRNA组FAP-α蛋白表达水平明显低于NC组和Blank组,差异有统计学意义(P<0.01),结果与Real-time PCR一致,见图1。

图1 转染后U87细胞FAP-α蛋白和mRNA表达变化
2.2 转染后U87细胞增殖的变化与NC组比较,转染后24、48、72和96 h siRNA组吸光度值(OD450值)降低,差异有统计学意义(P<0.01);转染后24 h二者比较差异无统计学意义(P>0.05),见图2。

图2 转染后U87细胞增殖的变化
2.3 转染后U87细胞Bcl-2、caspase-3和PCNA的表达Western blot法检测Bcl-2、caspase-3蛋白的表达,结果显示:siRNA组较NC组caspase-3蛋白表达增加(P<0.05);Bcl-2蛋白表达明显降低(P<0.01)。Real-time PCR检测PCNA的表达结果显示:siRNA组较NC组PCNA mRNA表达明显下降(P<0.01),见图3。
3 讨论
FAP-α是一种具有761个氨基酸的I I型穿膜糖蛋白[4],基因定位于染色体2q23[5],与多种疾病有关,包括创口愈合、慢性炎症和肿瘤等。越来越多的研究发现其在肿瘤的发生、发展、浸润和转移中发挥重要的作用,FAP-α的高表达与肿瘤的高危转移、低存活率、复发和极差预后密切相关[6-8],但具体的机制仍不明确。Huang等[9]用建立了表达FAP-α的小鼠乳腺肿瘤移植模型,发现该模型肿瘤生长速度远远快于对照组,提示FAP-α具有促进肿瘤生长的作用。温秋婷等[10]通过体外实验发现FAP能够促进卵巢癌细胞的增殖、侵袭和转移。同样的,朱琳等[11]研究发现FAP在体外可促进人脐静脉内皮细胞增殖迁移和小管形成,提示其在肿瘤血管生成起到一定的作用。
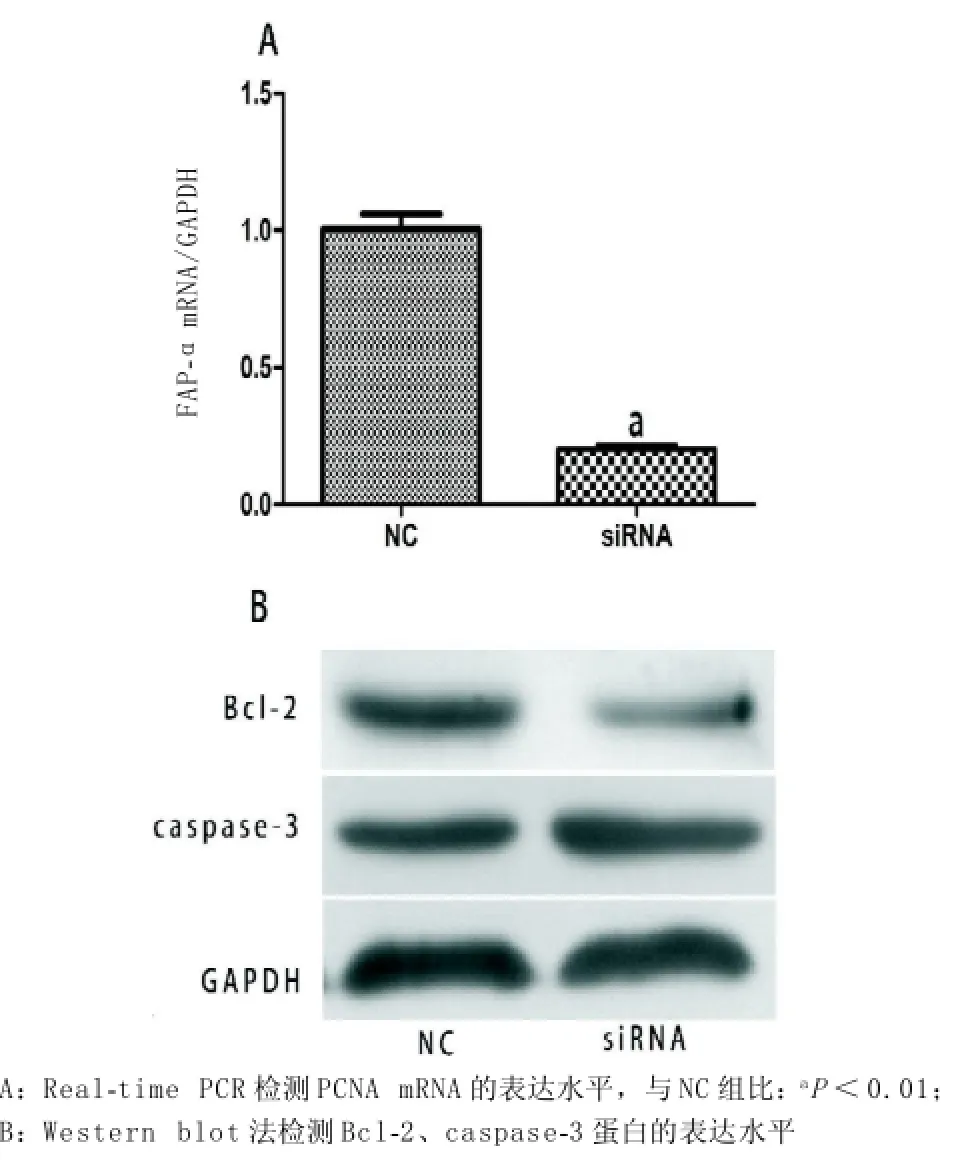
图3 转染后Bcl-2、caspase-3蛋白和PCNA mRNA表达情况
神经胶质瘤是颅内常见的肿瘤,治疗手段有限,预后极差。现有的研究发现FAP-α在正常脑组织中低表达或不表达,在星形细胞癌中,FAP-α的表达是与WHO分级相关的[12],病理级别越高,FAP-α表达越强并与胶质瘤的侵袭性有关[13]。目前关于FAP-α与神经胶质瘤增殖的研究报道尚少。本实验研究沉默FAP-α的表达对胶质瘤细胞株U87增殖的影响,我们用脂质体转染siRNA,沉默FAP-α的表达,运用Real-time PCR和Western Blot法检测转染后靶基因的表达变化,证实与对照组比较,实验组FAP-α基因的mRNA和蛋白水平均有明显的下降。
研究发现,PCNA与细胞DNA合成关系密切,在细胞增殖的启动上起重要作用,是反映肿瘤细胞增殖状态的良好指标[14],参与肿瘤的发生与发展[15]。我们通过Real-time PCR 检测发现转染后siRNA组较NC组PCNA表达明显下降,随着靶基因的表达下调而下降。提示实验组细胞增殖能力的下降。同样的,CCK-8实验结果显示,实验组细胞的细胞增殖能力均分别低于相应对照组,并且随时间的延长而差距变大。由此说明有效的沉默FAP-α的表达,可以促进胶质细胞瘤的生长增殖能力下降,并增加和促进其凋亡。
凋亡是细胞程序性自杀的过程,诱导肿瘤细胞的凋亡能抑制细胞增殖,是目前抗肿瘤的一种潜在的方法[16]。Bcl-2是抑制细胞凋亡的原癌基因,可以稳定线粒体电位,抑制CytC释放来抑制凋亡的线粒体依赖途径,其异常的表达与肿瘤的发生、发展有着密切的关系[17]。caspase-3是目前发现的caspase成员中引起细胞凋亡的关键性激酶,也是细胞凋亡的主要参与成分。caspase级联反应在凋亡通路中处于重要地位,尤其caspase-3是其中的中心环节[18]。本研究中细胞转染48 h后发现,下调FAP-α的表达可以显著抑制Bcl-2蛋白水平并上调caspase-3表达,说明下调FAP-α的表达能诱导U87细胞凋亡。综上所述,通过本实验我们发现FAP-α的表达下调能够使胶质瘤细胞的增殖能力下降,促进凋亡发生。因此FAP-α有可能成为临床治疗胶质瘤的靶点。但本研究仅以神经胶质瘤细胞U87为研究对象,探讨下调表达FAP-α对U87细胞的影响,关于在其他胶质瘤细胞株和体内实验的情况,以及在胶质瘤的发生、发展和诊疗中的作用机制研究仍不清楚,还需进一步的研究。
[1]Hirst TC, Vesterinen HM, Sena ES, et al. Systematic review and meta-analysis of temozolomide in animal models of glioma: was clinical efficacy predicted?[J]. Br J Cancer, 2013, 108(1): 64-71.
[2]Shah AH, Snelling B, Bregy A, et al. Discriminating radiation necrosis from tumor progression in gliomas: a systematic review what is the best imaging modality?[J]. J Neurooncol, 2013, 112(2): 141-152.
[3]Liu R, Li H, Liu L, et al. Fibroblast activation protein: A potential therapeutic target in cancer[J]. Cancer Biol Ther, 2012, 13(3): 123-129.
[4]Collins PJ, McMahon G, O'Brien P, et al. Purification, identification and characterisation of seprase from bovine serum[J]. Int J Biochem Cell Biol, 2004, 36(11): 2320-2333. [5]Chen D, Kennedy A, Wang JY, et al. Activation of EDTA-resistant gelatinases in malignant human tumors[J]. Cancer Res, 2006, 66(20): 9977-9985.
[6]武金波, 靳占峰. 成纤维细胞激活蛋白的表达与胃癌恶性生物学行为的关系[J]. 黑龙江医学, 2008, 32(1): 21-23.
[7]Shi M, Yu DH, Chen Y, et al. Expression of fibroblast activation protein in human pancreatic adenocarcinoma and its clinicopathological significance[J]. World J Gastroenterol, 2012, 18(8): 840-846.
[8]Liao Y, Ni Y, He R, et al. Clinical implications of fibroblast activation protein-alpha in non-small cell lung cancer after curative resection: a new predictor for prognosis[J]. J Cancer Res Clin Oncol, 2013, 139(9): 1523-1528.
[9]Huang Y, Wang S, Kelly T. Seprase promotes rapid tumor growth and increased microvessel density in a mouse model of human breast cancer[J]. Cancer Res, 2004, 64(8): 2712-2716.
[10]温秋婷, 孙玉荣, 李春红, 等. 成纤维细胞激活蛋白对卵巢癌细胞增殖、迁徙和侵袭的影响[J]. 中国癌症杂志, 2011, 21(6): 441-445.
[11]朱琳, 张宁, 代海丽, 等. FAP对体外内皮细胞增殖及其小管形成的影响[J]. 哈尔滨医科大学学报, 2012, 46(1): 10-13, 18.
[12]Stremenova J, Krepela E, Mares V, et al. Expression and enzymatic activity of dipeptidyl peptidase-IV in human astrocytic tumours are associated with tumour grade[J]. Int J Oncol, 2007, 31(4): 785-792.
[13]Mentlein R, Hattermann K, Hemion C, et al. Expression and role of the cell surface protease seprase/fibroblast activation protein-alpha (FAP-alpha) in astroglial tumors[J]. Biol Chem, 2011, 392(3): 199-207.
[14]翟广, 刘斌, 刘献志. 复发脑膜瘤血管内皮生长因子及增殖细胞核抗原的表达[J]. 中华实验外科杂志, 2007, 24(11): 1308-1309.
[15]潘丹, 陈国荣, 金茹. PTEN基因和增殖细胞核抗原在喉鳞状细胞癌中的表达及其意义[J]. 温州医学院学报, 2009, 39(3): 260-263.
[16]金洲祥, 王向昱. 三氧化二砷联合5-氟尿嘧啶对小鼠肝癌H22细胞株的抑制作用[J]. 温州医学院学报, 2013, 43(10): 655-659.
[17]Llambi F, Green DR. Apoptosis and oncogenesis: give and take in the BCL-2 family[J]. Curr Opin Genet Dev, 2011, 21(1): 12-20.
[18]Way TD, Kao MC, Lin JK. Degradation of HER2/neu by apigenin induces apoptosis through cytochrome c release and caspase-3 activation in HER2/neu-overexpressing breast cancer cells[J]. FEBS Lett, 2005, 579(1): 145-152.
(本文编辑:吴健敏)
Effect of siRNA on proliferation of glioma cell line U87 by targeting fibroblast activation protein alpha
CHEN Yuan, WANG Wei, TU Ming, WU Zhebao, ZHENG Weiming.Department of Neurosurgery,the First Affiliated Hospital of Wenzhou Medical University, Wenzhou, 325015
Objective:To explore the effect of small interfering RNA (siRNA) -mediated fibroblast activation protein alpha knock-down on proliferation of glioma cell line U87.Methods:The experiment is divided into Blank, NC and siRNA. Negative control or siRNA were transfected into U87cells by Lipofectamine 2000. After transfection, protein level of target gene FAP-α, Bcl-2 and caspase-3 were detected by Western blot, mRNA level of PCNA and FAP-αwere detected by Real-time PCR. The proliferation ability of NC group and siRNA group of cells were analyzed by CCK8 assay.Results:①Forty-eighth after transfection, mRNA and protein expressions of FAP-α in siRNA group were remarkably reduced as compared with those in NC and Blank group (P<0.05); Compared with NC group, the expression of caspase-3 was higher (P<0.05), while that of Bcl-2 was lower (P<0.01). The expression of PCNA mRNA was lower than NC group (P<0.01). ②The OD450 value of siRNA group was significantly lower than that in the NC group 24, 48, 72 and 96 h after transfection (P<0.05). Conclusion: siRNA-mediated fibroblast activation protein alpha knock-down can inhibit the proliferation of U87 glioma cells and promote apoptosis of glioma cells.
glioma; small interfering RNA; fibroblast activation protein alpha; cell proliferation function
R739.41
A
1000-2138(2014)04-0241-04
2013-10-28
浙江省外科学重中之重学科开放基金资助项目(kfjj2011006)。
陈渊(1988-),男,浙江台州人,硕士生。
郑伟明,主任医师,硕士生导师,Email:zhwm61@ 126.com。

