miR-34c对I I型子宫内膜癌HEC-1-B细胞生长和凋亡的影响
李甫钥,薛纪森,黄亦波,陈慧君,郑飞云
(温州医科大学附属第一医院 妇科,浙江 温州 325015)
·论 著·
miR-34c对I I型子宫内膜癌HEC-1-B细胞生长和凋亡的影响
李甫钥,薛纪森,黄亦波,陈慧君,郑飞云
(温州医科大学附属第一医院 妇科,浙江 温州 325015)
目的:研究miR-34c对Ⅱ型子宫内膜癌HEC-1-B细胞的生长及凋亡的影响。方法:用hsa-miR-34c mimics转染HEC-1-B细胞。流式细胞技术测定细胞转染率,实时荧光定量PCR验证转染后miR-34c的表达。CCK-8检测细胞增殖能力的改变。细胞克隆形成实验观察miR-34c对细胞生长的长期抑制。流式细胞技术测细胞凋亡。结果:细胞转染率为81.16%。相对于对照组,转染后实验组miR-34c表达明显增加,细胞增殖、克隆形成能力减弱,凋亡增加(P<0.05)。结论:miR-34c能明显抑制Ⅱ型子宫内膜癌细胞的增殖,促进细胞凋亡,是Ⅱ型子宫内膜癌的潜在抑癌基因。
miR-34c;Ⅱ型子宫内膜肿瘤;细胞;增殖;凋亡
子宫内膜癌是女性生殖系统最常见的恶性肿瘤之一,其发病率和病死率正逐年上升[1-2]。手术是目前子宫内膜癌的主要治疗方法。根据组织学特征、生物学表现及临床预后等,子宫内膜癌分为I型和I I型两种类型[3]。I型子宫内膜癌为雌激素受体阳性的高分化子宫内膜样腺癌,占子宫内膜癌的80%左右,一般预后较好;I I型为雌激素受体阴性的子宫内膜癌,较少见,主要包括浆液性腺癌、透明细胞癌及其他低分化癌[4],分化较差,预后不良。因此,寻找新的治疗方法对于改善I I型子宫内膜癌的预后具有重大意义。微RNA(miRNA)是一种长约18~24个核苷酸的非编码小RNA,通过对mRNA剪切或翻译抑制来调节基因表达[5]。最近研究发现miRNA可作为癌基因或抑癌基因参与多种癌的发生和发展(包括胃癌、肺癌、肝癌、卵巢癌、宫颈癌、淋巴瘤等)[6]。miRNA为肿瘤的治疗提供了新的思路,并可能在分子水平对未来肿瘤治疗产生巨大的影响。我们以前的研究[7]通过基因芯片技术对子宫内膜癌miRNA表达谱进行分析发现相对于正常子宫内膜,miR-34c在I I型子宫内膜癌中呈明显低表达,提示miR-34c可能是I I型子宫内膜癌的抑癌基因之一。本研究通过上调I I型子宫内膜癌细胞的miR-34c表达并对其生物学功能的改变进行检测,从而进一步了解miR-34c在I I型子宫内膜癌发生发展中的作用。
1 材料和方法
1.1 主要试剂与仪器hsa-miR-34c mimics(5’-AGGCAGUGUAGUUAGCUGAUUGC-3’)、miRNA mimics阴性对照(5’-UUCUCCGAACGUGUCACGUTT-3’)及FAM标记的hsa-miR-34c mimics(上海吉玛公司),hsa-miR-34c上游引物(5’-AGGCAGTGTAGTTAGCTGATTGC-3’)及U6上游引物(5’-CGCAAGGATGACACGCAAATTC-3’)(Invitrogen公司),胎牛血清、低糖DMEM培养液(Gibco公司),lipofectamine 2000转染试剂、CCK-8试剂(碧云天生物技术研究所),Trizol试剂、miRNA反转录及实时荧光定量PCR试剂盒(Invitrogen公司),SYBR GREEN(TOYOBO公司);ELX800酶标仪(美国BIO-TEK公司),Applied Biosysystems 7500型实时定量PCR仪(美国ABI公司),FACSCalibur流式细胞仪(美国B-D公司)。
1.2 方法
1.2.1 细胞系的选择及培养:HEC-1-B细胞系为雌激素受体ERα及ERβ均阴性的细胞系[8],根据I I型子宫内膜癌雌激素受体阴性的分类标准,我们选择HEC-1-B细胞(购自中科院上海细胞库)作为I I型子宫内膜癌细胞系。
HEC-1-B细胞用含10%胎牛血清的DMEM培养液,置于37 ℃含5% CO2的培养箱内培养。细胞呈贴壁生长,待细胞生长至培养瓶面积的90%以上时用胰酶消化,收集细胞,离心、重悬后,按1:3传代。
1.2.2 细胞的转染及转染率检测:转染前24 h按约2×105个/孔的量将细胞接种于6孔板(96孔板接种2 500个/孔),24 h后细胞覆盖约30%~50%的孔底面积时,按照lipofectamine 2000试剂说明书操作分别转染hsa-miR-34c mimics和NC。实验分三组:实验组(转染hsa-miR-34c mimics)、NC组(转染miRNA mimics阴性对照)、空白组(不转染)。转染后置于培养箱中继续培养。
转染FAM标记的hsa-miR-34c mimics(记为FAM组),24 h后用荧光显微镜观察细胞内的荧光,拍照。将获取的细胞用PBS洗涤、离心、重悬后,避光。用流式细胞仪检测带荧光的细胞量,通过与空白组的比较得出细胞的转染率。
1.2.3 RNA提取及实时荧光定量PCR测定miR-34c的表达:用6孔板铺板、转染后48 h,用Trizol试剂提取总RNA(其中包含miRNA),用核酸蛋白分析仪测定RNA纯度,保证A260/A280在1.8~2.0范围内。根据miRNA反转录及实时荧光定量PCR试剂盒说明,对提取的RNA中的miRNA加多聚A尾,然后进一步反转录为cDNA。完成反转录后,以U6作为内参进行下一步的实时定量荧光PCR,反应为10 μ L体系:5μ L的SYBR-Green试剂、1μ L浓度为1μmol/ L的特异性miR-34c或U6上游引物、1 μL浓度为1 μmol/L的下游通用引物(试剂盒内提供)、1μL之前合成的cDNA模板(1:10稀释后),2μ L的DEPC水。将反应体系置于实时定量PCR仪内进行反应。反应条件:95 ℃变性3 min后,扩增40个循环(每个循环95 ℃ 15 s,60 ℃ 1 min)。反应完成后,根据各组的miR-34c及内参U6的CT值用2-△△Ct法计算每组miR-34c的相对表达量。
1.2.4 CCK-8测细胞增殖:转染前24 h,以2 500个细胞/孔的浓度铺96孔板,每组设3个复孔。24 h后转染(方法同前述),转染后置于培养箱继续培养。培养96 h后用不含血清的DMEM培养液换液,每个孔各加10 μ L的CCK-8试剂,置于培养箱1 h后用酶标仪测定每个孔450 nm波长的吸光度,通过比较实验组与NC组及空白组的吸光度来反映有活性的细胞数量的差别。
1.2.5 细胞克隆形成实验:为进一步观察miR-34c对细胞生长的长期抑制作用,我们对转染后细胞的克隆形成能力进行研究。铺板、转染后72 h,胰酶消化、收集、离心各组细胞,弃上清,用含10%胎牛血清的DMEM培养液重悬。细胞计数后,以800个细胞/孔的浓度铺6孔板,混匀,使细胞均匀地分布于孔的底部。置于培养箱培养,每3~4 d换培养液,约14 d后,细胞在孔底形成肉眼可见的细胞团块。用结晶紫染液对细胞团染色30 min,PBS洗涤2~3次后,拍照、计数。
1.2.6 流式细胞技术测细胞凋亡:铺6孔板、转染后72 h,胰酶消化、收集、离心各组细胞,弃上清,PBS洗涤、离心2次,根据Annexin V/PI细胞凋亡试剂盒的说明,使用100μ L缓冲液重悬细胞,用5 μ L的Annexin V和1 μ L的PI对细胞进行染色15 min,再用400μ L缓冲液稀释。用流式细胞仪测定细胞的凋亡。
1.3 统计学处理方法采用SPSS 19.0统计学软件。各组数据比较采用单因素方差分析,并用LSD-t检验进行两两比较。每个实验至少重复3次,结果以±s表示。P<0.05为差异有统计学意义。
2 结果
2.1 转染效率细胞转染FAM标记的hsa-miR-34c mimics 24 h后,在荧光显微镜下可见明显的细胞内荧光(见图1A)。通过流式细胞技术比较实验组与空白组带荧光细胞量(见图1B),实验组的转染效率为81.16%。

图1 转染后24 h细胞荧光及转染效率
2.2 转染后细胞miR-34c的表达上调转染48 h后,通过实时荧光定量PCR测定miR-34c的相对表达量,根据图2A和图2B的融解曲线判断,miR-34c及U6的引物特异性较好,可认为PCR结果可靠。用2-△△Ct法计算miR-34c相对表达量显示:实验组为373.43±74.95,NC组为1.01±0.19,空白组为1.14±0.16。实验组的miR-34c表达量明显高于NC组及空白组,差异有统计学意义(P<0.05)(见图2C)。
2.3 转染miR-34c能抑制细胞的增殖转染96 h后,加入CCK-8后,用酶标仪测得每组的450 nm波长的吸光度,结果显示:实验组为0.56±0.02,NC组为1.00±0.04,空白组为1.03±0.02。实验组细胞增殖明显受抑制,抑制率约为44%,与NC组及空白组相比差异有统计学意义(P<0.05)(见图3)。
2.4 miR-34c抑制细胞克隆的形成细胞生长14 d后,实验结果如图4A,实验组的细胞克隆形成能力明显下降。统计细胞克隆数(见图4B),实验组细胞克隆数明显少于NC组和空白组(实验组为48.7 ±2.5,NC组为149.6±4.0,空白组为143.0± 2.6),差异有统计学意义(P<0.05)。
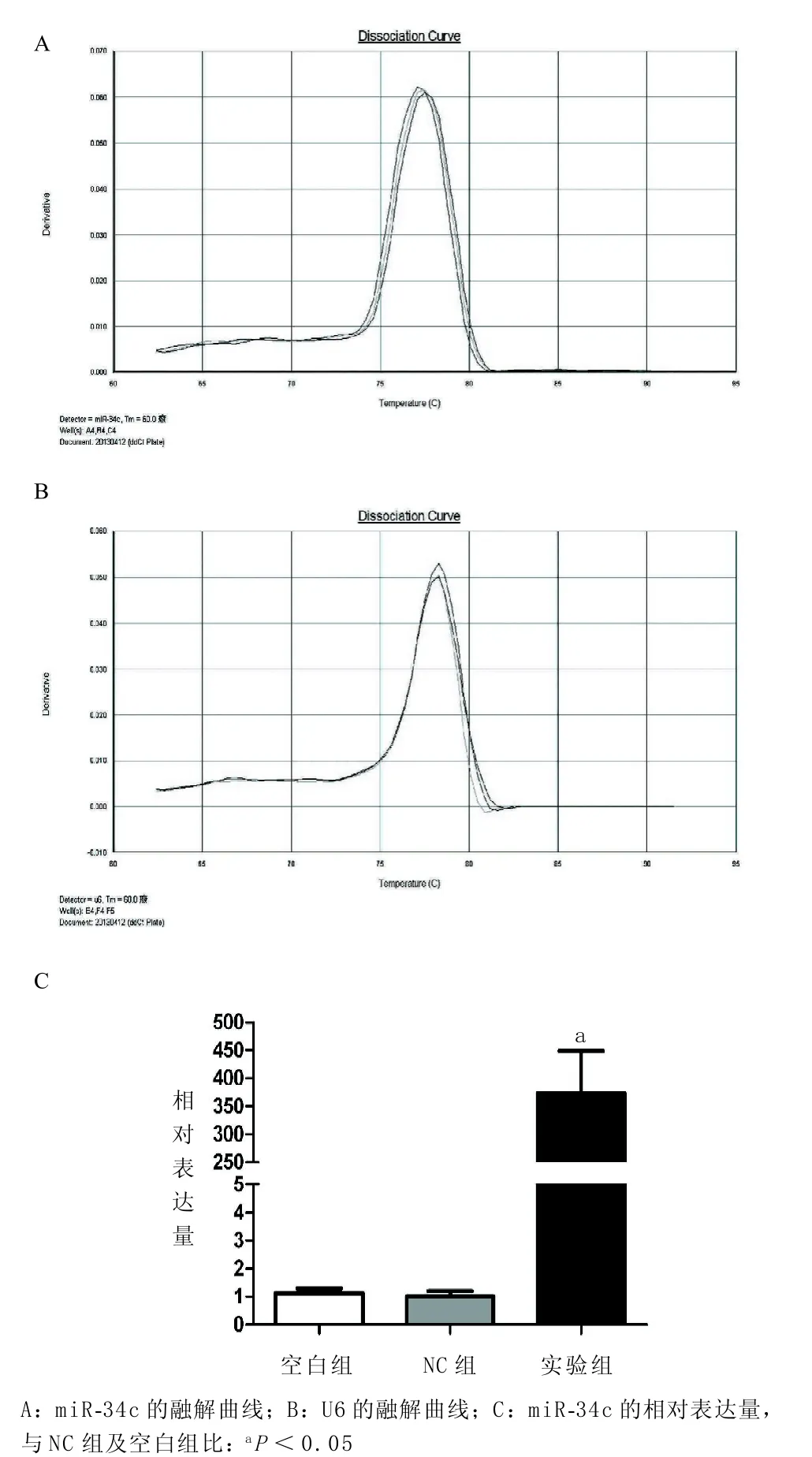
图2 实时荧光定量PCR检测miR-34c的表达情况(2-△△Ct法)

图3 转染后96 h细胞增殖情况(450 nm波长)
2.5 miR-34c促进细胞凋亡转染72 h后,流式细胞技术测细胞的凋亡(见图5),右下象限为早期凋亡细胞,右上象限为晚期凋亡细胞,两者之和为细胞总的凋亡。实验组细胞凋亡率高于NC组和空白组(实验组为11.96±0.90,NC组为5.05±0.43,空白组为5.25±0.83),差异有统计学意义(P<0.05)。
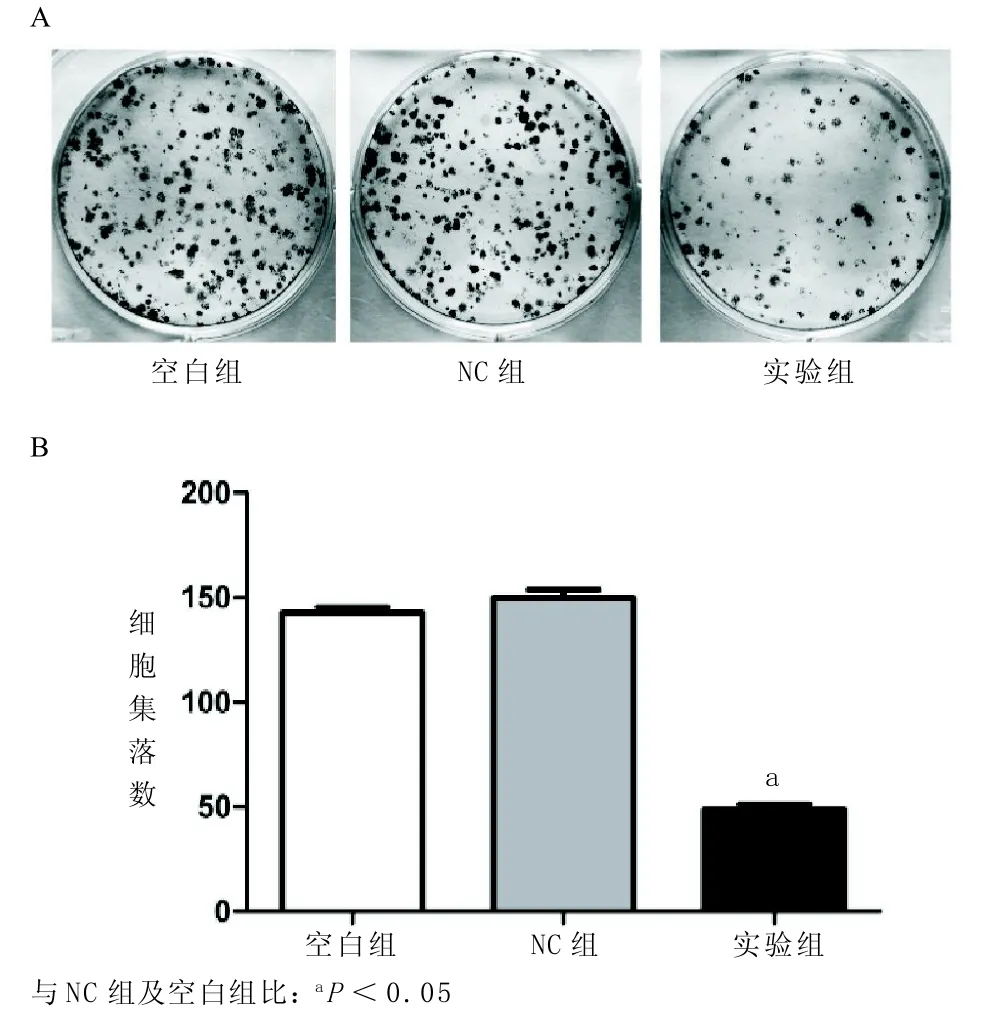
图4 细胞克隆形成实验
3 讨论
miRNA为近年来肿瘤治疗的研究热点。越来越多的研究显示其通过转录后水平调节肿瘤相关蛋白表达,显著改变多种肿瘤细胞的增殖、凋亡、细胞周期及侵袭能力等[6,9],在肿瘤诊断及治疗方面有着极大的潜力。
近年来研究发现miR-34家族成员(包括miR-34a、miR-34b和miR-34c)是p53抑癌基因的靶点,通过与p53的相互作用而起到抑癌作用[10]。研究证实miR-34家族参与多种肿瘤的形成与发展,包括肝癌、结肠癌、卵巢癌、神经母细胞瘤及白血病等[11-12]。目前,关于miR-34c对子宫内膜癌的生物学作用的研究甚少,尤其是对I I型子宫内膜癌的作用国内鲜见相关报道。
在分子学水平理解肿瘤的发病机制是成功找到新的治疗方法的重要途径[13]。子宫内膜癌I I型较I型少见,但是预后明显比I型差,病死率高,有学者认为这与I I型子宫内膜癌的高侵袭性和高复发率相关[14]。但从分子水平考虑其预后差是否与miRNA相关还不清楚,鉴于我们之前研究发现的miR-34c在I型子宫内膜癌中的表达与正常子宫内膜无明显差别,而在I I型子宫内膜癌中呈明显低表达[7],我们认为I型和I I型子宫内膜癌预后的差别可能与miR-34c相关。为进一步研究miR-34c的抑癌作用,本研究通过转染hsa-miR-34c mimics上调I I型子宫内膜癌HEC-1-B细胞miR-34c的表达。流式细胞技术测定转染率达80%以上。实时荧光定量PCR再次验证,结果显示实验组miR-34c表达明显上调,与流式细胞技术结果一致,证实转染成功。用CCK-8试剂测细胞增殖能力的改变,发现细胞增殖明显被抑制。细胞克隆形成实验证实miR-34c对I I型子宫内膜癌有长期抑制作用。更重要的是,流式细胞技术测凋亡发现miR-34c也能促进细胞凋亡。通过实验的观察,我们发现细胞的凋亡能进一步抑制细胞增殖及细胞克隆形成能力。根据以上结果,我们认为miR-34c是I I型子宫内膜癌的潜在抑癌基因。
Tanaka等[15]对间皮细胞中miR-34的作用进行研究,证明miR-34通过调节MET蛋白表达抑制细胞增殖,并调节Bcl-2蛋白的表达促进细胞凋亡。这与我们在II型子宫内膜癌中观察到的结果一致,但miR-34c在I I型子宫内膜癌中的作用机制及其是否也与MET和Bcl-2有关仍需进一步研究证明。
综上所述,miR-34c能明显抑制I I型子宫内膜癌细胞的增殖,促进细胞凋亡,并可能与I I型子宫内膜癌的预后差相关。miR-34c作为I I型子宫内膜癌的潜在抑癌基因,可能为将来I I型子宫内膜癌在分子水平的早期诊断及治疗提供新的方法,成为手术之外更有效的治疗方法之一。但目前大部分miRNA的作用机制尚未研究清楚,miR-34c的作用机制还有待进一步研究。

图5 流式细胞技术测凋亡
[1]Siegel R, Naishadham D, Jemal A. Cancer statistics, 2012[J]. CA Cancer J Clin, 2012, 62(1): 10-29.
[2]Ueda SM, Kapp DS, Cheung MK, et al. Trends in demographic and clinical characteristics in women diagnosed with corpus cancer and their potential impact on the increasing number of deaths[J]. Am J Obstet Gynecol, 2008, 198(2): 218.e1-218.e6.
[3]Bokhman JV. Two pathogenetic types of endometrial carcinoma[J]. Gynecol Oncol, 1983, 15(1): 10-17.
[4]Tergas AI, Buell-Gutbrod R, Gwin K, et al. Clinico-pathologic comparison of type II endometrial cancers based on tamoxifen exposure[J]. Gynecol Oncol, 2012, 127(2): 316-320.
[5]Bartel DP. MicroRNAs: genomics, biogenesis, mechanism, and function[J]. Cell, 2004, 116(2): 281-297.
[6]Esquela-Kerscher A, Slack FJ. Oncomirs - microRNAs with a role in cancer[J]. Nat Rev Cancer, 2006, 6(4): 259-269.
[7]薛纪森, 张乾, 李晓琳, 等. 子宫内膜癌I型和II型miRNA表达谱差异的分析[J]. 实用医学杂志, 2011, 27(22): 4051-4054.
[8]孙蓬明, 魏丽惠, 高敏, 等. 雌激素受体相关受体α过度表达对雌激素受体阴性的子宫内膜癌细胞增殖的影响[J]. 中华妇产科杂志, 2007, 42(6): 408-411.
[9]Le XF, Merchant O, Bast RC, et al. The roles of microRNAs in the cancer invasion-metastasis cascade[J]. Cancer microenviron, 2010, 3(1): 137-147.
[10]Bommer GT, Gerin I, Feng Y, et al. p53-mediated activation of miRNA34 candidate tumor-suppressor genes[J]. Curr Biol, 2007, 17(15): 1298-1307.
[11]Son MS, Jang MJ, Jeon YJ, et al. Promoter polymorphisms of pri-miR-34b/c are associated with hepatocellular carcinoma[J]. Gene, 2013, 524(2): 156-160.
[12]Wong MY, Yu Y, Walsh WR, et al. microRNA-34 family and treatment of cancers with mutant or wild-type p53 (Review)[J]. Int J Oncol, 2011, 38(5): 1189-1195.
[13]Yeramian A, Moreno-Bueno G, Dolcet X, et al. Endometrial carcinoma: molecular alterations involved in tumor development and progression[J]. Oncogene, 2013, 32(4): 403-413.
[14]Mendivil A, Schule K, Gehrig P, et al. Non-endometrioid adenocarcinoma of the uterine corpus: a review of selected histological subtypes[J]. Cancer Control, 2009, 16(1): 46-52.
[15]Tanaka N, Toyooka S, Soh J, et al. Downregulation of microRNA-34 induces cell proliferation and invasion of human mesothelial cells[J]. Oncol Rep, 2013, 29(6): 2169-2174.
(本文编辑:吴健敏)
The influence of miR-34c on growth and apoptosis of type II endometrial carcinoma cell line HEC-1-B
LI Fuyao, XUE Jisen, HUANG Yibo, CHEN Huijun, ZHENG Feiyun.Department of Gynecology, the First Affiliated Hospital of Wenzhou Medical University, Wenzhou, 325015
Objective: To investigate the effect miR-34c on the growth and apoptosis of type II endometrial carcinoma cells (HEC-1-B cell line).Methods:Up-regulated the expression of miR-34c by transfecting cells with hsa-miR-34c mimics, the transfection efficiency was detected by flow cytometry and further verified by quantitative real-time PCR (qRT-PCR). Cell proliferation assay by CCK-8 and colony formation assay applied to demonstrate that miR-34c could inhibit the growth of HEC-1-B cells. Cells apoptosis assay was analyzed by flow cytometry.Results:The transfection efficiency was 81.16%. The overexpression of miR-34c (detected by qRT-PCR) could inhibit cell proliferation, colony formation and promote cells apoptosis (P <0.05).Conclusion:MiR-34c can inhibit the growth and promote apoptosis of HEC-1-B cells significantly, and function is a potential tumor suppressor in type II endometrial carcinoma.
miR-34c; type II endometrial carcinoma; cell; proliferation; apoptosis
R711
A
1000-2138(2014)02-0086-05
2013-09-25
浙江省自然科学基金资助项目(Y2 090 69 9)。
李甫钥(1989-),男,浙江苍南人,硕士生。
郑飞云,主任医师,硕士生导师,Email:zfy5710 @163.com。

