紫七软肝方含药血清对巨噬细胞条件培养液诱导肝星状细胞活化后增殖的影响*
徐吉敏 肖 莉 黄建华 严 明 黄 艳 赵凤鸣 王明艳 叶 放△
1.南京中医药大学第一临床医学院(江苏 南京,210029) 2.江苏省省级机关医院 3.南京鼓楼医院
肝纤维化(hepatic fibrosis,HF)是各类慢性肝脏疾病向肝硬化发展的共同病理过程,是一种主动的基质病理增生过程,其中,肝星状细胞(HSC)的激活是HF 发生过程中的核心事件,HF 治疗的核心即是针对HSC 的治疗[1,2]。本研究通过观察紫七软肝方含药血清对活化后HSC-T6 增殖的影响,并与扶正法黄芪一贯煎含药血清作对照,观察其对HF 的有效性。
1 材料与方法
1.1 实验动物与细胞 健康清洁级SD 雄性大鼠64 只,体重(200 ±20)g。购自南京医科大学动物实验基地(质量合格证许可证号:SCXK (苏)2008 -0004)。实验动物在南京中医药大学清洁级动物房饲养,食用标准颗粒饲料,自由饮食。
小鼠单核巨噬细胞白血病细胞RAW 264.7,购自中国科学院细胞生物研究所(ATCC 号:TIB-71);大鼠肝星状细胞HSC-T6 由南京中医药大学药学院郑仕中教授惠赠,为活化型永生的大鼠肝星状细胞系。
1.2 实验药物与试剂 紫七软肝方(由紫草、三七、虎杖、赤芍、茵陈、炙鳖甲、马鞭草等组成,共计106g)和黄芪一贯煎(由黄芪、生地、北沙参、枸杞子、当归、麦冬、川楝子组成,共计105g)中药材均购自江苏省中医院,依据参考公式[3]:给药剂量=临床用量×动物等效面积系数×体外实验系统内血清稀释度,由本校药学院中药鉴定及药化实验室鉴定并分别制成质量浓度为11g·ml-1的药液。阳性对照组药物秋水仙碱(COLC),美国Sigma 公司,成人(60kg)的日用量为1mg,大鼠的剂量为成人用量的30 倍(即0.25mg·kg-1),灌胃时用0.9%生理盐水调制药液浓度成0.025g·L-1。主要试剂有:DMEM 培养基(美国Gibco)、胎牛血清(德国Biochrom)、胰蛋白酶 (美国 Amresco)、噻唑蓝(MTT)(北京Solarbio)、二甲基亚砜(DMSO)(美国Amresco)、脂多糖(LPS) (美国Sigma)、卡西霉素(Calcimycin,美国Sigma)、青霉素和链霉素(山东鲁抗)。
1.3 主要仪器和器材 洁净工作台(苏州净化),RE2000 型旋转蒸发仪(上海亚荣),AY220 电子分析天平(日本Shimadzu),CKX31 倒置显微镜(日本Olympus),MDF-382ECM超低温冰箱(日本Sanyo),HH-6 恒温水浴锅(常州国华),高速冷冻离心机(德国Eppendorf),酶联免疫检测仪(美国Bio-Rad),移液器(德国Gilson)。
1.4 含药血清的制备 64 只大鼠随机分为8 组,每组8 只,分别为紫七软肝方高、中、低浓度组,黄芪一贯煎高、中、低浓度组,秋水仙碱组和生理盐水组。紫七软肝方组和黄芪一贯煎组大鼠分别以高、中、低浓度为11g、5.5g、2.75g·ml-1的水煎液,秋水仙碱组大鼠灌胃浓度为0.025g·L-1,生理盐水组大鼠灌以0.9%生理盐水,均按1ml/100g 标准进行灌胃。早晚8 点各灌胃1 次,连续7d,紫七软肝方组于末次给药2h (经过预实验证实此时效果好)、黄芪一贯煎组于末次给药1h 后(经过预实验证实此时效果好)、秋水仙碱组和生理盐水组均于末次给药1h 后,颈主动脉取血,4℃静置4h,3000rpm 离心15min,分离血清,同组血清混匀,56℃水浴灭活30min,无菌过滤分装后-70℃冻存备用。
1.5 巨噬细胞条件培养液的制备 巨噬细胞条件培养液(MCM)参照文献[4]制备,取对数生长的RAW264.7 细胞,待细胞数约为2 ×106/L 时,先用1μmol/L 卡西霉素孵育8h,磷酸盐缓冲液洗涤细胞3 次后,再用100g·L-1LPS 孵育6h,磷酸盐缓冲液洗涤细胞3 次后,最后用DMEM 培养液孵育24h,收集细胞上清液于-20℃贮存备用。
1.6 细胞培养 RAW264.7 细胞置于含10% 胎牛血清的DMEM 高糖培养液中培养,每天换液,每3d 传代1 次;HSC-T6 细胞置于含10%胎牛血清的DMEM 高糖培养液中培养,隔天换液1 次,每3d 传代1 次。均置于37℃、5%CO2、饱和湿度条件下细胞培养箱中培养,取对数生长期细胞进行实验。
1.7 MTT 法检测不同采血时间点的含药血清对活化后HSC-T6 增殖的影响 无菌条件下,取对数生长期HSC-T6,显微镜下观察待细胞数占细胞瓶底约50%时加入MCM 共同培养24h,0.25%胰酶消化,显微镜下计数后调整细胞密度为1 ×105/ml,每孔200μl 接种于96 孔板中,置37℃、5%CO2的饱和湿度培养箱中培养。待细胞贴壁后(过夜),弃去培养液,每孔加入含20%不同浓度含药血清的培养液,生理盐水组加入等体积含药血清培养液,每组均设6 个复孔,分别培养24、48h 后,每孔加入新鲜配制的5g·L-1的MTT 溶液 (将100mgMTT 粉末溶解于20ml PBS 中,现配现用,无菌过滤分装,-20℃冻存)20μl,轻微震荡2min,继续培养4h,轻轻吸弃上清,每孔加入DMSO 溶液150μL (避光操作),水平摇床混匀,应用酶标仪于490nm 波长处测定吸光度(A),重复3 次。在一定细胞数范围内,MTT 结晶形成的量与细胞数成正比,根据测得的A 值判断细胞数量,A 值越大,细胞活性越强。按下式计算不同质量浓度含药血清对HSC-T6 增殖的抑制率(IR),IR=(1 -A给药组/A生理盐水组) ×100%。
1.8 MTT 法检测紫七软肝方含药血清对活化后HSC-T6 增殖的影响 无菌条件下,将对数生长期HSC-T6 和MCM 共同培养24h 后胰酶消化,调整细胞密度为1 ×105个/mL 后接种于96 孔板中,置细胞培养箱中培养。待细胞贴壁后(过夜),弃去培养液,每孔加入含20%含药血清的培养液,使紫七软肝方和黄芪一贯煎组终质量浓度分别为2.2g、1.1g、0.55g·ml-1,秋水仙碱组和生理盐水组加入等体积含药血清培养液,每组均设6 个复孔,分别培养24h、48h、72h 后,依次加入MTT 溶液和DMSO 溶液,水平摇床混匀,应用酶标仪于490nm 波长处测定A,重复3 次。(具体同1.7)。
2 结果
2.1 不同采血时间点的含药血清对活化后HSC-T6 的增殖抑制作用 中浓度紫七软肝方(临床等效剂量)灌胃后各时间点制备的含药血清与生理盐水组相比,灌胃后2h 对活化后HSC-T6 抑制作用最明显,且48h (P <0.05)优于24h (P >0.05);中浓度黄芪一贯煎含药血清于灌胃后1h 对活化后HSC-T6 抑制作用最明显,且48h (P <0.05)优于24h (P >0.05)结果见表1、表2 和图1。
2.2 紫七软肝方含药血清对活化后HSC-T6 的抑制作用 紫七软肝方含药血清在2.2g、1.1g、0.55g·ml-1质量浓度时作用24h、48h 和72h 后,吸光度与生理盐水组相比均有差异(P <0.01),紫七软肝方高浓度组抑制率高于秋水仙碱组,但中、低浓度组低于秋水仙碱组,紫七软肝方含药血清48h 抑制率最明显;黄芪一贯煎含药血清在2.2、1.1、0.55 g·ml-1质量浓度时作用24h、48h 和72h 后,吸光度与生理盐水组相比部分有显著差异(P <0.05),24h 低浓度组与生理盐水组相比,P >0.05,无统计学差异,高、中、低浓度组均与秋水仙碱组无统计学差异,黄芪一贯煎含药血清48h 抑制率最明显。从表3 可以看出,细胞培养从24h 到48h,细胞数量增加较快,而从48h 到72h,细胞数量有所下降,可能是因为药物的影响,也有可能是细胞自身的凋亡,故72h 结果仅供参考,统计学意义较小。如图2 所示。
表1 中浓度紫七软肝方含药血清于不同采血时间点对活化后HSC-T6 的增殖抑制作用(±s)

表1 中浓度紫七软肝方含药血清于不同采血时间点对活化后HSC-T6 的增殖抑制作用(±s)
与生理盐水组相比,* P <0.05,△P <0.01
表2 中浓度黄芪一贯煎含药血清于不同采血时间点对活化后HSC-T6 的增殖抑制作用(±s)

表2 中浓度黄芪一贯煎含药血清于不同采血时间点对活化后HSC-T6 的增殖抑制作用(±s)
与生理盐水组比较,△P <0.01

图1 不同采血时间点的中浓度紫七软肝方组含药血清对活化后HSC-T6 的抑制率(上图)和不同采血时间点的中浓度黄芪一贯煎组含药血清对活化后HSC-T6 的抑制率(下图)
表3 紫七软肝方含药血清对活化后HSC-T6 的抑制作用(±s)

表3 紫七软肝方含药血清对活化后HSC-T6 的抑制作用(±s)
与生理盐水组比较,* P <0.05,△P <0.01
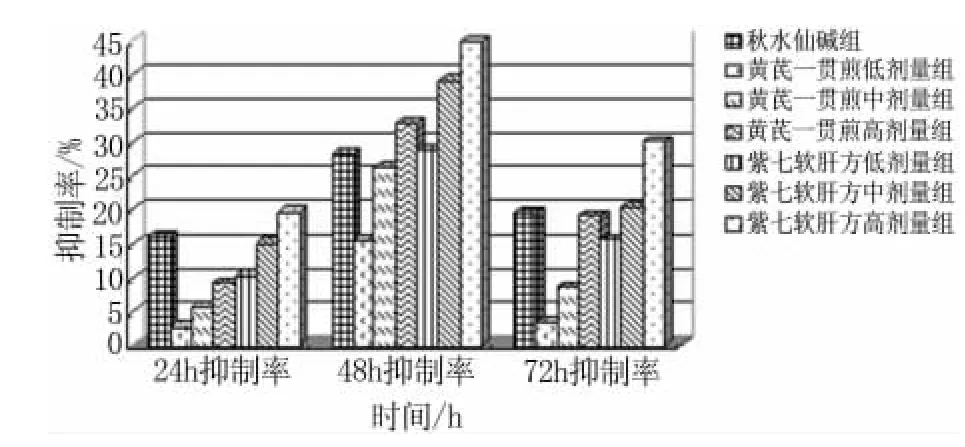
图2 各含药血清对活化后HSC-T6 的抑制率
3 讨论
已知在HF 的形成过程中涉及的细胞主要包括HSC 和枯否细胞(Kupffer Cells,KCs),KCs 活化后产生的致炎因子诱导HSC 活化发生HF。大量的研究者应用HF 发生发展过程中KCs 活化前后涉及的细胞因子如TGF-β1、PDGF、瘦素等单一细胞因子诱导HSC 活化后进行研究[5~7]。目前整体致炎微环境中细胞网络如何诱导HSC 活化的整体机制尚不明确,故本实验体外培养体系中首先诱导KCs 活化使其产生大量细胞因子,营造致HSC 活化的微环境以模拟体内HF 的发生过程。
研究表明,LPS 和Cal 可诱导KCs 活化[4,8]。本实验通过LPS 和Cal 制备的MCM,诱导同属于巨噬细胞来源于成年BALB/c 雄性小鼠的巨噬细胞株-RAW264.7 细胞代替KCs 活化,RAW264.7 细胞在HF 过程中产生大量细胞因子,激活HSC-T6,从而启动HF 的进程。体外制备MCM 的目的在于模拟体内HSC-T6 活化前的环境和致活化因素,RAW264.7 细胞活化后释放多种细胞因子,并不是某一种或是几种细胞因子就可以启动HSC-T6 的活化,而是多种细胞因子相互作用,产生炎性环境,通过旁分泌机制作用于HSC-T6 加速其活化、增殖及细胞外基质的合成。HSC-T6 一旦活化,即便去除致活化因素,HSC-T6 继以自分泌的形式活化,促使HF 的发生。
国医大师周仲瑛教授以清化湿热瘀毒法为组方原则,研制成功“紫七软肝方”是其临床辨治肝纤维化和肝硬化常用“祛邪”为主的基本方。黄芪一贯煎是由一贯煎加黄芪而成,具有益气养阴作用,是针对肝纤维化中晚期气阴两虚病机而常用扶正为主的基本方。这两种不同治法的方药在临床上普遍应用,但至今未见有对其防治HF 作用机制比较研究的研究报告。
中药成分复杂,将单味药或复方的粗提液直接作用于细胞培养体系,对其细胞分子水平进行药理研究,结果会受到其中所含的杂质或是本被人体吸收代谢后不存在的物质影响,亦会缺乏经人体代谢出的或与机体反应后得到的产物对实验的作用。为解决实验中的这些问题,日本学者田代真一于20世纪80年代提出含药血清实验方法的设想,并进行了一系列研究后,于1988年提出了血清药理学 的概念和实验方法[9]。这一方法具有两大优点:①体现复方体内生化转化效应;②克服药物本身理化性质对实验的直接干扰[10]。但其也存在一定的缺点:给药方案难以确定;无法判断体外培养体系内药物浓度与血药浓度的关系;药效最佳的采血时间难以确定;不同批次制备得到的或是低温冻存后的含药血清进行实验,结果重复性差;血清中固有的活性成分常影响实验结果等[11~13]。本实验在探索制备含药血清时考虑到以下5 个方面[14]:第一,考虑到本次试验涉及的HSC -T6 的种属是大鼠,为了血清和细胞的同种属性,故选择制备的动物是SD 大鼠;第二,给药方法中采取每日给药2 次,给药周期为1 周,重复多次给药使血药浓度达到稳态,取得的含药血清药理作用强度较高;第三,采血时间是通过必要的时效关系研究,将药效达峰时间作为采血时间,能够较为细致地进行含药血清研究,避免了假阴性实验结果的出现;第四,根据能充分反映药效、有利于实验操作简便、快捷的原则,本次试验中大鼠的采血部位确定为颈动脉,并通过心外按压大鼠期望得到尽可能多的血液;第五,为了避免单样本对整组结果的影响,对同组血清采取混匀灭活,并无菌分装保存,同时也避免了反复冻存对含药血清的影响。
本实验在探索制备含药血清时发现,紫七软肝方和黄芪一贯煎分别于灌胃后2h、1h 采血制备得到的含药血清对活化后HSC-T6 抑制作用最明显,且48h 均优于本组的24h,但黄芪一贯煎灌胃后3h 得到的含药血清作用于活化后HSC-T6 细胞48h 后出现的高抑制率与药物在大鼠体内代谢规律不一致,其原因尚有待于进一步研究。同时,紫七软肝方含药血清在2.2g·ml-1、1.1g·ml-1、0.55g·ml-1质量浓度时对活化后HSC-T6 抑制率在48h 时最明显,且随浓度的增大而增加,呈现浓度依赖性。
本实验研究表明,用MCM 培养HSC-T6 细胞48h 后即予药物治疗,尚处于HF 早中期阶段,故而出现代表祛邪法的各剂量组紫七软肝方含药血清对活化后HSC-T6 的抑制作用均优于代表扶正法的黄芪一贯煎含药血清这一结果,符合HF 的早期以祛邪为主、中期祛邪与扶正并存、晚期治以扶正这一治则共识;高浓度紫七软肝方含药血清的抑制作用高于阳性对照组,中、低浓度的抑制作用低于后者。临床上秋水仙碱治疗肝纤维化作用明确,但其存在一定的毒副作用,在本次实验制备含药血清中亦有所体现:大鼠灌胃后出现精神萎靡、食欲不振、皮下出血、眼睛出血、尿血、便血等,而同时灌胃的中药组和生理盐水组均未出现上述表现。
本研究揭示紫七软肝方对HSC-T6 活化的抑制作用确切,优于黄芪一贯煎,但其机制需要进一步探讨。
[1]Hiroshilubota,Hsin-Leiyao,Lloam.Rerd.Identification and Characterization of Vitamin A-Storing Cells in Fetal Liver:Implications for Functional Importance of Hepatic Stellate Cells in LiverDevelopment andHematopoiesis [J].Stem Cells,2007,25 (9):2339 -2349.
[2]Novo Erica,Cannito Stefania,Zamara Elena,et al.Proangiogenic cytokines as hypoxia-dependent Factors stimulating migration of human hepatic stellate cells [J].The American journal of pathology,2007,170 (6):1942 -1953.
[3]王力倩,李仪奎,符胜光,等.血清药理学方法研究探索[J].中药药理与临床,1997,13 (3):29.
[4]田鸣,张俊平,钱定华,等.蛋白激酶C 抑制剂和钙调素抑制剂对小鼠腹腔巨噬细胞释放肿瘤坏死因子的抑制作用[J].中国药理学报,1993,14 (5):447 -449.
[5]李剑锋,王胜春,田卫斌,等.五灵胶囊对转化生长因子-β1 诱导肝星状细胞TGF-β/Smad 信号通路的影响[J].中成药,2010,32 (1):35 -38.
[6]李烨.灵芪蠲肝胶囊含药血清对PDGF 诱导的大鼠肝星状细胞增殖及JAK/STAT 信号通路的影响[D].泸州:泸州医学院,2011.
[7]侯丽颖,季幸姝,吕志平,等.瘦素诱导HSC 增殖的信号转导通路及保肝宁调控作用的实验研究[J].中医药通报,2008,7(2):40,61 -63.
[8]冯俊明,史景泉,刘友生.脂多糖对枯否细胞中CD14、TOLL 样受体4 表达的影响及其意义[J].中华实验外科杂志,2002,19 (4):350 -351.
[9]田代真一.“血清药理学”と“血清药化学”--汉方の药理学がい始まつた药物血中浓度测定の新しい世界[J].TDM 研究,1988,7 (5):54.
[10]阴赪宏,谭余庆,霍海如,等.中药血淸药理学研究方法及应用[J].中国实验方剂学杂志,1997,3 (6):41.
[11]余文珍,施红.复方中药含药血清研究现状[J].中医药通报,2003,2 (2):113 -116.
[12]黄臣虎,陆茵,高骁君,等.中药血清药理学研究进展[J].中国实验方剂学杂志,2011,17 (10):266 -271.
[13]孙莉娜,孟静岩,孙晓霞.中药血清药理学方法相关问题的思考[J].甘肃中医,2012,25 (11):36 -38.
[14]李仪奎.中药药理实验方法学[M].2 版.上海:上海科学技术出版社,2006:50 -60.

