缫丝蚕蛹蛋白酶解产物体外抗氧化能力研究
,,,,*
(1. 西南大学食品科学学院,重庆市农产品加工及贮藏重点实验室,重庆 400716; 2. 家蚕基因组生物学国家重点实验室,重庆 400716)
蚕蛹含有丰富的蛋白质,干蚕蛹中蛋白质含量高达45% ~ 55%,其中人体必需的8种氨基酸占总氨基酸的40%左右,是人类理想的蛋白质来源[1]。但缫丝蚕蛹有很重、很难除尽的腥味,不能被消费者直接接受;其次,蚕蛹蛋白的水溶性较差,不利于在生产中应用;再次,由于蚕蛹中存在约30ku的大分子蛋白,会引起部分人出现过敏反应,据估计,中国每年大约有1000人因食用蚕蛹蛋白而过敏,甚至出现休克症状[2]。因此,有必要对缫丝蚕蛹进行酶解,制备生物活性肽,提高缫丝蚕蛹蛋白的利用价值。
人类的衰老现象及许多慢性疾病都和人体内的自由基水平失衡有关,外源性的抗氧化剂可帮助人们维持体内自由基的平衡[3]。通过对具有抗氧化活性的天然食物进行研究有可能开发出有效的抗氧化药物和保健食品。研究发现植物蛋白、动物蛋白以及微生物蛋白中能水解分离出抗氧化肽[4]。闵建华等[5]以水解度和DPPH·清除能力为指标,赵钟兴[6]、李高扬等[7],以DPPH·清除能力为指标,卢楠等[8]以总还原能力为指标对酶解过程进行分析,优化了蚕蛹蛋白酶解的最佳工艺,并对水解产物多肽的体外抗氧化活性进行了研究。生物活性肽是近年来研究的热点,为了提高蚕蛹蛋白酶解产物的抗氧化活性,本文选用了不同的酶酶解缫丝蚕蛹蛋白并对酶解产物的抗氧化能力进行了探讨,期望为蚕蛹的深加工和综合利用提供理论依据和实验基础。

表1 五种酶最适水解条件表 Table 1 The table of five enzymes optimal hydrolyse conditions
1 材料与方法
1.1材料与仪器
缫丝蚕蛹 由重庆合川太和丝厂提供;脱脂蚕蛹蛋白(≥77. 31%) 自制,将干燥的缫丝蚕蛹粉碎,用索氏提取器用石油醚作溶剂抽提12h以去除其中的脂肪,剩余物干燥、粉碎而得脱脂蚕蛹蛋白粉;蚕蛹蛋白水解专用酶、中性蛋白酶 南宁东恒华道生物科技有限公司;木瓜蛋白酶、风味酶、胰酶 广西南宁庞博生物工程有限公司;二苯代苦味酰基(DPPH) Sigma公司;其他常用试剂均为分析纯。
pHs - 3C酸度计 上海三信仪表厂;5810型台式高速离心机 Eppendorf;UV - 2405分光光度计 日本岛津公司。
1.2实验方法
1. 2. 1 缫丝蚕蛹蛋白的酶解 根据前期研究结果,选取以下5种单酶或双酶对脱脂的缫丝蚕蛹蛋白进行酶解,酶解条件[9]如表1所示。采用恒温水浴维持水解温度不变,酶解过程中不断滴加1mol/L的NaOH或HCl溶液维持pH稳定,4h后停止酶解,沸水浴10min灭酶,迅速冷却至室温后用纯水补足在酶解过程散失的水分,4000r/min离心15min,收集上清液,冷冻备用进行抗氧化能力的研究。
1. 2. 2 酶解产物还原力的测定 参考Oyaizu[10]的铁氰化钾还原法将酶解所得的缫丝蚕蛹蛋白酶解液稀释100倍进行测定,同时作试剂空白。
将缫丝蚕蛹蛋白酶解液稀释10倍进行超氧阴离子清除率的测定。以1. 0mL蒸馏水加入2. 5mL的0. 1mol/L Tris - HCL缓冲溶液(pH8. 2,其中含1mmol/L EDTA)调零,加入10μL 50mmol/L的邻苯三酚(25℃水浴预热)迅速混匀,在320nm处每隔30s读取吸光度1次,5min后结束测定。作吸光值随时间变化的回归方程,其斜率为邻苯三酚自氧化速率V1。
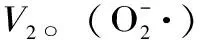
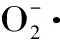
式中:V1- 对照组邻苯三酚自氧化速率;V2- 样品组邻苯三酚自氧化速率。
1. 2. 4 酶解产物对羟自由基(·OH)清除能力的测定 根据参考文献[13 - 14]的方法将缫丝蚕蛹蛋白酶解液稀释10倍进行对·OH清除率的测定。
1. 2. 5 酶解产物对二苯代苦味酰基自由基(DPPH·)清除能力的测定 测定方法根据参照文献[15]略加修改而得。
将缫丝蚕蛹蛋白酶液稀释100倍进行对DPPH·清除率的测定。用乙醇配制20μg/L DPPH·溶液,避光保存备用。分别取3. 0mL缫丝蚕蛹蛋白酶解稀释液于试管中,加入3. 0mL20μg/L DPPH·溶液,摇匀,放置30min后在517nm处测定其吸光值。在相同反应体系下分别测定样品组、样品空白组、空白对照组的吸光值。DPPH·的清除率计算公式如下:
式中:A1- 空白对照组的吸光值;A2- 样品组的吸光值;A3- 样品空白组的吸光值。
每项实验重复3次以上,实验结果取平均值,采用Excel 2003、SPSS17. 0进行数据分析,Origin8. 0软件做图。
2 结果与分析
2.1五种酶对缫丝蚕蛹蛋白的水解作用
五种酶在最佳的水解条件下与缫丝蚕蛹蛋白作用,计算缫丝蚕蛹蛋白的水解度,结果如图1所示:
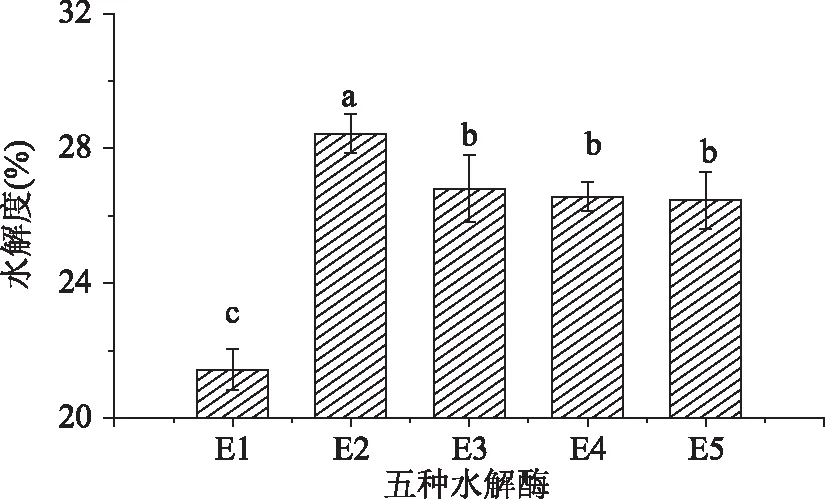
图1 五种水解酶水解度的比较Fig. 1 Comparison of five kinds of hydrolytic enzyme hydrolysis注:上标为水解度的显著性分析,不同字母表示不同酶解液的水解度具有显著性差异(p<0. 05),图2 ~ 图5同。
从图1可以看出,五种酶对缫丝蚕蛹蛋白的水解度均达到了20%以上,其中E2的水解作用最大,水解度为28. 44%,E3、E4、E5的水解作用次之,水解度分别为26. 81%、26. 57%、26. 46%。而E1的水解作用较低,水解度为21. 44%。双酶水解度较单一酶水解度高,这可能是因为双酶之间发生了协同作用,促进了蚕蛹蛋白的水解。
以这5种酶酶解缫丝蚕蛹得到的水解产物为样本,研究它们的体外抗氧化能力。
2.2缫丝蚕蛹蛋白酶解物还原力评价
多项研究表明,抗氧化活性与还原力存在正相关性[16 - 18]。还原力可表示抗氧化物质提供电子的能力,还原能力强的物质可以与自由基反应,通过提供电子使自由基变为稳定的物质,从而阻断自由基的链式反应,为实验材料清除活性氧等自由基或发挥抗氧化作用提供可能[19]。将缫丝蚕蛹蛋白酶解液稀释100倍测定其还原力,实验结果如图2所示:

图2 五种蚕蛹蛋白酶解物还原力的比较Fig. 2 Comparison of reducing power capability of five Silk reeling silkworm pupa protein hydrolysate
还原力主要用于评价抗氧化剂在氧化还原反应过程中整体的抗氧化能力[20]。以吸光值表示还原力,吸光度越高,还原能力越强。由图2可以看出,P1(蚕蛹蛋白水解专用酶酶解产物)的还原力最高,在700nm处的吸光度达到0. 75,显著(p<0. 05)高于双酶酶解生成多肽的还原力。双酶酶解生成的多肽中,P4(胰酶+中性蛋白酶酶解产物)还原力最高,在700nm处的吸光度为0. 54,P3(蚕蛹蛋白水解专用酶+木瓜蛋白酶酶解产物)和P5(胰酶+风味酶酶解产物)的还原力显著(p<0. 05)低于P4,700nm处的吸光度分别0. 49和0. 51,P2(蚕蛹蛋白水解专用酶+风味酶酶解产物)的还原力最低,700nm处的吸光度为0. 42。
由上可知,只采用E1酶解蚕蛹蛋白得到的多肽还原力高于复合酶酶解得到的多肽。
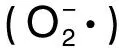
超氧阴离子自由基本身不太活泼,但可通过歧化反应和其它反应途径产生OH·,是生物体系中自由基产生的根源[21]。人体内的超氧阴离子一旦与羟基自由基(OH·)结合,其产物会导致细胞DNA损坏,破坏人类机体功能,而且其衍生的自由基也具有细胞毒性,会导致细胞DNA损伤及细胞膜损伤[22]。5种缫丝蚕蛹蛋白酶解原液稀释10倍后对超氧阴离子的清除效果的实验结果如图3所示:
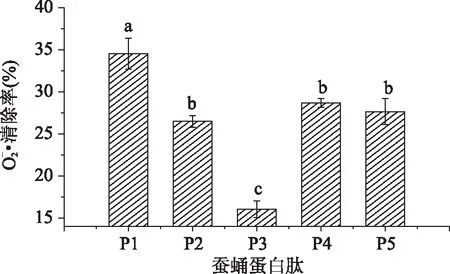
图3 五种缫丝蚕蛹蛋白酶解物对清除率的比较Fig. 3 Comparison of superoxide anion radical scavenging activity of five Silk reelingsilkworm pupa protein hydrolysate
2.4缫丝蚕蛹蛋白酶解物对·OH的清除能力
·OH是已知的存在于需氧生物代谢过程中的最强的氧自由基,几乎可以和所有的生物大分子发生不同类型的反应,其危害最大,能够引起生物膜、蛋白质和DNA的氧化损伤,导致细胞衰老、死亡和机体病变[18,23 - 24]。考察将五种缫丝蚕蛹蛋白酶解物稀释10倍对·OH的清除效果,实验结果如图4所示:
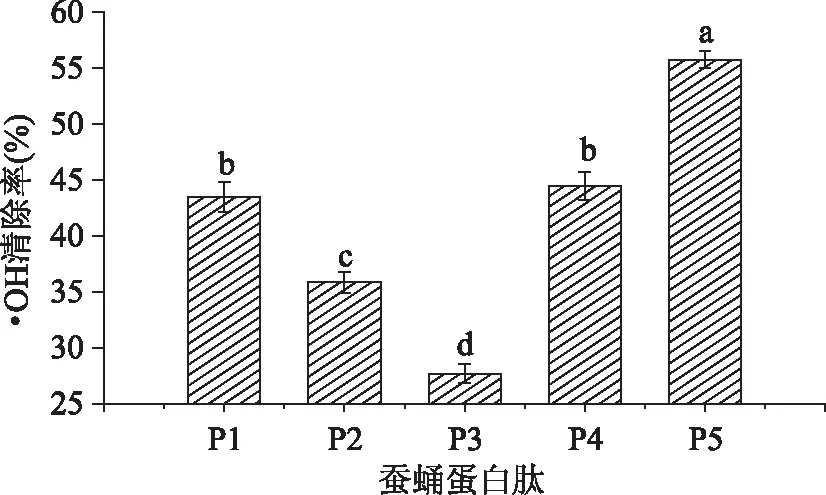
图4 五种缫丝蚕蛹蛋白酶解物对·OH的清除率的比较Fig. 4 Comparison of hydroxyl radical scavenging activity of five Silk reeling silkworm pupa protein hydrolysate
由图4可见,稀释10倍的P5对·OH的清除率显著(p<0. 05)高于其他组,清除率为55. 77%;稀释10倍的P1和P4对·OH的清除率次之,分别为43. 77%和44. 52%;稀释10倍的P3对·OH的清除率最低,仅为27. 72%。相同浓度的酶解物对·OH的清除力比对O-2·的清除力高,这可能是因为·OH极强的氧化能力更易于使肽类被氧化,同时肽类还能与Fe2+鳌合,从而减缓了Fenton反应产生·OH。
由上可知,采用E5酶解蚕蛹蛋白得到的多肽比其他复合酶酶解得到的多肽具有更强的·OH清除能力。
2.5缫丝蚕蛹蛋白酶解物对DPPH·的清除能力
DPPH·是一种较为稳定的以氮为中心的自由基,氮原子上有一个孤对电子,若孤对电子被配对,其乙醇溶液在517nm 处的吸光值减小,溶液颜色的变浅程度与配对电子数成正相关。因此,通过测定517nm 处的吸光值可以评价样品对芳香自由基的清除能力[25]。考察将五种缫丝蚕蛹蛋白酶解物稀释100倍对DPPH·清除能力,实验结果如图5所示:
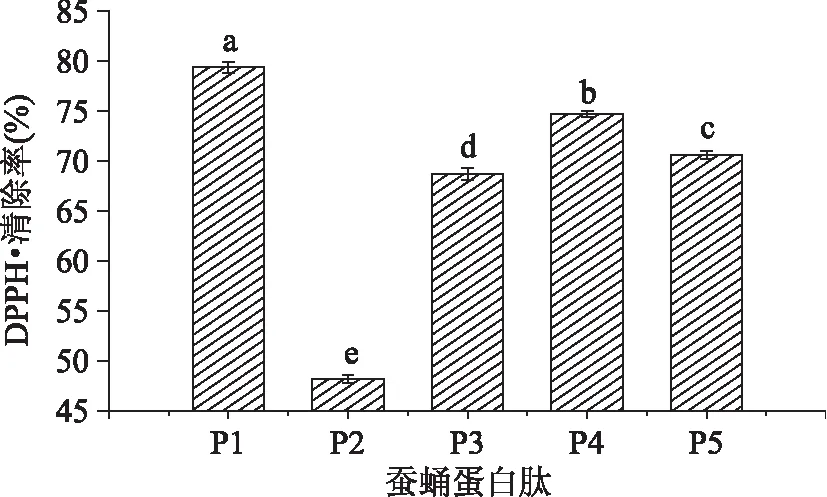
图5 五种缫丝蚕蛹蛋白酶解物对DPPH·清除率的比较Fig. 5 Comparison of DPPH· radical scavenging activity of five Silk reeling silkworm pupa protein hydrolysate
由图5可见,不同酶解物对DPPH·清除率具有显著(p<0. 05)差异,稀释100倍的P1对DPPH·的清除率显著(p<0. 05)高于双酶酶解生成的产物,清除率为79. 38%;稀释100倍的P4、P5、P3和P2对DPPH·的清除率依次减小,分别为74. 70%、70. 62%、68. 71%和48. 20%,其中P1、P3、P4、P5对DPPH·的清除力均高于采用碱性蛋白酶水解产物对DPPH·最大的清除率(63. 40%)[5]。蚕蛹蛋白水解产物对DPPH·具有很强的清除能力,这可能是因为水解产物直接捕获或与DPPH·相结合,通过还原作用把电子与质子传递给DPPH·氮原子上的单电子生成DPPH2,或者与DPPH·处于平衡状态的DPPH+发生氧化还原反应并还原DPPH+的氮 - 氮双键使其分解成三硝基苯胺[26],从而达到清除DPPH·的作用。
由上可知,只采用E1酶解缫丝蚕蛹蛋白比其他复合酶水解得到的产物具有更强的DPPH·清除能力。
3 结论
3.1在最佳的水解条件下,E2的水解作用最大,水解度为28. 44%,E3、E4、E5的水解作用次之,水解度分别为26. 81%、26. 57%、26. 46%,而E1的水解作用较低,水解度为21. 44%。

因此可采用E1酶解多肽作为抗氧化肽分离纯化的原料。这为蚕蛹的深加工综合利用及抗氧化肽的广泛应用提供理论依据和实验基础。
[1]董烨平,吴琼英. 蚕蛹蛋白开发与利用现状[J]. 农产品加工(学刊),2010(6):17 - 20
[2]Ji K M,Zhan Z K,Chen J J,etal. Anaphylactic shock caused by silkworm pupa consumption in China[J]. Allergy,2008(10):1407 - 1408.
[3]黄进,杨国宇,李宏基,等. 抗氧化剂作用机制研究进展[J]. 自然杂志,2003,26(2):74 - 77.
[4]Zhang T,Li Y H,Miao M,etal. Purification and characterisation of a new antioxidant peptide from chickpea(Cicer arietium L. )protein hydrolysates[J]. Food Chemistry,2011,128(1):28 - 33.
[5]闵建华,李建科,陈婷. 蚕蛹多肽的制备工艺及其体外抗氧化活性[J]. 食品科学,2009,30(14):123 - 126.
[6]赵钟兴,廖丹葵,孙建华,等. 蚕蛹蛋白酶解产物体外抗氧化和降血压活性筛选及响应面工艺优化[J]. 食品科学,2011,32(23):186 - 190.
[7]李高扬,崔堂兵,陈亮,等. 蚕蛹蛋白酶解制备抗氧化肽的初步研究[J]. 现代食品工业科技,2011,27(7):810 - 814.
[8]卢楠,廖鲜艳,翁新楚. 蚕蛹抗氧化肽的制备及其体外抗氧化活性评价[J]. 上海大学学报,2013,19(2):215 - 219.
[9]张海祥,魏兆军,周乐春,等. 响应曲面法优化动物蛋白酶水解脱脂蚕蛹蛋白的工艺[J]. 食品科学,2009,30(24):188 - 192.
[10]Oyaizu M. Studies on products of the browning reaction. Antioxidative activities of browning reaction products prepared from glucosamine[J]. Japanese Journal of Nutrition[Eiyogaku Zasshi],1986(6):307 - 315.
[11]王戈莎. 大米多肽的分离纯化及其抗氧化活性的研究[D]. 无锡:江南大学,2008.
[12]周徐慧. 汉麻籽蛋白抗氧化肽的制备及其活性研究[D]. 无锡:江南大学,2008.
[13]李锐达. 乳清抗氧化肽的制备及其生物活性研究[D]. 哈尔滨:东北林业大学,2010.
[14]王璇. 黑豆肽的制备及其抗氧化活性研究[D]. 郑州:河南工业大学,2012.
[15]代衍峰. 抗氧化玉米肽的制备及其功能与结构关系的研究[D]. 无锡:江南大学,2008.
[16]Duh P D. Antioxidant activity of burdock(Arctium lappa Linne):Its scavenging effect on free - radical and active oxygen[J]. Journal of the American Oil Chemists Society,1998(4):455 - 461.
[17]Chang H - Y,HO Y - L,Sheu M - J,etal. Antioxidant and free radical scavenging activities of Phellinus merrillii extracts[J]. Botanical Studies,2007(4):407 - 417.
[18]Li Y,Jiang B,Zhang T,etal. Antioxidant and free radical - scavenging activities of chickpea protein hydrolysate(CPH)[J]. Food Chemistry,2008(2):444 - 450.
[19]Ferreira I C F R,Baptista P,Vilas - boas M,etal. Free -radical scavenging capacity and reducing power of wild edible mushrooms from northeast Portugal:Individual cap and stipe activity[J]. Food Chemistry,2007(4):1511 - 1516.
[20]Kou X,Gao J,Xue Z,etal. Purification and identification of antioxidant peptides from chickpea(Cicer arietinum L. )albumin hydrolysates[J]. Lwt - Food Science and Technology,2013(2):591 - 598.
[21]Halliwell B,Gutteridge J M C. Role of free - radicals and catalytic metal - ions in human - disease - an overview[J]. Methods In Enzymology,1990,1 - 85.
[22]Faraggi M,Houee - levin C. Some aspects of the chemistry and biology of the superoxide radical anion[J]. Journal De Chimie Physique Et De Physico - Chimie Biologique,1999(1):71 - 84.
[23]许申鸿. 一种测定·OH产生与清除的新化学发光体系[J]. 分析测试学报,2000(2):11 - 13.
[24]Je J Y,Qian Z J,Byun H G,etal. Purification and characterization of an antioxidant peptide obtained from tuna backbone protein by enzymatic hydrolysis[J]. Process Biochemistry,2007(5):840 - 846.
[25]Shimada K,Fujikawa K,Yahara K,etal. Antioxidative properties of xanthan on the autoxidation of soybean oil in cyclodextrin emulsion[J]. Journal of Agricultural and Food Chemistry,1992(6):945 - 948.
[26]李铉军,崔胜云. 抗环血酸清除DPPH自由基的作用机理[J]. 食品科学,2011,32(1):86 - 90.

