草鱼PAX7基因的克隆、序列分析及组织表达
甘甜 冷向军 郭婷 胡静 魏静 李小勤
(上海海洋大学水产与生命学院 教育部水产种质资源发掘与利用重点实验室,上海 201306)
草鱼PAX7基因的克隆、序列分析及组织表达
甘甜 冷向军 郭婷 胡静 魏静 李小勤
(上海海洋大学水产与生命学院 教育部水产种质资源发掘与利用重点实验室,上海 201306)
配对盒基因7(Paired box 7 gene,PAX7)在神经嵴发育及原肠胚形成、肌肉自主更新与再生中扮演着重要角色,对细胞更新、分化、凋亡等起着十分重要的调控作用。参照GenBank中斑马鱼、线鳍电鳗和虹鳟等物种PAX7序列的保守区域设计简并引物,进行反转录PCR扩增,获得草鱼PAX7基因的部分序列,长645 bp,编码214个氨基酸,包含编码128个氨基酸的PAX7蛋白配对框(PD)。氨基酸序列比对结果发现,草鱼PAX7基因与其他物种具有高度的相似性,与斑马鱼、线鳍电鳗、日本青鳉、金头鲷、虹鳟、大西洋鲑、北极嘉鱼、人、野牦牛、褐家鼠和小鼠的PAX7氨基酸序列同源性可达90%-97%;各物种PAX7部分氨基酸序列的系统进化树结果显示,草鱼与斑马鱼、日本青鳉、北极嘉鱼、大西洋鲑、虹鳟、线鳍电鳗和金头鲷聚为一大支,小鼠、褐家鼠,野牦牛与人类另聚一支,所得结果符合物种传统分类进化地位。运用实时荧光定量PCR检测草鱼PAX7基因在各组织中的差异表达,结果显示PAX7基因在肌肉中表达量最高;其次是前肠和皮肤,在心、脑、肾和肝中仅少量表达,所得结果与该基因的功能相一致。
PAX7基因 草鱼 序列分析 组织差异表达
PAX基因,又名配对盒基因,因其各成员均含有配对结构域(Paired box)而得名,该基因不同成员间有的含有同源域(Homeodomain,HD),有的不含同源域,有的含有八肽域(Octapeptide,OP),有的不含八肽域[1]。因该基因的所有成员均含有配对结构域而导致不同成员间在功能上的部分相似。目前,已发现果蝇PAX基因有10个成员,其中PAX7最早是在果蝇胚胎体节中被发现[2]。而在脊椎动物上,已发现9个成员(PAX1-PAX9),根据其功能结构域的不同将其分为4个亚家族[3]:(1)PAX1和 PAX9;(2)PAX2、PAX5和 PAX8;(3)PAX3和PAX7;(4)PAX4和PAX6。其中,PAX7基因是PAX家族中第Ⅲ亚家族的一员,该基因包含一个配对框(Paired Box domain,PD)、一个同源域(Homeodomain,HD)、一个八肽结构(Octapeptide,OP)和数个外显子编码的转录区[4],八肽结构在配对框和同源域之间,配对框和同源域是DNA结合区。配对框通过选择性剪接方式产生4种PAX7转录物(PAX7a-d),经体外模型研究发现,正常胚胎及成人肌组织持续表达这4种不同的转录物[5]。
PAX蛋白是一类非常保守的转录因子,其中的PAX7主要通过自身配对结构域与DNA结合引发一系列基因转录和表达,从而引起相应的生理反应,其研究主要集中在大脑和肌肉组织。它能促进幼小鼠[4]、北极嘉鱼[6]和斑马鱼[7]胚胎的中枢神经系统发育,以及成年鼠[8]视神经损伤的再建,还能刺激人[9]、小鼠[4,10]、斑马鱼[11]、线鳍电鳗[12]及北极嘉鱼[6]骨骼肌发育与自我更新、肌肉损伤的再生与修复,但PAX7过表达会引发肌肉肥大[13]甚至肌源性肿瘤[14]。此外,PAX7基因还被用作体外原代肌卫星细胞培养的鉴定基因。因为成熟肌肉组织中除成熟肌细胞外,还有肌卫星细胞和非肌源性细胞包括成纤维细胞、间质细胞、常驻巨噬细胞、纤维/脂肪祖细胞(FAPs)和微脉管系统相关细胞等[15]。如何鉴别出其中的肌卫星细胞显得尤为重要。Seale等[16]研究发现成年小鼠PAX7在肌源性卫星细胞系即卫星细胞和增殖成肌细胞中表达,而在非肌源性细胞系包括如成纤维细胞系、转染腺病毒E1A基因的人肾上皮细胞系、间充质干细胞、胚胎癌细胞系、子宫颈癌细胞系、人乳腺癌细胞系等中不表达。因此,PAX7基因的表达与否,被用于是否是肌源性细胞的鉴别依据,以及肌肉组织培养物的筛选。目前,已有Reimann[17]、徐青[18]、陈岩[19]、单艳菊[20]、罗桂芬[21]和Weber等[12]分别在人、壁虎、鸡、鸭、猪和线鳍电鳗上将PAX7基因作为体外原代肌卫星细胞鉴定基因的报道。
GenBank中已有PAX7基因氨基酸序列报道的鱼类有斑马鱼(NP_001139621.1)、线鳍电鳗(ACC86106.1)、日本青鳉(BAN57331.1)、金头鲷(AEV53628.1)、虹鳟(NP_001245265.1)、大西洋鲑(CAF02090.1)和北极嘉鱼(CAG25522.1)等,其中有相关文献报道的仅见斑马鱼胚胎PAX7作为肌源性调节因子在生皮肌节样组织中的表达[22]以及在神经嵴、色素细胞系和色素干细胞的鉴定[23];北极嘉鱼[6]幼鱼PAX7在颅颌面、肌肉及中枢神经系统发育中的重要作用;四倍体大西洋鲑[24]幼鱼PAX7基因多个剪切体的识别以及成鱼PAX7基因在不同组织中的差异表达。而草鱼尚无关于PAX7基因序列及相关研究报道,本试验首次对草鱼PAX7基因片段进行克隆,旨在为草鱼肌肉组织原代细胞培养后肌卫星细胞的鉴定提供依据,为探明外源性营养对于肌纤维的形成及调控奠定基础。
1 材料与方法
1.1 材料
1.1.1 材料来源 试验用草鱼由上海海洋大学特种养殖场提供,基因克隆用草鱼体重约为(10±0.5)g,将鱼体用酒精消毒去皮后,采集背鳍下方侧线上方肌肉组织于-80℃超低温冰箱中保存备用。组织差异表达试验用草鱼体重为(1.3±0.1)kg,解剖后取其肝脏、肾脏、皮肤、肌肉、心脏、脑和前肠用液氮速冻后转入-80℃超低温冰箱保存备用。
1.1.2 主要试剂与仪器 RNAiso Plus总RNA提取试 剂、PrimeScript® Reverse Transcriptase、Ex Taq酶、DNA Marker2000、SYBR® Premix Ex Taq(Perfect Real Time)均为TaKaRa公司产品;琼脂糖凝胶、pMD19-T质粒试剂盒、DH5α感受态细胞、Agarose琼脂糖、IPTG、X-gal购自天根生化科技公司;LB培养基购自上海生工公司;DNA纯化试剂盒购自北京康为世纪生物科技有限公司;核酸染料Gold view
(GV)购自上海赛百盛基因技术有限公司;其它试剂均为分析纯,购自国药集团。
台式高速冷冻离心机(5810R,Eppendorf公司,德国);蛋白核酸分析仪(Smart SpecTMplus,Bio-Rad公司,美国);梯度PCR仪(C1000,Bio-Rad公司,美国);凝胶成像系统(Biorad GelDoc XR,Bio-Rad公司,美国);荧光定量PCR仪(7500,ABI公司,美国);电泳仪(CYY-6C,北京市六一仪器厂);ABI3730XL测序仪(ABI公司,美国,上海美吉生物医药科技有限公司)。
1.2 方法
1.2.1 PAX7基因克隆
1.2.1.1 肌肉组织总RNA提取及反转录 取草鱼肌肉组织,按TaKaRa RNAiso Plus RNA提取试剂说明书提取总RNA,按照TaKaRa PrimeScript Reverse Transcriptase(反转录酶)试剂盒方法以Oligo(dT)18为引物合成cDNA第一链。
1.2.1.2 引物设计及 PCR 扩增反应 根据GenBank中已报道的斑马鱼Danio rerio(BC163502.1)、线鳍电鳗Sternopygus macrurus(EU624121.1)、虹鳟Oncorhynchus mykiss(NM_001258337.1)等物种的PAX7基因核苷酸保守序列设计简并引物(表1),送上海生工生物工程有限公司合成。
采用25 μL扩增体系进行PCR扩增:10×Ex Taq Buffer(Mg2+Plus)2.5 μL,dNTP(各2.5 mmol/L)4 μL,上下游引物各0.5 μL(10 μmol),Ex Taq酶0.25 μL,模板1 μL,RNase free dH2O 16.25 μL,扩增程序:95℃ 4 min;95℃ 30 s,56.5℃ 30 s,72℃ 30 s,37个循环;72℃ 10 min。扩增产物经琼脂糖凝胶电泳检验后用于DNA纯化。
1.2.1.3 目的基因的克隆和测序 根据琼脂糖凝胶微量DNA回收试剂盒说明书纯化回收目的基因,将纯化产物与载体以摩尔比3∶1的添加量与pMD19-T载体在16℃连接6 h,转化DH5α感受态细胞,涂布于含有IPTG、X-gal和氨苄青霉素的LB固体培养基上37℃过夜培养,挑取多个白色菌落接种于含氨苄青霉素的LB液体培养基中37℃ 200 r/min振荡培养6-12 h,再通过菌液PCR筛选阳性重组克隆,送上海美吉测序公司测序。所得序列翻译成氨基酸序列后进行同源性分析,采用MEGA4构建分子系统树。运用NCBI蛋白结构数据库(http://www.ncbi.nlm. nih.gov/Structure/cdd/wrpsb.cgi)工具CDD(Conserved Domain Database)分析所得草鱼PAX7基因蛋白结构域。
1.2.2 组织差异表达分析
1.2.2.1 实时荧光定量 PCR 根据克隆获得的草鱼PAX7基因片段序列设计荧光定量PCR引物(表1),扩增片段长82 bp,另据草鱼β-actin(DQ211096.1)设计内参基因引物(表1),扩增片段长152 bp。
提取肝脏、肾脏、皮肤、肌肉、心脏、脑、前肠组织的RNA,方法同1.2.1.1,按PrimeScript®RT reagent Kit with gDNA Eraser(Perfect Real Time)说明书逆转录为cDNA。
实时荧光定量PCR根据TaKaRa SYBR®Premix-Ex Taq(Perfect Real Time)试剂盒说明书进行,采用20 μL反应体系:SYBR® Premix Ex Taq(2×)10 μL,上下游引物(10 μmol/L)各0.5 μL,cDNA模板2 μL,Rox Reference DyeⅡ 0.5 μL,ddH2O 6.5 μL;荧光定量PCR扩增程序为:95℃预变性30 s;95℃变性5 s,55℃退火34 s,40个循环;后95℃ 15 s,60℃ 1 min,95℃ 15 s进行熔解曲线检测,每个样本3个重复。分别制作内参基因β-actin和目的基因PAX7的标准曲线,以检测实时荧光定量PCR引物的特异性和试验的可靠性。选取合适的浓度梯度进行实时荧光定量PCR 反应,以各浓度模板的Ct值位于15-30之间为宜。
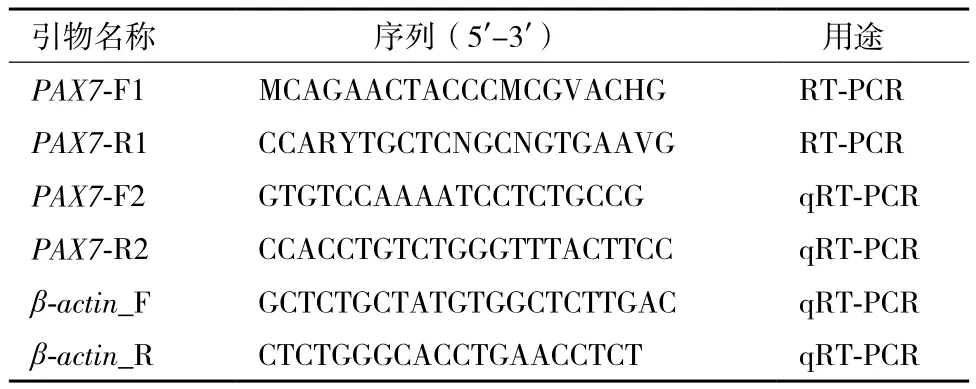
表1 PAX7基因克隆及荧光定量PCR所用引物
1.2.2.2 不同组织mRNA相对表达量计算 以草鱼β-actin基因为内参,对得到的各组织样品Ct值进行均一化处理,并以各组织中最低表达量组织为基准,用2-△△Ct法计算不同组织PAX7基因mRNA的相对
表达量。采用SPSS17.0中one-way ANOVA进行差异显著性检验,P<0.05表明差异显著,结果以平均值标准差表示(±s)。
2 结果
2.1 PAX7基因克隆及序列分析
肌肉总RNA提取质量检测结果(图1)显示,条带清晰,RNA完整性好,浓度为268 μg/mL,OD260/280为1.86,符合反转录PCR试验要求。
以简并引物PAX7-F1、PAX7-R1及草鱼肌肉cDNA为模板进行PCR扩增,扩增产物电泳后经凝胶成像系统UV检测结果(图2)显示,获得了一条长约647 bp的单一条带,片段大小与预期的目的片段基本一致。
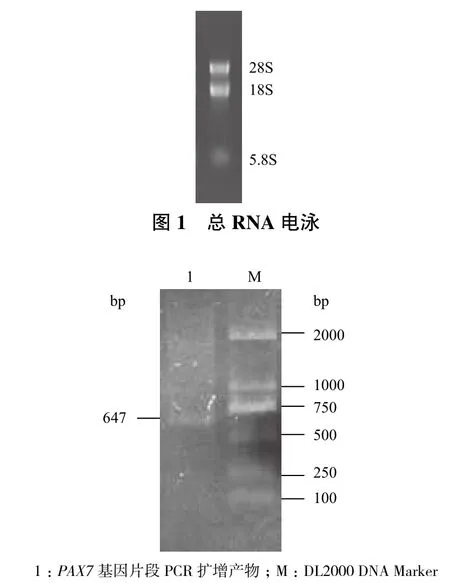
图2 草鱼PAX7基因片段PCR扩增产物
草鱼PAX7基因片段的克隆测序结果以及利用SMS在线工具包进行序列分析的结果(图3)显示,所得草鱼PAX7基因序列长645 bp,编码214个氨基酸(GenBank登录号:KJ195463)。
运用NCBI在线工具CDD(Conserved Domain Database)分析所得草鱼PAX7基因蛋白结构域(图4)显示,红色区域为PAX7配对框(PD),共128个氨基酸。

图3 草鱼PAX7基因部分序列及推测的氨基酸序列
经BLASTP 程序搜索 GenBank 的 Non-redundant protein sequences(nr)数据库进行PAX7部分序列氨基酸同源性比对,结果显示所得草鱼PAX7部分氨基酸序列与斑马鱼 Danio rerioⅡPAX7b(NP_001139621.1)、线鳍电鳗Sternopygus macrurus(ACC86106.1)、斑马鱼Danio rerioⅠPAX7a(AAI63492.1)、日本青鳉Oryzias latipesⅠPAX7a(BAN57331.1)、金头鲷Sparus aurata(AEV53628.1)、虹鳟Oncorhynchus mykissⅡPAX7b(NP_001245265.1)、大西洋鲑Salmo salar(CAF02090.1)、北极嘉鱼Salvelinus alpines(CAG25522.1)、人Homo sapiens(CAA84513.1)、野牦牛Bos grunniens mutus(ELR4572-2.1)、褐家鼠Rattus norvegicus(NP_001178913.1)和小鼠Mus musculus(EDL13317.1)的PAX7氨基酸序列相似性依次为97%、97%、96%、96%、94%、93%、91%、91%、92%、91%、90%和90%。
利用MEGA4软件以邻位相接(Neighbor joining,NJ)法构建的各物种PAX7部分氨基酸序列系统进化树结果(图5)显示,草鱼与斑马鱼Ⅱ聚成一支,后与日本青鳉聚成一小支,再与北极嘉鱼、大西洋鲑、虹鳟、线鳍电鳗、斑马鱼Ⅰ、金头鲷聚为一大支,小鼠、褐家鼠与人类、野牦牛另聚一支,所得结果符合物种传统分类进化地位。
2.2 草鱼PAX7基因的组织差异表达
运用实时荧光定量PCR技术,以最低表达量脑组织为校准样本计算草鱼各组织的相对表达量,构建草鱼PAX7基因的组织表达谱。表2和图6显示,PAX7基因在草鱼肌肉、肾、心、脑、皮肤、肝和
前肠均有表达,在肌肉组织中表达量最高,显著高于其他组织(P<0.05),其次是前肠和皮肤组织,在肾、心、肝、脑组织中少量表达,显著低于其他组织(P<0.05)。
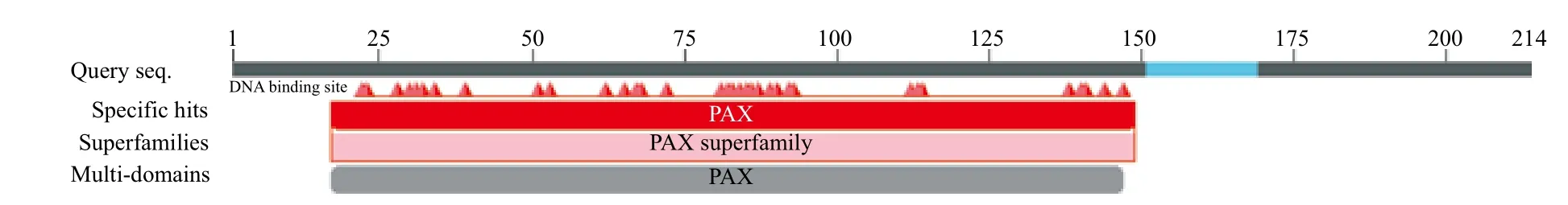
图4 草鱼PAX7部分蛋白结构域分析
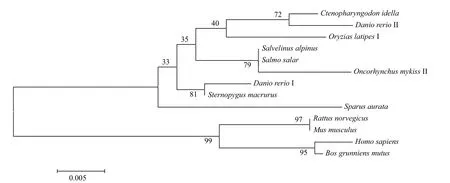
图5 根据NJ法构建PAX7蛋白氨基酸序列系统进化树
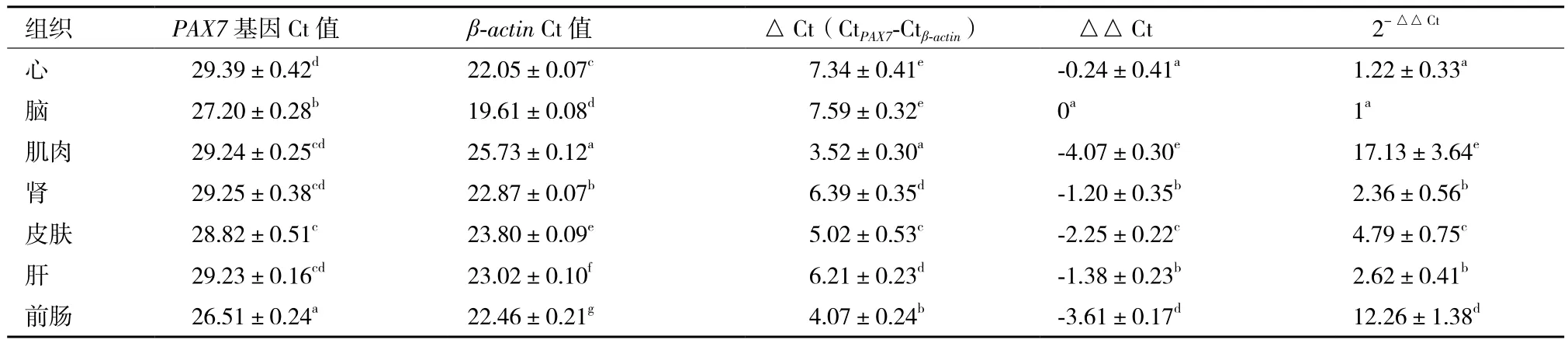
表2 草鱼PAX7基因组织表达
3 讨论
PAX7基因的组织差异表达,仅见在小鼠和鱼中有研究。Seale[16]对成年小鼠Northern杂交后发现PAX7在肌肉组织中特异表达,在脑、心、肠、肾和肝组织中不表达。而在水产动物中,Sibthorpe等[6]采用原位杂交技术研究北极嘉鱼PAX7对颅颌面、骨骼肌及中枢神经系统发育中的重要作用,发现该基因在个体发育早期中脑、后脑、脊髓和体节表达,在成鱼脑和骨骼肌中表达,其他组织未进行检测;Gotensparre等[24]对四倍体大西洋鲑成鱼进行组织差异表达分析后发现,PAX7基因在脑中表达量最高,其次是慢肌和快肌,在鳃、脾、心和鱼鳔中不表达,但对皮肤未进行检测。而本试验结果显示PAX7基因在草鱼肌肉组织中表达量最高;其次是前肠和皮肤,肾、心、和肝组织表达量较低,在脑组织中表达量最低,所得结果与前人研究有一定差异,但可以明确的是PAX7基因在各物种肌肉组织中均有高表达,可见PAX7基因在肌肉中的重要性。
至于PAX7在皮肤和前肠中也有相对较高的表达,其原因可能与皮肤中分布的大量色素细胞相关,
因在斑马鱼幼鱼色素细胞的研究中发现,PAX7基因在黑色素细胞、色素干细胞和神经嵴中均有表达[23]。
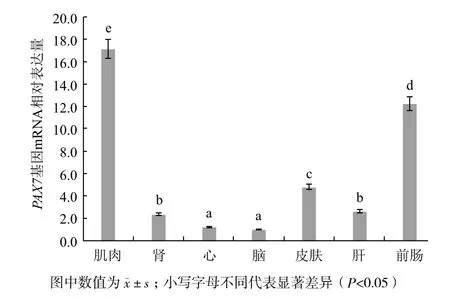
图6 草鱼PAX7基因的组织表达图谱
关于肠PAX7的表达,仅见一篇文献报道,且是成年小鼠肠PAX7不表达的报道[16],本试验在草鱼中的高表达恰好与其相反。究其原因,可能与肠道的采样部位有关,因无胃的草鱼前肠与食道相连接的部分有一些由食道的肌层延伸而来的横纹肌纤维[25],也有可能与物种特异性有关。
本试验在脑组织中低表达,而不同物种的文献报道结果不一致,在幼小鼠[4]和仔稚斑马鱼[7,11]中的研究表明,发育早期PAX7主要表达于整个动物脑组织中,后局限于中脑,进一步延伸至背侧心室区甚至整个前后轴。在大西洋鲑成鱼脑中PAX7基因也是表达量最高,而成年小鼠脑组织却未发现PAX7表达[4,16]。因此认为,脑组织中PAX7表达量与种属相关,同时也可能受生理、年龄的影响。
4 结论
本试验首次成功克隆获得草鱼PAX7基因部分序列,长645 bp,编码214个氨基酸,与其他物种同源性均在90%以上,系统进化树符合物种传统分类进化地位。该基因在肌肉中高表达,其次是前肠和皮肤,在心、脑、肾和肝中仅少量表达。
[1]Wehr R, Gruss P. Pax and vertebrate development[J]. The International Journal of Developmental Biology, 1996, 40(1):369-377.
[2]李莉, 杨杨, 薛雷. Pax 基因家族在果蝇发育过程中的调控作用[J].遗传, 2010, 32(2):115-121.
[3]Lang D, Powell SK, Plummer RS, et al. PAX genes:roles in development, pathophysiology, and cancer[J]. Biochemical Pharmacology, 2007, 73(1):1-14.
[4]Jostes B, Walther C, Gruss P. The murine paired box gene, Pax7, is expressed specifically during the development of the nervous and muscular system[J]. Mechanisms of Development, 1990, 33(1):27-37.
[5]Ziman MR, Thomas M, Jacobsen P, Beazley L. A key role for Pax7 transcripts in determination of muscle and nerve cells[J]. Experimental Cell Research, 2001, 268(2):220-229.
[6]Sibthorpe D, Sturlaugsdóttir R, Kristjansson BK, et al. Characterisation and expression of the paired box protein 7(Pax7)gene in polymorphic Arctic charr(Salvelinus alpinus)[J]. Comparative Biochemistry and Physiology Part B:Biochemistry and Molecular Biology, 2006, 145(3):371-383.
[7]Minchin JE, Hughes SM. Sequential actions of Pax3 and Pax7 drive xanthophore development in zebrafish neural crest[J]. Developmental Biology, 2008, 317(2):508-522.
[8]Thomas MG, Barker RA, Beazley LD, Ziman MR. Pax7 expression in the adult rat superior colliculus following optic nerve injury[J]. Neuroreport, 2007, 18(2):105-109.
[9]Hyatt JPK, McCall GE, Kander EM, et al. PAX3/7 expression coincides with MyoD during chronic skeletal muscle overload[J]. Muscle & Nerve, 2008, 38(1):861-866.
[10]Brzóska E, Przewoźniak M, Grabowska I, et al. Pax3 and Pax7 expression during myoblast differentiation in vitro and fast and slow muscle regeneration in vivo[J]. Cell Biology International, 2009, 33(4):483-492.
[11]Seger C, Hargrave M, Wang X, et al. Analysis of Pax7 expressing myogenic cells in zebrafish muscle development, injury, and models of disease[J]. Developmental Dynamics, 2011, 240(11):2440-2451.
[12]Weber CM, Martindale MQ, Tapscott SJ, Unguez GA. Activation of Pax7-positive cells in a non-contractile tissue contributes to regeneration of myogenic tissues in the electric fish S. macrurus[J]. PloS One, 2012, 7(5):e36819.
[13]Ishido M, Uda M, Kasuga N, Masuhara M. The expression patterns of Pax7 in satellite cells during overload-induced rat adult skeletal muscle hypertrophy[J]. Acta Physiologica, 2009, 195(4):459-469.
[14]Schäfer BW, Czerny T, Bernasconi M, et al. Molecular cloning and characterization of a human PAX-7 cDNA expressed in normal and neoplastic myocytes[J]. Nucleic Acids Research, 1994, 22(22):4574-4582.
[15]Mann CJ, Perdiguero E, Kharraz Y, et al. Aberrant repair and fibrosis development in skeletal muscle[J]. Skelet Muscle, 2011, 1(1):21.
[16]Seale P, Sabourin LA, Girgis-Gabardo A, et al. Pax7 is required for the specification of myogenic satellite cells[J]. Cell, 2000, 102(6):777-786.
[17]Reimann J, Brimah K, Schröder R, et al. Pax7 distribution in human skeletal muscle biopsies and myogenic tissue cultures[J]. Cell and Tissue Research, 2004, 315(2):233-242.
[18]徐青, 徐敏, 张加吉, 等.壁虎骨骼肌卫星细胞的原代培养与鉴定[J].交通医学, 2011, 25(2):110-117.
[19]陈岩, 王琨, 朱大海.鸡骨骼肌卫星细胞的分离培养, 鉴定及生物学特性研究[J].遗传, 2006, 28(3):257-260.
[20]单艳菊, 束婧婷, 宋迟, 等.鸭骨骼肌卫星细胞的分离培养与鉴定[J].江苏农业科学, 2012, 40(12):26-28.
[21]罗桂芬, 文旭辉, 杨公社.猪肌卫星细胞的分离培养及鉴定[J].细胞与分子免疫学杂志, 2006, 22(6):823-825.
[22]Hammond CL, Hinits Y, Osborn DP, et al. Signals and myogenic regulatory factors restrict pax3 and pax7 expression to dermomyotome-like tissue in zebrafish[J]. Developmental Biology, 2007, 302(2):504-521.
[23]Domínguez L. Pax7 identifies neural crest, chromatophore lineages and pigment stem cells during zebrafish development[J]. Int J Dev Biol, 2007, 51:327-331.
[24]Gotensparre SM, Andersson E, Wargelius A, et al. Insight into the complex genetic network of tetraploid Atlantic salmon(Salmo salar L.):Description of multiple novel Pax-7 splice variants[J]. Gene, 2006, 373:8-15.
[25]楼允东.组织胚胎学[M].北京:中国农业出版社, 1994:104.
(责任编辑 马鑫)
Cloning and Tissue Expression Analysis of PAX7 Gene in Grass Carp(Ctenopharyngodon idellus)
Gan Tian Leng Xiangjun Guo Ting Hu Jing Wei Jing Li Xiaoqin
(Key Laboratory of Exploration and Utilization of Aquatic Genetic Resources,the College of Fisheries and Life Science,Shanghai Ocean University,Ministry of Education,Shanghai 201306)
Paired box gene 7(PAX7)is crucially important to the cellular renewal, differentiation and apoptosis, especially in neural crest development, gastrulation, and muscle self-renewal. The PAX7 domains sequence is conserved among several species, such as zebrafish, apteronotidae, and rainbow trout, and the conserved sequence zebrafish was used to design degenerate primers for reverse-transcription PCR(RTPCR). A partial sequence of PAX7 from grass carp was obtained for a 645 bp segment encoding a 214 amino acid peptide, containing a paired box domain with 128 amino acids. The deduced protein showed homology to zebrafish(Danio rerio), apteronotidae(Sternopygus macrurus), Japanese Medaka(Oryzias latipes), gilthead bream(Sparus aurata), rainbow trout(Oncorhynchus mykiss), Atlantic salmon(Salmo salar), Arctic charr(Salvelinus alpinus), human(Homo sapiens), wild yak(Bos grunniens mutus), brown rat(Rattus norvegicus), and mouse(Mus musculus)with 90%-97% identities. Analysis of the PAX7 phylogenetic tree revealed that the grass carp joined with zebrafish, and there was a confluence of Japanese medaka, Arctic charr, Atlantic salmon, rainbow trout, apteronotidae and gilthead bream. The other branch was consisted of mouse, brown rat, wild yak and human. These results conformed to the traditional species classification evolution status. The expression in tissues was detected by Real-time quantitative PCR, which indicated that the highest level of PAX7 gene expression was found in muscle, a lower expression level was found in foregut and skin, and the lowest detectable level was found in heart, brain, kidney and liver. The results are in agreement with the function of the gene.
PAX7 gene Grass carp(Ctenopharyngodon idellus) Sequence analysis Tissue differential expression
2014-04-22
上海市自然科学基金项目(13ZR1419600)
甘甜,女,硕士研究生,研究方向:分子营养;E-mail:499314787@qq.com
李小勤,女,硕士,副教授,研究方向:遗传营养学;E-mail:xqli@shou.edu.cn

