绿头鸭IFN-α的可溶性表达及其活性分析
刘澜澜庄艳娜于晓红曾祥伟
(1.黑龙江中医药大学基础医学院,哈尔滨 150040;2.东北林业大学野生动物资源学院,哈尔滨 150040)
绿头鸭IFN-α的可溶性表达及其活性分析
刘澜澜1庄艳娜2于晓红1曾祥伟2
(1.黑龙江中医药大学基础医学院,哈尔滨 150040;2.东北林业大学野生动物资源学院,哈尔滨 150040)
为了利用原核表达系统研制有生物活性的鸭IFN-α。以pMD18T-MaIFN-α为模板扩增绿头鸭IFN-α成熟肽基因,将其克隆至原核表达载体pET-32a中,在大肠杆菌BL21中进行变温诱导表达。SDS-PAGE分析表达结果,并用Western blotting进行验证。Ni2+树脂柱纯化目的蛋白后,测定其生物活性。结果表明,重组pET-32a(+)-MaIFN-α在大肠杆菌BL21成功表达,主要以可溶性形式存在,Western blotting分析显示目的蛋白具有良好的抗原性。细胞病变抑制法测定重组鸭IFN-α的抗病毒活性约为8×104U/mL;荧光定量PCR方法检测显示表达的重组鸭IFN-α使NDV在DEF上的复制受到了明显的抑制,48 h时间点相对抑制率高达91%。这些都表明表达的重组鸭IFN-α具有良好抗病毒活性。
绿头鸭 IFN-α 可溶性表达 活性分析
干扰素(Interferon,IFN)是具有良好的抗病毒、抗肿瘤活性和免疫调节作用的细胞因子[1-3]。目前IFN可分为Ⅰ型和Ⅱ型,Ⅰ型IFN 主要包括IFN-α、β、ω、δ、κ、ε、ξ 和τ 等,Ⅱ型IFN 只有IFN-r一种[4]。其中α-干扰素以其突出的抗病毒效应而备受重视,其抗病毒、抗肿瘤活性作用要明显强于Ⅱ型IFN;同时也具有一定的免疫调节作用,但要弱于Ⅱ型IFN。
鸭IFN-α的开放阅读框架由576个核苷酸组成,编码191个氨基酸,前30个氨基酸为信号肽,后161个氨基酸为成熟活性蛋白。1995年Schultz等[5]首次成功克隆了鸭I型干扰素基因。国内从2000年开始陆续有关于鸭干扰素的报道,目前北京鸭、番鸭、绍兴鸭和四川麻鸭等的序列先后被克隆和测定[6-9]。国内学者也先后利用不同表达系统表达了鸭IFN-α,原核表达重组鸭IFN-α蛋白表达量较高,
但多以包涵体形式存在,需要经过复性才能获得其生物活性[8];真核表达系统表达重组鸭IFN-α蛋白具有较好的生物活性,但表达量很低。这些都限制了鸭IFN-α在临床实践中的大量应用。获得高表达量并具有活性的鸭IFN-α是目前亟待解决的问题。
本研究尝试对绿头鸭的IFN-α成熟肽基因进行表达,仍然应用原核表达系统,但是通过变温诱导来优化表达条件,力求减少包涵体的形成,增加融合蛋白的可溶性,旨在获得具有较高生物活性的鸭IFN-α重组蛋白。
1 材料与方法
1.1 材料
1.1.1 载体菌株、毒株和试验动物 含有绿头鸭IFN-α基因的重组质粒pMD18T-MaIFN-α、pMD18TDNV-F由本实验室构建并保存,原核表达载体pET 32a(+)、感受态E.coli BL21受体菌购于美国Invitrogen 公司。新城疫病毒(NDV)F48E9株、水泡口炎病毒(vsv)、鸭胚由中国农业科学院哈尔滨兽医研究所提供。
1.1.2 试剂 DNA凝胶回收试剂盒、限制性内切酶EcoR I、Hind III、Ex Taq酶、T4 DNA连接酶、 One Step SYBR® PrimeScriptTMRT-PCR Kit II、蛋白Marker等购自大连宝生物公司。抗His标签单抗、辣根过氧化物酶(HRP)标记的羊抗鼠IgG 购自Sigma公司。
1.1.3 引物 参考GenBank上发表的鸭IFN-α基因(登录号:X84764)和NDV的F基因(登录号:AY508514)相关基因序列,设计了2对引物。其中IFNA-F、IFNA-R用于扩增鸭IFN-α成熟肽基因上游引物分别加入了EcoRⅠ、Hind III酶切位点(酶切位点用下划线标注);Ffp、Frp用于扩增新城疫病毒(NDV)的F基因。引物由上海英骏公司合成,具体见表1。
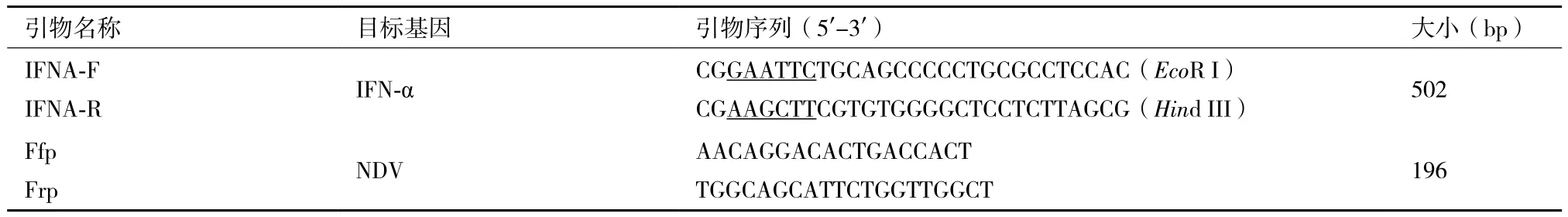
表1 本研究中所使用的引物
1.2 方法
1.2.1 原核表达重组质粒的构建及目的基因的表达 以pMD18T-MaIFN-α为模板,以IFNA-F、IFNA-R为引物,使用Ex Taq酶对鸭IFN-α成熟肽基因进行常规扩增反应,将扩增产物和原核表达载体pET-32a(+)分别用EcoRⅠ和Hind III双酶切,回收、连接,构建重组表达质粒pET-32a(+)-Ma-IFN-α,并且测序鉴定重组质粒的正确性。将鉴定后的阳性重组质粒转化入E.coli BL21感受态细胞中,进行变温诱导表达,在新鲜的含有Amp+的LB培养基中37℃震荡培养,当菌液OD600nm达到0.6时,加入IPTG,使其在菌液中的终浓度为0.5 mmol/L,25℃诱导表达6 h。然后进行SDS-PAGE分析。
1.2.2 表达产物的Western blotting鉴定 将SDSPAGE凝胶电泳的蛋白带通过半干法转移至硝酸纤维膜上,5%脱脂奶粉配制的封闭液中,4℃封闭过夜,以封闭无关蛋白结合位点。一抗使用抗His标签鼠单克隆抗体、二抗为HRP-羊抗鼠IgG,进行Western blotting检测,使用DAB显色试剂盒显色。
1.2.3 重组蛋白的可溶性分析与纯化 收集10 mL诱导后的菌液沉淀,经PBS洗涤后重悬于10 mL PBS(pH8.0)中,加入溶菌酶至终浓度为1 mg/mL,冰浴30 min。冰浴后进行超声细胞破碎(350 W,工作2 s,间隙3 s,作用10 min),之后4℃10 000 r/min离心20 min,分别收集上清和沉淀,沉淀用等体积量的PBS溶解,SDS-PAGE电泳分析。按照His.Bind纯化试剂盒说明书,利用Ni2+树脂柱对原核表达的鸭IFN-α进行纯化。并利用紫外分光光度计对纯化的蛋白进行浓度的测定。
1.2.4 细胞病变抑制法测定IFN-α重组蛋白抗病毒活性 制备鸭胚成纤维细胞(DEF),待长成单层后每孔加入5×102、1×103、2×103、4×103、8×103、
1.6×104、3.2×104和6.4×104倍稀释的纯化后的鸭IFN-α 0.1 mL,每个稀释度设6孔平行样,37℃作用过夜,每孔加入100TCID50的剂量的水泡口炎病毒(vsv)感染细胞。同时设立病毒组、干扰素+病毒组、空白对照组,24-48 h内观察结果,在阳性对照孔出现75%以上病变时,判断结果。以能抑制50%细胞病变的样品的干扰素稀释度定义为一个单位干扰素。
1.2.5 荧光定量PCR方法检测 IFN-α重组蛋白抗病毒活性 试验分为3组:第1组正常生长细胞组;第2组NDV接种组(细胞接种NDV病毒);第3组保护组(加重组蛋白后再接种病毒)。将单层DEF细胞中的培养液去掉,第1、2组接入等量维持液,第3组加入10倍稀释的重组蛋白2 mL。过夜培养后,第2、3组接种100TCID50的NDV。在接毒的6 h、12 h、24 h和48 h,以Ffp、Frp检测引物,应用荧光定量RT-PCR方法检测DEF中NDV的含量;同时按照Reed-Muench两氏法测算病毒的滴度。反应完成后根据其Ct值,按标准曲线换算病毒核酸拷贝数来反映IFN-α重组蛋白抗NDV病毒的效果,用SPSS15软件进行数据分析,并计算相对抑制率:
相对抑制率(%)=(接种组病毒含量-保护组病毒含量)/接种组病毒含量×100%。
2 结果
2.1 重组质粒pET-32a-MaIFN-α的鉴定
重组质粒pET-32a-MaIFN-α经测序,结果显示插入的MaIFN-α基因大小、序列和开放阅读框架均正确无误,表明成功构建了pET 32a-MaIFN-α原核表达重组质粒。
2.2 重组鸭IFN-α融合蛋白的表达
pET-32a-MaIFN-α重组质粒转化E.coli BL21感受态细胞中经IPTG诱导表达后,SDS-PAGE分析(图1)显示出现了一条特异的蛋白质增强条带,大小约为39 kD,与预期结果一致,而空载体对照中并无此条带,由此说明重组鸭IFN-α融合蛋白成功表达。
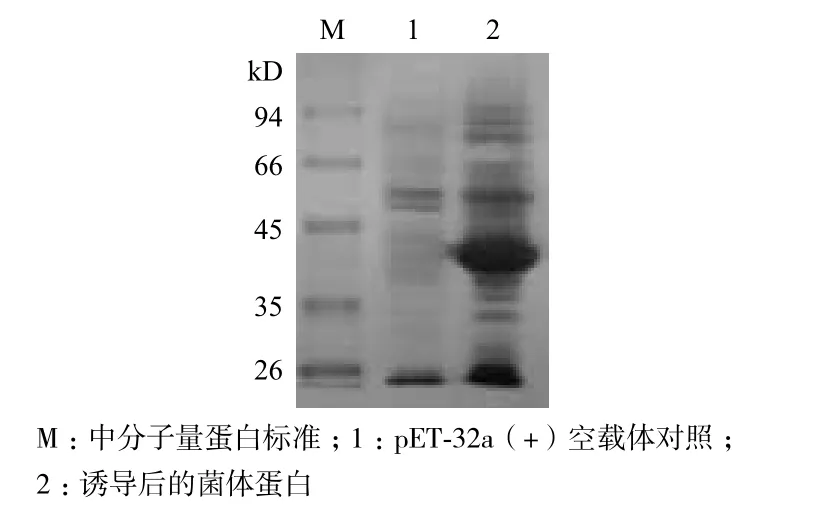
图1 表达重组蛋白的SDS-PAGE分析
2.3 表达产物的Western blotting鉴定
对pET-32a-MaIFN-α融合蛋白进行Western blotting分析,结果(图2)发现在分子量约为39 kD处出现一条特异条带,表明融合蛋白能与His标签鼠单克隆抗体发生特异免疫反应,具有良好的抗原性。

图2 表达重组蛋白的Western blotting分析
2.4 重组蛋白的可溶性分析和纯化
SDS-PAGE电泳分析显示破碎受体菌的上清和沉淀中均有目的蛋白表达,但沉淀中目的蛋白很少,而上清中的目的蛋白含量很多,经蛋白扫描系统分析,目的蛋白越占总蛋白的70%,可见该重组蛋白以可溶性表达为主。
表达的重组蛋白纯化后,经SDS-PAGE分析,结果(图3)显示在大小约为39 kD处可见一条清晰的蛋白带,经测定蛋白浓度约为0.98 mg/mL。
2.5 细胞病变抑制法测定IFN-α重组蛋白抗病毒活性
在重组鸭IFN-α样品进行500-4 000倍稀释的细胞孔中均未见细胞病变,而稀释倍数为8 000的细胞孔中有一半细胞孔出现了细胞病变,因此其抗病毒活性(U/mL)=1 U×抑制50%细胞病变的样品的干扰素稀释倍数/加入干扰素的体积(mL)= 1 U×8 000/0.1 mL=8×104U/mL。这表明表达的重组鸭IFN-α具有较好的抗病毒活性。
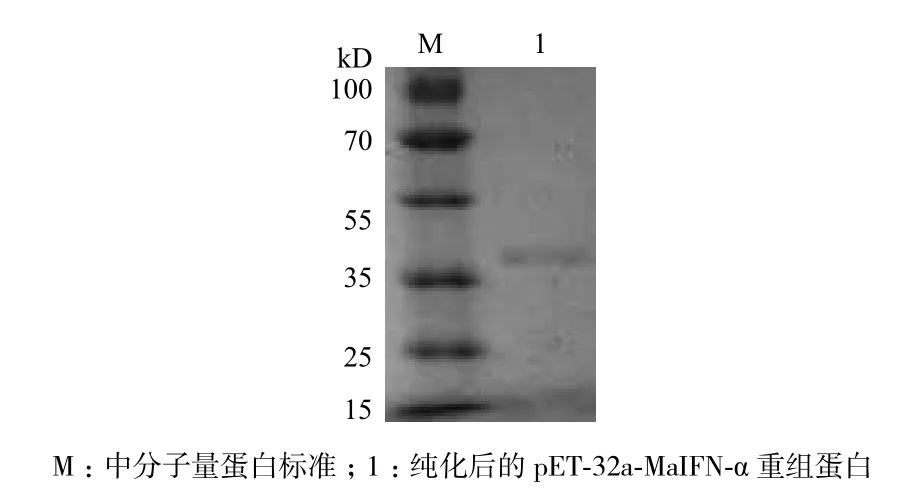
图3 表达重组蛋白的纯化
2.6 荧光定量PCR方法检测 IFN-α重组蛋白抗病毒活性
应用荧光定量PCR方法检测了各组不同时间点NDV的含量。结果(图4)显示,在接种NDV的12 h内,添加重组鸭IFN-α的保护组的病毒拷贝数和病毒接种组之间相比基本保持一致,两组的差异并不显著(P>0.05)。在24 h出现变化,两组的病毒拷贝数都有增加,但保护组的病毒拷贝数的增加数量明显低于病毒接种组,两组差异显著(P<0.05);在48 h两组的病毒拷贝数仍在增加,特别是病毒接种组的病毒拷贝数的数量级达107,相比而言保护组的病毒拷贝数增加不多,两组数据差异显著(P<0.05),在该时间点相对抑制率为91.0%而正常细胞组在各个时间点取样未检测到病毒核酸。
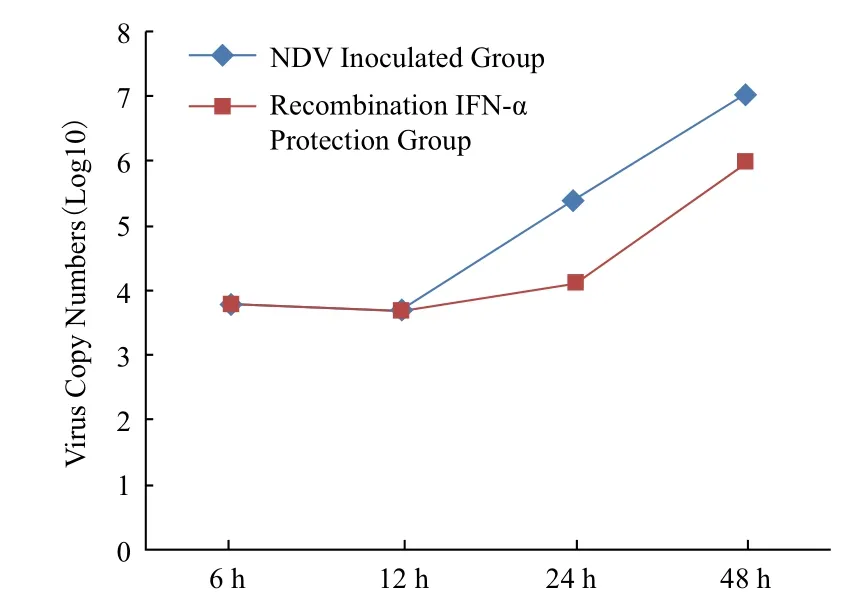
图4 NDV拷贝数动态变化的分析
病毒的滴度也呈现了相似的变化趋势,12 h以内两组病毒的滴度差异不大(P>0.05),24-48 h两组病毒的滴度差异比较明显(P<0.05),具体见表2。在48 h,病毒接种组细胞出现部分圆缩、坏死和脱落等细胞病变,而保护组的细胞基本维持正常形态,未见明显的细胞病变。这都表明表达的重组鸭IFN-α具有良好的抗病毒活性。
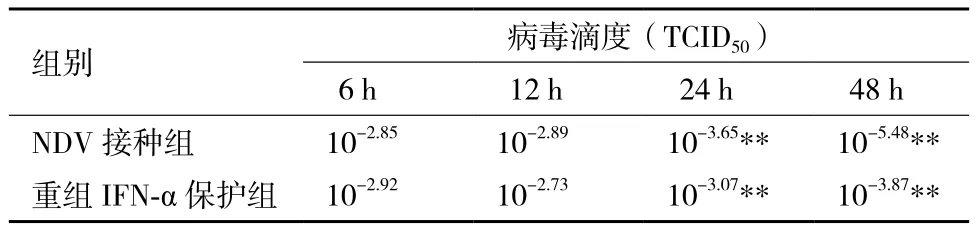
表2 NDV病毒滴度(TCID50)动态变化的分析
3 讨论
原核系统表达的干扰素的表达量较高,但多以包涵体形式存在,需要经过复性才能获得其生物活性。包涵体的复性是个费时、费力的过程,而且复性后的蛋白其生物活性通常不高。因此,选择合适的原核表达载体、优化表达条件来提高IFN-α的可溶性表达尤为重要。本研究中选择了pET-32a(+)这一高效表达载体,它能快速、高效和稳定地表达基因产物,成本低廉,适合应用于工业化批量生产。该载体表达的目的片段前融合有硫氧还蛋白,它有助于蛋白的折叠,提高可溶性蛋白的含量[10]。此外,研究中使用变温诱导表达的方法,即在加入IPTG后使用相对较低的温度(25℃)进行诱导表达,降低了表达产物形成包涵体的几率,结果表明目前蛋白绝大部分在处理细胞的上清中以可溶形式表达。这些都为重组鸭IFN-α的发酵生产奠定了良好基础。
在干扰素生物活性的检测方法中最经典的就是应用vsv/wish细胞系统通过细胞病变抑制试验方法来测定干扰素的抗病毒活性[11]。该方法需要滴定每个孔病毒的滴度,十分费时费力。此外,干扰素与其受体细胞间的结合具有种属特异性[12],因此评价不同的干扰素要选择不同的指示细胞,这也影响了评价系统的准确性。为了更好地测定表达的重组鸭IFN-α的生物活性,本研究在初步应用经典试验方法的基础上,应用荧光定量PCR的方法检测了IFN-α重组蛋白体外抗病毒的效果,不仅直观地反映干扰素对病毒复制的抑制效果,同时还能实时对病毒复制的抑制过程进行观察。
细胞病变抑制试验方法来测定重组鸭IFN-α的抗病毒活性约为8×104U/mL,明显高于一些研究中经过包涵体复性的重组鸭IFN-α[8,13]。荧光定量PCR方法检测重组鸭IFN-α的抗病毒活,从24-48 h
这段时间里,保护组由于表达的重组鸭IFN-α的作用,NDV在DEF上的复制受到了明显的抑制,相对抑制率高达91%,各组病毒滴度的动态变化结果也进一步验证了重组鸭IFN-α能有效抑制NDV的复制和增殖。这些都表明,本研究中所表达的重组鸭IFN-α具有良好的抗病毒活性,为今后的大规模的临床应用奠定了基础。
4 结论
本研究利用pET-32a原核表达系统,采用变温诱导的方法成功表达了可溶性的重组鸭IFN-α,经细胞病变抑制法和荧光定量PCR的方法检测,表达的重组鸭IFN-α具有良好抗病毒活性。
[1]Samuel CE. Antiviral actions of interferons[J]. Clin Microbiol Rev, 2001, 14(4):778-809.
[2]Pestka S, Langer JA, Zoon KC, et al. Interferons and their actions[J]. Annual Review of Biochemistry, 1987, 56(4):727-777.
[3]Clemens MJ. Interferons and apoptosis[J]. J Interferon Cytokine Res, 2002, 23(6):277-292.
[4]Vilcek J. Novel interferons[J]. Nat Immunol, 2003, 4(1):8-9.
[5]Schultz U, Kock J, Schlicht HJ, et al. Recombinant duck interferon: a new reagent for studying the mode of interferon action against hepatitis B virus[J]. Virology, 1995 , 212(2):641-649.
[6]夏春, 万建青, 吴志光, 等. 北京鸭1型干扰素基因分子克隆与序列分析[J]. 畜牧兽医学报, 2000, 31(6):567-570.
[7]王春霞, 王林川. 番鸭IFN-α基因的克隆与序列分析[J]. 华南农业大学学报, 2002, 23(4):68-70.
[8]叶伟成, 张存, 王一成, 等. 绍兴鸭α-干扰素基因克隆、表达及活性测定[J]. 浙江农业学报, 2005, 17(3):115-119.
[9]陈斌, 程安春, 汪铭书, 等. 麻鸭α干扰素基因克隆与序列分析[J]. 中国兽医学报, 2006, 26(4):401-404.
[10]Kang Y, Son MS, Hoang TT. One step engineering of T7-expression strains for protein production:increasing the host-range of the T7-expression system[J]. Protein Expr Purif, 2007, 55(2):325-3331.
[11]Pestka S, Meager A. Interferon standardization and designations[J]. J Interferon Cytokine Res, 1997, 17(Supp1.):S9-14.
[12]Billiau A. Interferon-gara:biology and role in pathogenesis[J]. Adv Immunol, 1996, 62:61-130.
[13]陈斌. 鸭α干扰素原(真)核表达及其生物学活性研究[D].雅安:四川农业大学, 2008.
(责任编辑 李楠)
Soluble Expression and Activity Analysis of Mallard IFN-α
Liu Lanlan1Zhuang Yanna2Yu Xiaohong1Zeng Xiangwei2
(1. College of Basic Medical Science,Heilongjiang University of Chinese Medicine,Harbin 150040;2. College of Wildlife Resources,Northeast Forestry University,Harbin 150040)
In order to acquire efficient expression and production of biologically active duck IFN-α, the mature protein gene of duck IFN-α was amplified from pMD18T-MaIFN-α. The fragment was linked to the prokaryotic expression vector pET-32a to construct the recombinant expression plasmids pET-32a(+)-MaIFN-α, and then converted into E.coli BL21 cells. The fusion protein was induced to express in the change temperature condition. SDS-PAGE and western blotting analysis were used to examine the fusion protein. After purified by Ni2+resin column, the activity of the expression product was determined. The results showed that the recombinant pET-32a(+)-MaIFN-α expressed a soluble protein after being induced by IPTG. Western blotting analysis showed the fusion protein had expected antigenicity. The activity of the expressed duck IFN-α detected by inhibiting cytopathic effect was about 8×104U/mL. The activity detected by the Real-time PCR showed that the expressed duck IFN-α had a strong inhibition of NDV replication in DEF. This indicated that the expressed duck IFN-α was verified to be of high antiviral activity.
Mallard IFN-α Soluble expression Activity analysis
2014-05-19
黑龙江省自然科学基金项目(C201223),黑龙江中医药大学校科研基金项目(BS201402)
刘澜澜,女,博士,讲师,研究方向:微生物与免疫;E-mail:lanlan0112@126.com
曾祥伟,男,博士,副教授,研究方向:病毒与免疫;E-mail:xiangwei_zeng@163.com

