胃蛋白酶中性蛋白酶水解酪蛋白的研究
王立晖,卢楠,李培骏
(1.现代职业技术学院,天津300350;2.河北化工医药职业技术学院,河北石家庄050026;3.温州质量技术监督检测院,浙江温州325000)
胃蛋白酶中性蛋白酶水解酪蛋白的研究
王立晖1,卢楠2,李培骏3
(1.现代职业技术学院,天津300350;2.河北化工医药职业技术学院,河北石家庄050026;3.温州质量技术监督检测院,浙江温州325000)
本实验主要研究双蛋白酶(胃蛋白酶-中性蛋白酶)催化酪蛋白水解的反应过程。实验中首先设计正交试验确定了中性蛋白酶和胃蛋白酶各自单独水解酪蛋白的最佳反应条件,分别为酶浓度0.6%、温度55℃、pH 8.0、底物浓度2%和酶浓度1.5%、温度55℃、pH 1.6、底物浓度10%。在此基础上以双蛋白酶作为催化剂水解酪蛋白的反应过程进行研究,并利用层析分离技术和液相色谱初步验证了水解产物中含有β-啡肽-7等多肽类物质。
酪蛋白;水解度;胃蛋白酶;中性蛋白酶;生物活性多肽
酪蛋白是乳制品中含量最高的蛋白质,是一种完全蛋白质,内含人体自身无法合成的全部的8种必需氨基酸,可以为生物体生长发育提供坚实的营养基础[1]。在适当蛋白酶的催化下,酪蛋白能够发生水解反应,生成众多具有独特生物活性和重要生理功能的多肽类物质,例如,酪蛋白磷酸肽具有防止矿物质流失、预防龋齿,防治骨质疏松与佝偻病,促进动物体外受精,调节血压,治疗缺铁性贫血等多种生理功效。因此,酪蛋白已被确认是未来用于开发新药物和新型功能性食品的重要原料物之一。
本实验分别研究了单蛋白酶与双蛋白酶催化酪蛋白水解的过程。首先采用正交试验法,分别确定了中性蛋白酶和胃蛋白酶单独水解酪蛋白的最佳反应条件,并在此基础上,进一步研究了双蛋白酶(中性蛋白酶与胃蛋白酶)水解酪蛋白的过程,并利用层析分离技术和高效液相色谱仪初步验证了水解产物中的多肽类物质的种类及含量。
1 材料与方法
1.1 实验材料
干酪素(食品级):徐州百顺生物科技有限公司;胃蛋白酶(EC 3.4.23.1):Sigma-Aldrich公司;中性蛋白酶:Novo公司;甲醛(分析纯):梯希爱(上海)化成工业发展有限公司;交联葡聚糖Sephadex G-15:Sigma-Aldrich公司;甲醇(色谱级):天津江天化工技术有限公司;乙腈(色谱级):国药集团化学试剂有限公司;β-酪啡肽-7(纯度98%):梯希爱(上海)化成工业发展有限公司;其余试剂纯度等级均为分析纯。
1.2 实验仪器
PHS-3C型pH计:上海伟业仪器厂;85-2B数显恒温磁力搅拌器:江苏省金坛市友联仪器研究所;BILONHW-10S水浴恒温振荡器:上海比朗仪器制造有限公司;DHG-06型电热恒温鼓风干燥箱:深圳市耐美特工业设备有限公司;FA3204B电子分析天平:上海精科天美贸易有限公司;HD-3紫外检测仪:美国热电有限公司;BT101S恒流泵:武汉恒流泵业制造有限公司;Centrifuge 5810R离心机:Sigma-Aldrich公司;Lyostar冻干机:新默真科技(北京)有限公司;Heto Hsc 500记录仪:丹麦Heto公司;QT超声波仪:天津市瑞普电子仪器公司;LC-2900型高效液相色谱仪:Sigma-Aldrich公司;LC-10AT液相流动泵:Sigma-Aldrich公司;SPD-10A型紫外-可见监测器:Sigma-Aldrich公司;2010色谱工作站数据处理系统:Sigma-Aldrich公司;7 52型(自动)紫外分光光度计:上海天普分析仪器有限公司;微孔过滤膜(0.45 nmφ50):天津大学科威公司。
1.3 实验方法
1.3.1 单酶催化水解酪蛋白
1)酪蛋白溶液(蛋白含量为0.785)配制
向85℃的NaOH(0.1mol/L,100mL)溶液中缓慢加入干酪素(酪蛋白),搅拌溶解,蒸馏水定容至250mL。调节温度和pH至蛋白酶的最适催化条件(来源于文献资料),恒温储藏待用。
2)水解反应
中取100mL酪蛋白溶液置于恒温振荡水浴锅中的锥形瓶,分别加入等量的蛋白酶(中性蛋白酶或胃蛋白酶)后开始水解反应,一段时间后,取出锥形瓶并立即倒入强碱液终止反应。
3)水解度的测定
水解度(Degree of Hydorlysis,DH)是指原料蛋白中肽键裂解的百分数,也表示蛋白质被水解的程度。由于蛋白质每断裂一个肽键就会生成一个-NH2和-COOH,因此只需要定量测定增加的-NH2和-COOH并通过计算即可求得该蛋白在反应中的水解度。
本实验中采用甲醛法进行酪蛋白水解度的测定,具体操作为:将终止反应后的反应液(10mL)与去二氧化碳蒸馏水(30mL)想混合,调节混合液pH到8.2后加入甲醛(10mL,pH 7.0)。1min后,用标准NaOH溶液滴定至pH 9.2,记录所用NaOH体积。以酪蛋白溶液为底物反应做空白试验。水解度的计算公式如下:
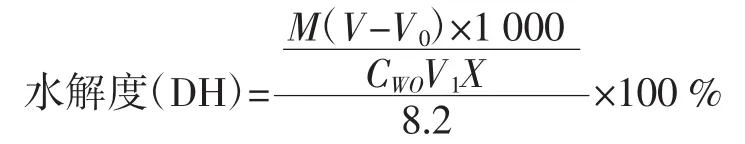
式中:M为NaOH溶液的浓度,(mol/L);V为水解液滴定时消耗的氢氧化钠溶液的体积,mL;V0为空白液滴定时消耗的氢氧化钠溶液的体积,mL;Cwo,V1为所取酪蛋白溶液的浓度,(mg/mL)和体积,mL;X为酪蛋白样品中蛋白质的含量;8.2为每克酪蛋白中所含的肽键数,(mmol/g)。
4)正交试验
选择实验中的反应温度,酪蛋白溶液pH,酪蛋白浓度,蛋白酶浓度等适当的因素水平,构建不同蛋白酶做催化剂的四因素三水平的L9(34)正交实验表。每组变量实验重复3次。研究不同反应条件对酪蛋白水解度的影响,并分析后确定各蛋白酶的最佳反应条件。
1.3.2 双蛋白酶催化水解酪蛋白
1)以中性蛋白酶水解酪蛋白的最佳反应条件为实验条件,在反应一段时间(60、90、120min)后,终止反应,取一定量的反应液检测酪蛋白的水解度。
2)以上一步得到的反应液为底物溶液,胃蛋白酶为催化剂,在该酶最佳催化条件下(酶浓度1.5%、温度55℃、PH 1.6)分别反应0.5、1.0、1.5、2.0、2.5 h,取出反应液并终止反应,测定此时酪蛋白的水解度。
1.3.3 酪蛋白水解产物的定性研究
1)以交联葡聚糖作为层析柱填充物,用水溶胀后填入φ17 cm的层析柱中,确保压实后柱中填充物高度为57.5 cm。用3倍柱床体积的缓冲液洗脱柱子。
2)将水解样品经过离心、过滤、浓缩等初步提纯后,将反应液用制得的层析柱分离,收集目标流出物,冷冻干燥得到水解产物。
1.3.4 RP-HPLC检测酪蛋白水解产物
1)通过查询资料可知,酪蛋白水解后得到产物为多肽链(5个~10个氨基酸组成的具有生物活性的多肽类物质),平均长度可用公式[4]计算得出。

2)本实验中以其中一种典型的七肽,即脑啡肽中的β-酪啡肽-7作为主要研究对象进行分析检测。张源淑[5]的研究介绍了利用反相高效液相色谱仪(RPHPLC)对β-酪啡肽-7进行检测的操作条件,通过这个方法能够实现验证组合酶水解酪蛋白得到的反应液中是否含有β-酪啡肽-7等生物活性多肽类物质。
3)准确称取2.65mgβ-酪啡肽-7标准样,用甲醇溶解并定容至5mL,溶解时可用超声波仪助溶。取标准品溶液(10μL)用液相色谱仪进行定性检测,色谱检测条件为色谱柱:SHIM-PACK VP-ODSC18;检测波长:215 nm,柱温40℃,柱压9.6MP;乙腈∶水=20∶80作为流动相,流速为1mL/min。重复多次检测,以确保结果的准确性。检测过程中溶剂在使用前需要用微孔滤膜过滤以及超声波仪脱气处理。
4)准确称取一定数量反应液提纯物,用甲醇溶解并定容至5mL,超声波仪助溶,在上述条件下用液相色谱仪进行检测样品液,观察出峰情况。
2 结果与分析
2.1 单蛋白酶催化水解酪蛋白
2.1.1 中性蛋白酶催化水解酪蛋白反应分析
在不同反应条件下,以中性蛋白酶作为催化剂催化酪蛋白水解0.5 h,重复3次实验,构建L9(34)正交试验(表1),不同反应条件下的水解度结果如表2所示。对正交试验结果进行数据分析(表3)可知,4个变量因素(反应温度,酪蛋白溶液pH,酪蛋白浓度,反应液中酶浓度)中显著性的显著程度为:酪蛋白溶液pH(D)<反应温度(C)<酪蛋白浓度(A)<反应液中酶浓度(B),从而确定四因素水平的最佳组合方式为:A2B3C2D3,即中性蛋白酶催化水解酪蛋白的最佳反应条件为:0.6%酶浓度、2%酪蛋白浓度、55℃反应温度、酪蛋白溶液pH 8.0。
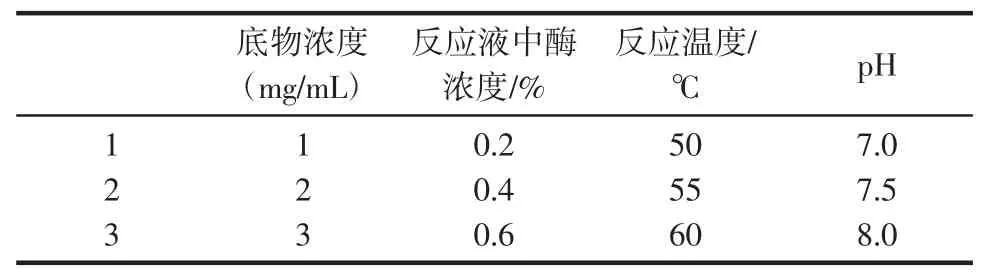
表1 L9(34)正交试验因素表Table1 Levelsof factorsof orthogonal test L9(34)
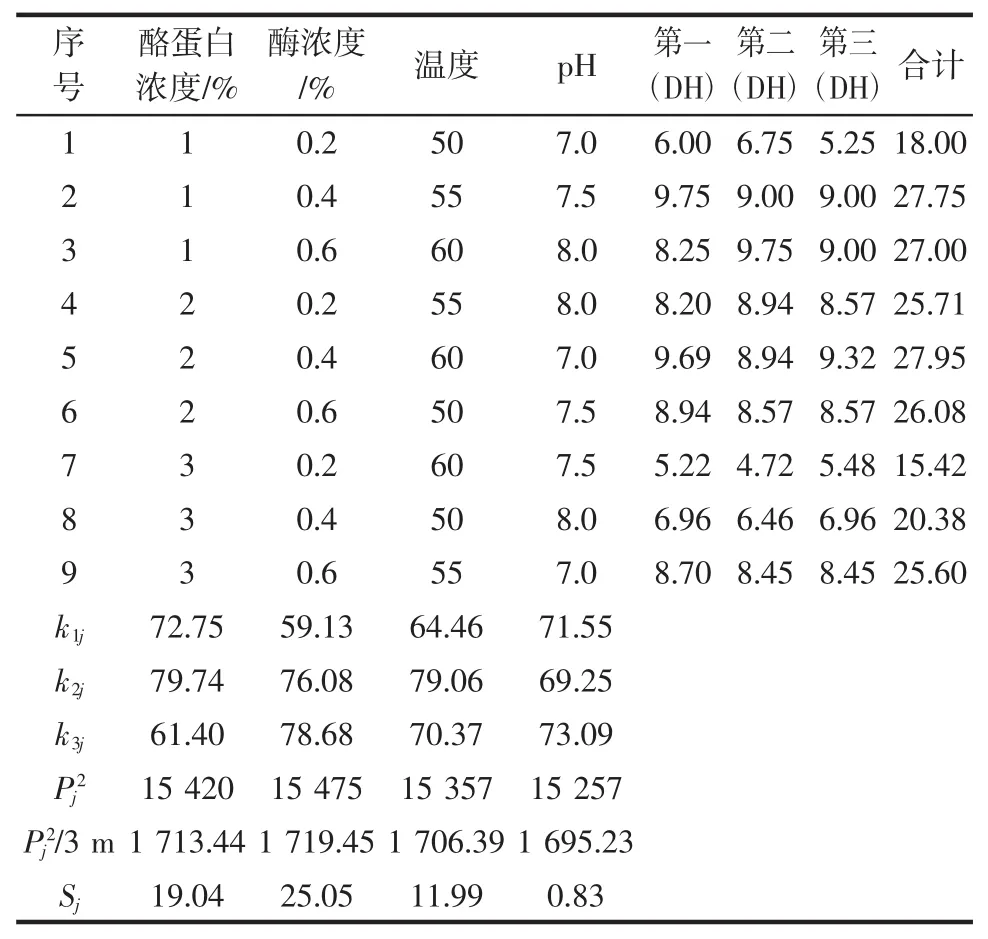
表2 L9(34)正交试验结果Table2 Resultsof orthogonal test L9(34)
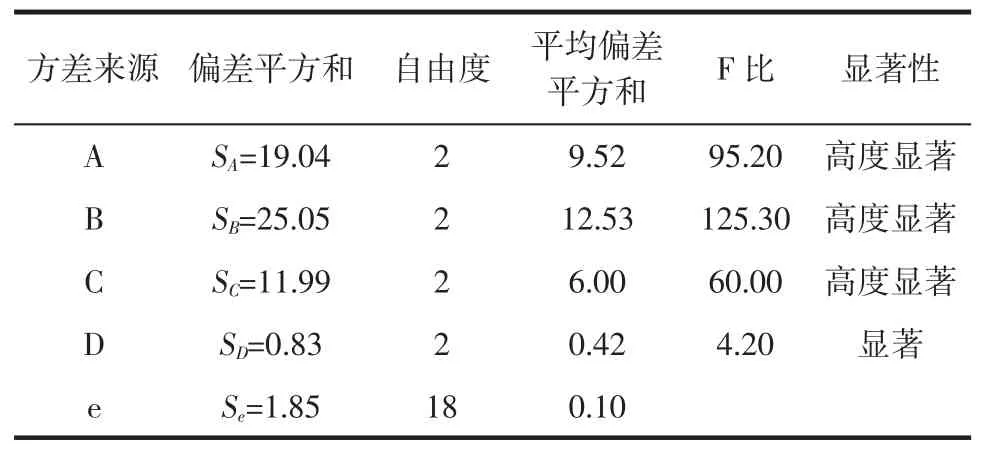
表3 L9(34)正交试验数据分析表Table3 Datasheet AMalysisof of orthogonal test L9(34)
2.1.2 胃蛋白酶催化水解酪蛋白反应分析
在不同反应条件下,以中性蛋白酶作为催化剂催化酪蛋白水解2 h,重复3次实验,构建L9(34)正交实验(表4),不同反应条件下的水解度结果如表5所示。
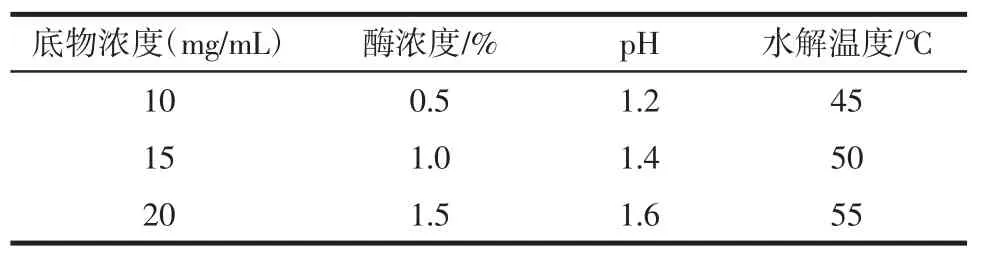
表4 L9(34)正交试验因素表Table4 Levelsof factorsof orthogonal test L9(34)
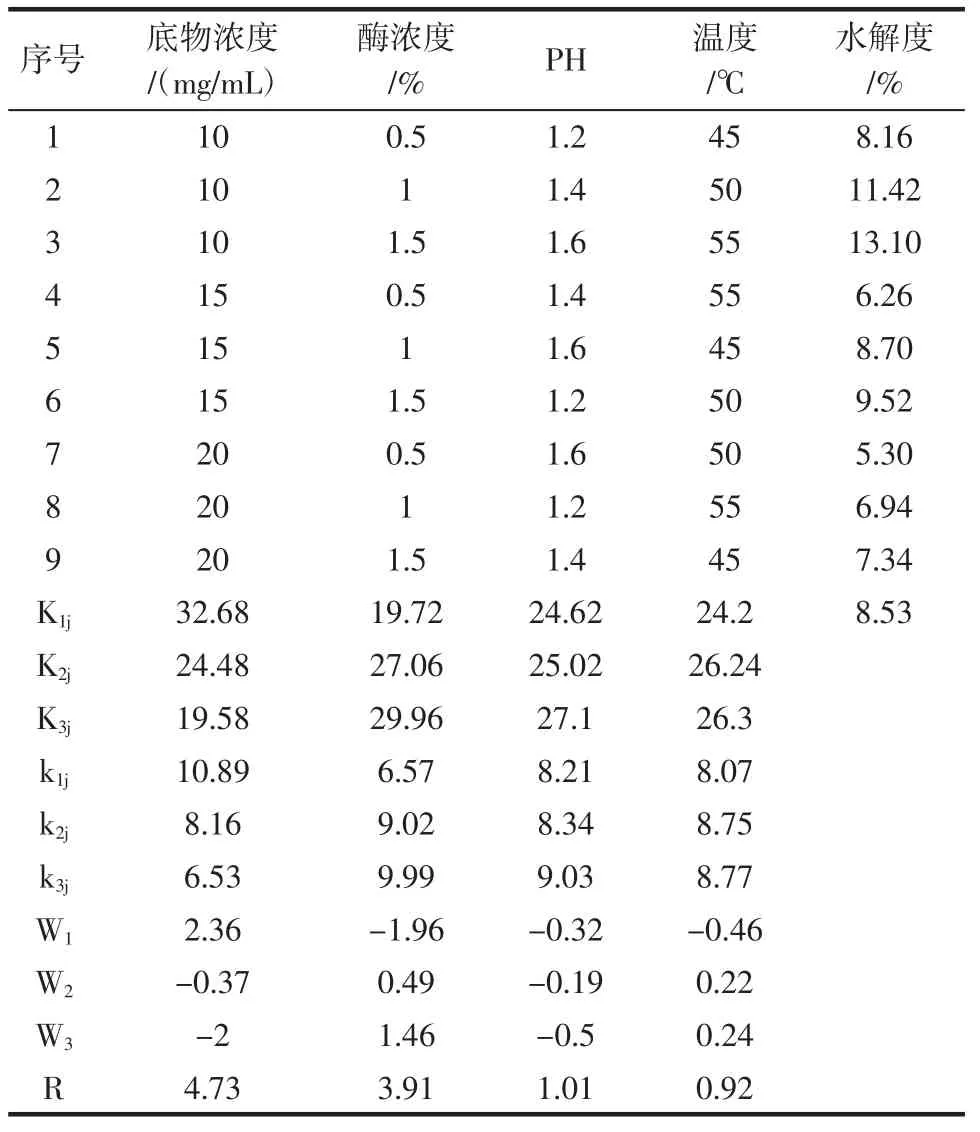
表5 L9(34)正交试验结果Table5 Resultsoforthogonal test L9(34)
通过方差分析,确定正交试验中4个因素的显著性顺序为:反应温度(D)<酪蛋白溶液pH(C)<反应液中酶浓度(B)<酪蛋白浓度(A),最佳因素组合为A1B3C3D3,估计实验数值为y=8.53+2.36+1.46+0.5+ 0.24=13.10。以实验和数据分析结果为基础,结合需要的最佳水解度值和成本因素,最终确定胃蛋白酶催化酪蛋白水解的最佳反应条件为:酪蛋白浓度10mg/mL,反应液中酶浓度1.5%;反应液pH 1.6,反应温度55℃。
2.2 双蛋白酶催化水解酪蛋白的反应分析
以双蛋白酶(中性蛋白酶-胃蛋白酶)作为催化剂,不同反应时间条件下,水解酪蛋白结果如表6所示。
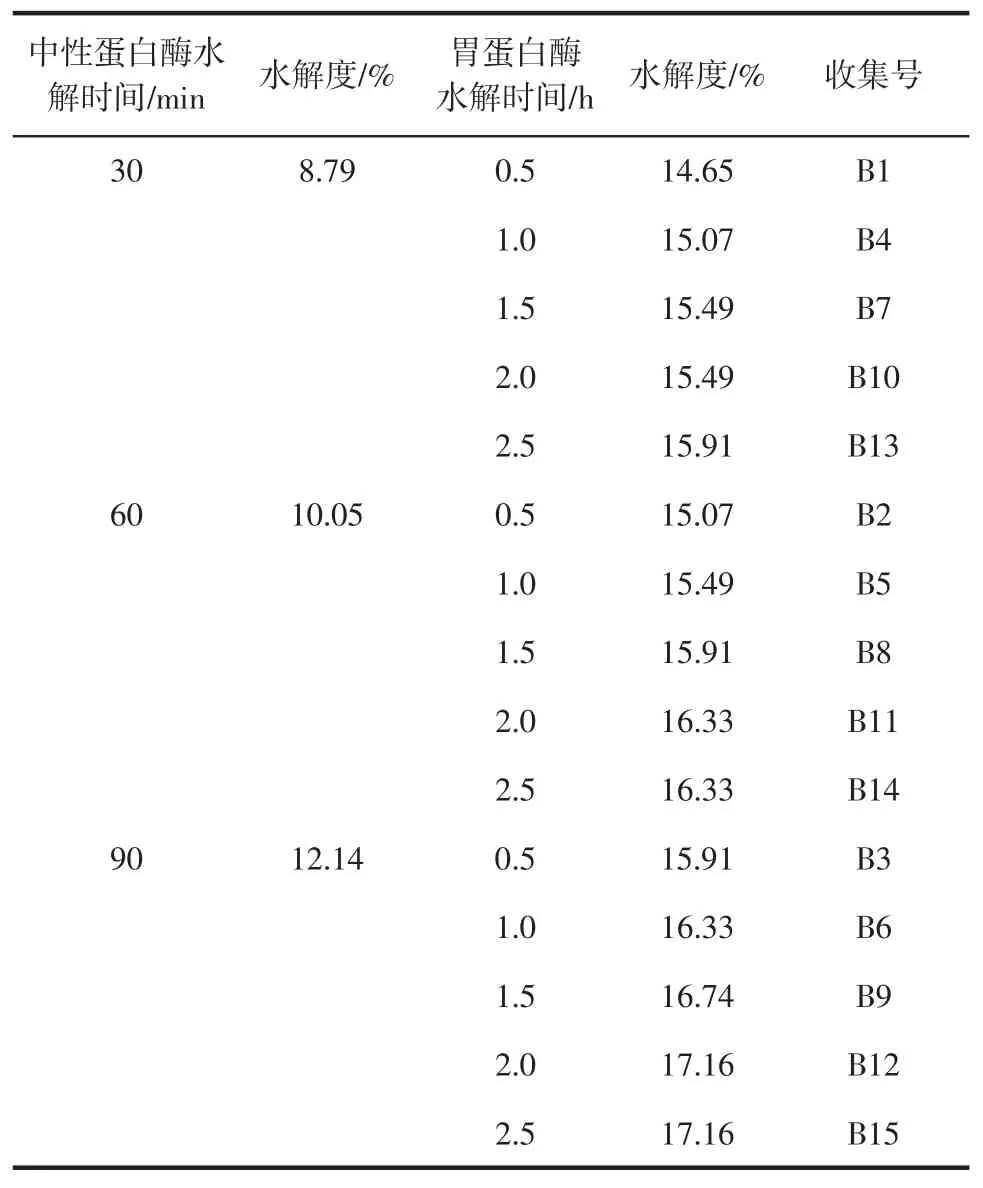
表6 双酶催化水解酪蛋白的结果Table6 Hyd rolysis resultsof casein catalyzed by doubleenzyme
从表6中结果可知,相比单一蛋白酶作为催化剂水解酪蛋白,双酶体系可以取得更佳的水解效果。随着中性蛋白酶催化时间的增加,最终得到的酪蛋白水解度也随之增加,并且水解度明显优于单酶的水解结果。
综上所述,双蛋白酶水解酪蛋白的最佳反应条件为:中性蛋白酶水解30min后,胃蛋白酶水解2.5 h。并以此条件作为下一阶段实验的反应条件,从而对水解产物进行研究。
2.3 酪蛋白水解产物的定性研究
2.3.1 水解产物的层析分离结果
双酶催化酪蛋白水解反应中的B13水解液经分离和提纯。将不同时间的流出液进行吸光度检测,通过对比酪蛋白空白曲线图和B13水解液的吸光度-洗脱峰的曲线(图1和图2)可以清晰证明,水解反应后有新的物质产生。
2.3.2 水解产物组分的标准品的色谱分析
2.3.2.1 β-啡肽-7标准物的色谱分析
利用反相高效液相色谱仪对β-啡肽-7标准品进行色谱分析,结果如图3所示。
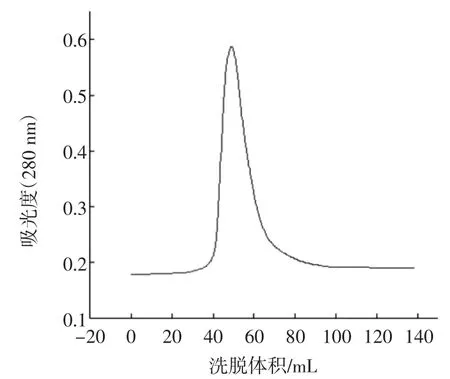
图1 酪蛋白空白Fig.1 Casein
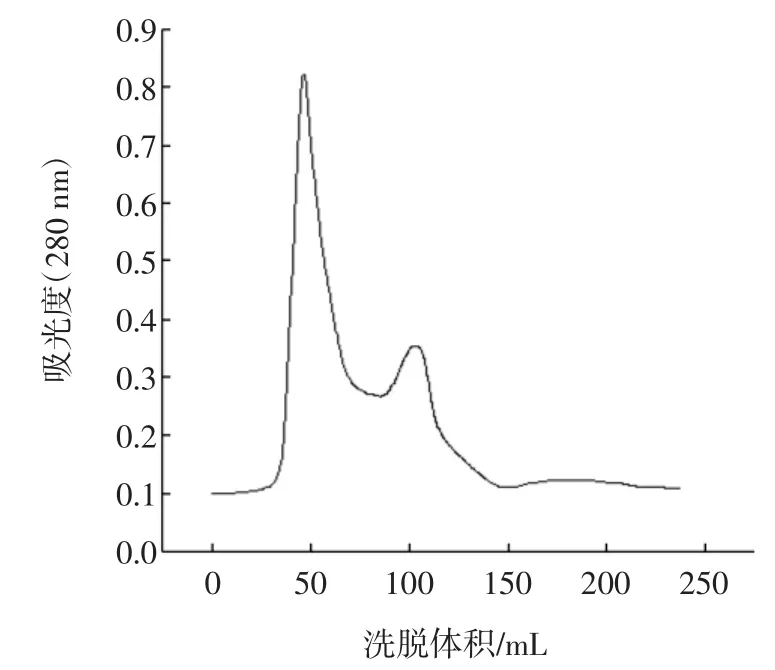
图2 双酶水解液Fig.2 Subtilisin-pepsin hydrolyte
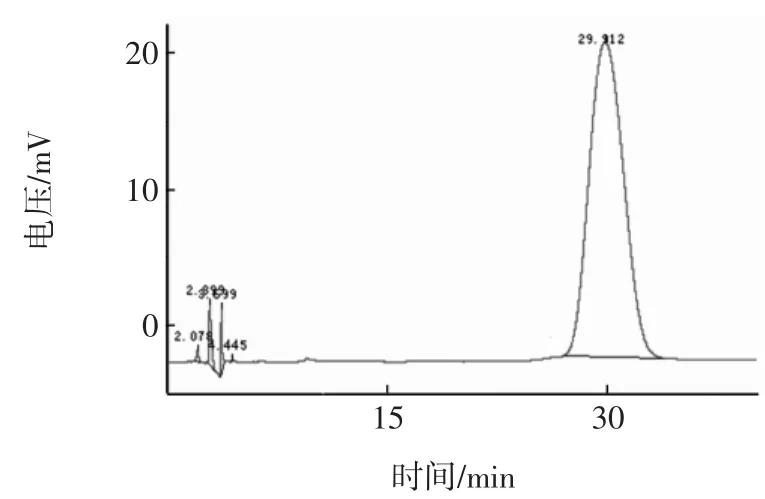
图3 β-啡肽-7标准品色谱分析图Fig.3 ChroMatograManalysis figureofβ-啡肽-7
从图中可以看出β-啡肽-7特征峰的保留时间是29.912min,峰面积为7 584 300.5,峰高度是327.534,含量为0.977 8%。
2.3.2.2 样品B13的液相色谱检测
利用反相高效液相色谱仪对水解度为15.91%的B13样品的提纯物进行检测分析,并将结果与β-啡肽-7标准样的特征峰进行比对,实验结果及数据记录如图4和表7。
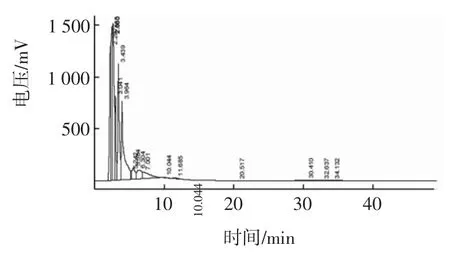
图4 中性蛋白酶-胃蛋白酶组合中目标峰的检测结果Fig.4 Subtilisin-pepsin coMbination HPLC detection results
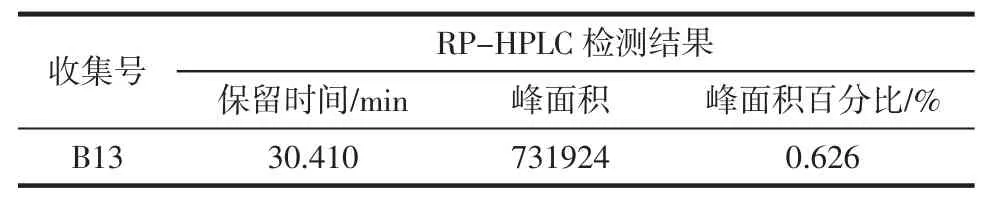
表7 RP-HPLC检测结果Table7 Resultsof RP-HPLC
检测结果证实由双蛋白酶催化酪蛋白反应得到的水解物中含有β-酪啡肽-7等生物活性多肽。
3 讨论与结论
本实验主要研究双蛋白酶(中性蛋白酶-胃蛋白酶)催化酪蛋白水解的反应过程。实验中首先设计正交试验确定了中性蛋白酶和胃蛋白酶各自单独水解酪蛋白的最佳反应条件,分别为酶浓度0.6%、底物浓度2%、温度55℃、pH 8.0和酶浓度0.15%、温度55℃、pH 7.5、底物浓度6%。在此基础上以双蛋白酶作为催化剂水解酪蛋白的反应过程进行研究,并利用层析分离技术和液相色谱初步验证了水解产物中含有β-啡肽-7(保留时间30.410min、峰面积731 924、峰面积百分比(%)0.626)。
酶解酪蛋白是蛋白质研究领域中的热门方向,各种酪蛋白的酶解方法、水解产物的提纯和检测手段也越来越受国内外学者的重视,尤其是对水解产物中所含的生物活性肽的研究,不仅扩展了食物蛋白的应用范围,也为动物学、营养学、生物医药以及食品科学等学科的发展提供了一个新的思路。我们能够相信,在功能食品和饲料添加剂制造领域中,生物活性多肽的发展前景是非常广阔的。
[1]邹思湘.酪蛋白源活性肽[J].生命的科学,1993,13(1):18
[2]林立.酶促水解反应的实验和优化[D].华东理工大学硕士学位论文,2001:18-19
[3]Brantl V,Teschemacher H,Henschen A.Novel opioid peptides derived froMcasein(β-casomorphins)[J].I.Isolation froMbovine casein peptone.Hoppe~Seyler's ZPhysiolChem,1979,360:1211-6
[4]J.Adler Nissen.Enzymatic hydrolysisof food proteins[M].New York, Elsevier Appl.Sci.Pub:1986
[5]张源淑,邹思湘.反相高效液相色谱法分析结构相似酪啡肽[J].食品科学2005,26(2):172-174
Reseach on the Hydrolytic Course froMCasein w ith Pepsin and Subtilisin
WANGLi-hui1,LUNan2,LIPei-Jun3
(1.Tianjin Modern Vocation Technology College,Tianjin 300350,China;2.HebeiChemicaland Pharmaceutical Vocational Technology College,Shijiazhuang050026,Hebei,China;3.Wenzhou Instiute of Technology and Calibration,Wenzhou 325000,Zhejiang,China)
The focus of the experiment is reseach on the hydrolytic course froMcasein with double enzymes(pepsin and subtilisin).Firstly,thebest testconditionsof casein hydrolysate catalyzed were obtained by dispase or pepsin according to the results of orthogonal tests which were designed firstl.the optimistic conditions for dispase or pepsinwere as follow:enzyme concentration 0.6%,temprature 55℃,pH 8.0,substrate concentration 2%and enzyme concentration 1.5%,temprature 55℃,pH 1.6,substrate concentration 10%.Subsequently,reseachon thehydrolytic coursecatalyzed bysubtilisin-pepsinwascarried and thehydrolysateconteinsβ-CM-7 biologicalactivitypeptidesidentified by chromatographyand RP-HPLC.
casein;degree ofhydrolysis;pepsin;dispase;biologicalactivity peptides
10.3969/j.issn.1005-6521.2014.18.099
2014-09-24
王立晖(1981—),男(汉),副教授,硕士,研究方向:食品生物技术。

