诱导性多能干细胞与肾脏再生
刘 熹 综述 余 晨 审校
急性肾损伤和慢性肾脏病发病率逐年升高,患者进展至终末期肾病需维持性透析治疗,其病死率高,且加重社会负担。肾脏移植存在器官短缺、免疫排斥反应等问题,故需寻找更好的治疗方法。诱导性多能干细胞(iPSC)可定向分化为肾系细胞,参与肾脏损伤后的修复,且其来源于体细胞,取材简便,无明显免疫排斥反应,避免伦理学争议,因而在肾脏再生领域最具发展前景。
干细胞分类及比较
干细胞是一类具有高度增殖和多系分化能力的细胞。干细胞根据分化潜能大小分为多能干细胞和多功能成体干细胞(图1)[1]。多能干细胞包括胚胎干细胞(ESC)和iPSC,可分化为内、中、外三胚层细胞。多功能成体干细胞包括间充质干细胞(MSC)、造血干细胞(HSC)和生殖细胞。获取ESC需毁损胚胎,细胞来源受限,体内注射可致畸胎瘤。MSC及HSC体外培养、扩增相对容易,但其分化潜能较ESC和iPSC减弱。
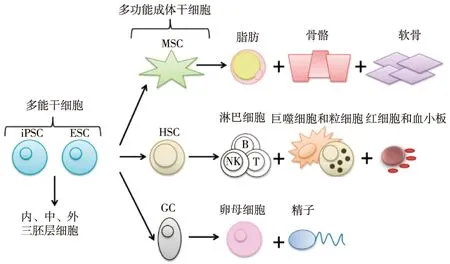
图1 干细胞种类及分化潜能[1]
iPSC的产生及鉴定
2006年,Yamnaka研究小组从24个候选基因中筛选出四个基因:Oct4、Sox2、c-Myc和Klf4,应用逆转录病毒将这4个基因的cDNA导入小鼠成纤维细胞,转染后的成纤维细胞在ESC培养环境中生长成胚胎干细胞样集落,并表达ESC绝大部分标志基因,移植入裸鼠皮下可形成畸胎瘤,具有内、中、外三胚层细胞特征,植入胚泡可形成小鼠胚胎,因此被命名为iPSC[2]。2007年,该小组应用相同的转录因子将人类皮肤成纤维细胞诱导为iPSC[3]。iPSC体积小,核/质比高,细胞排列紧密,表达ESC内源性基因Oct4,Sox2,Nanog,Lin28,DPPA4,同时表达ESC标志性抗原,如肿瘤识别抗原TRA-1-81、TRA-1-60,阶段特异性胚胎抗原SSEA3和SSEA4,其DNA甲基化模式及组蛋白修饰情况与ESC相似。2009年,我国科学家利用iPSC通过四倍体囊胚注射技术得到存活并具有繁殖能力的小鼠,证明iPSC与ESC一样具有相同的分化潜能[4]。
多能干细胞诱导技术进展
自iPSC产生后,诱导技术不断改进,在诱导因子方面,c-Myc和Klf4与肿瘤发生相关, 研究发现L-Myc较c-Myc诱导效率高,肿瘤形成风险低[5]。2008年,Kim等[6]用Oct4联合Klf4或c-Myc将神经干细胞诱导为iPSC;2009年,该研究组仅用Oct4一种转录因子即将神经干细胞诱导为iPSC[7]。用Oct4,Sox2两种转录因子,转染人类近端肾小管上皮细胞,13d后可得到iPSC,其上皮细胞标志抗原CD13表达下调,肾脏祖细胞标志抗原CD10、CD133、CD24持续表达,其他干细胞基因的表达与胚胎干细胞相同[8]。目前认为,c-Myc启动了体细胞重编程,与重编程效率相关,在体细胞向干细胞转变的过程中,只有Oct4是唯一必需的诱导因子。与普通体细胞相比,成体干细胞诱导效率更高,需要插入的诱导因子少。在诱导载体方面,逆转录病毒转染效率高,但随机插入宿主基因存在激活原癌基因风险,目前采用质粒[9]、Piggy转座子[10]等非整合型载体同样可成功诱导多能干细胞。
iPSC诱导效率低制约其临床应用,最初体细胞重编程效率仅0.001%~0.01%。抑制或增强某些信号通路、改变诱导环境等均可提高诱导效率,如添加组蛋白去乙酰化酶抑制剂[11]、Wnt信号通路激活剂[12]、转化生长因子β(TGF-β)信号通路抑制剂[13]、维生素C[14]及骨形态发生蛋白[15]等。将iPSC培养环境中的氧浓度从21%降到5%,诱导效率可提高2.5~4.2倍,进一步降低氧浓度到1%,则会导致部分细胞死亡[16]。在诱导过程中调节miRNA-302的水平,增强细胞整体去甲基化水平,也可提高诱导效率[17]。
肾脏损伤的修复再生机制
传统观点认为肾脏是不可再生的器官,胚胎36周后即无新的肾单位形成[18]。在肾脏包囊壁层上皮细胞中存在CD133+CD24+肾脏祖细胞[19],当肾脏损伤时,MSC、HSC自骨髓归巢至肾脏,与肾脏祖细胞及少量停留在G1期的肾小管上皮细胞一起参与损伤后修复再生。这些细胞一方面直接分化为足细胞、肾小管上皮细胞等参与修复,另一方面调节炎症因子白细胞介素1β(IL-1β),肿瘤坏死因子α(TNF-α),γ干扰素(IFN-γ)和抗炎因子IL-10、成纤维细胞生长因子(FGF)、TGF-α和B淋巴细胞瘤2蛋白(Bcl-2)的分泌来减轻局部炎症反应,促进肾脏再生修复。在肾脏损伤动物模型中,移植外源性干细胞也可促进肾脏修复。外源性干细胞可通过尾静脉、颈动脉、肾动脉及肾皮质局部注射等方式移植至体内,治疗效果报道不一,总体来说通过肾动脉和肾皮质直接注射技术,干细胞肾脏归巢率高,但局部损伤大,通过颈动脉、尾静脉等途径注射则干细胞归巢率低,但易于操作。
iPSC促进肾脏再生策略
异体肾脏移植技术成熟,但供体匮乏。由于肾脏结构复杂,利用自体细胞进行完整器官克隆尚未取得成功。目前临床上最普遍的是肾功能部分受损,仍残存有功能的肾单位,对于这部分患者,研究主要集中在将体外扩增的iPSC先定向分化为特定的肾系细胞,再移植入体内,在原有肾脏结构中进行细胞和功能修复(图2)[20]。

图2 诱导性多能干细胞诱导及分化示意图[20]
肾系细胞诱导为iPSC人体绝大多数体细胞均可诱导为多能干细胞,iPSC具有一定的记忆功能,倾向于分化为其最初来源的细胞[21],因此将肾系细胞诱导为多能干细胞,更有利于修复肾脏损伤。Song等[22]用逆转录病毒转染OCT4、SOX2、c-MYC和KLF4至成年男性肾脏系膜细胞,12d后这些系膜细胞与ESC形态相似,高表达碱性磷酸酶,并表达OCT4、肿瘤识别抗原TRA-1-60、TRA-1-81。将这些未分化的肾脏源性iPSC注入免疫缺陷小鼠中,可形成畸胎瘤。我国Wang等[23]将载有Oct4,Sox2,c-Myc 和 Klf4四种转录因子的慢病毒转染2天龄C57BL/6幼鼠肾小管上皮细胞,21d后转染成功的肾小管上皮细胞表现出ESC形态,并表达c-Myc、FGF-4、阶段特异性胚胎抗原1、端粒酶逆转录酶基因、NANOG、Oct4、Sox2和REX-1,在体外经诱导可分化为内、中、外胚层细胞[23]。获取肾脏固有细胞用于诱导多能干细胞常需要进行有创操作,增加了治疗难度。Zhou等[24]收集人尿液中脱落的肾小管上皮细胞,应用病毒转染的方法得到iPSC,具有简便、经济、无创、诱导效率高及成功率高的优点,提示尿液中脱落的肾脏细胞是iPSC的理想来源。
iPSC向肾系细胞定向分化肾脏损伤涉及足细胞、系膜细胞、肾小管上皮细胞等多种细胞,将iPSC定向分化为特定类型的肾系细胞,可直接参与修复肾脏损伤。胚胎期肾脏发育经历前肾、中肾、后肾三个阶段,后肾由输尿管芽、生后肾间充质组织及基质细胞组成,这些细胞在一系列诱导信号分子作用下发生复杂的间充质细胞向上皮组织转化。在肾脏发育过程中,有4个基因至关重要,分别是威尔氏瘤抑制基因(WT-1),Adrenalmarker,Rennin和Kallikrein。WT-1在早期肾脏生成中起核心作用,介导间充质细胞向上皮细胞转化[25]。肾脏发育还涉及MYC、活性氧类(ROS)、同源盒基因(HOX)、PAX等基因及表皮生长因子(EGF)、TGF-α、肝细胞生长因子(HGF)、骨形态发生蛋白7(BMP-7)等表达,在iPSC的分化过程中加入这些调节因子,可定向诱导其向特殊肾系细胞分化。
Song等[26]在培养基中加入激活素A、维甲酸和BMP-7,成功将肾脏系膜细胞来源的iPSC诱导分化为类足细胞样细胞[26]。这些类足细胞样细胞具有正常足细胞形态,表达裂隙膜蛋白和突触极蛋白,并具有增殖潜能。Araoka等[27]应用小分子糖原合成酶激酶3抑制剂CHIR99021和维甲酸受体拮抗剂AM580诱导人iPSC分化为中胚层肾源性细胞,可明显提高诱导率(达80%),同时缩短诱导时间至5d。这些中胚层肾源性细胞可分化为多种肾脏细胞,并形成肾小管样结构。Morizane等[28]比较了小鼠ESC和纤维母细胞来源的iPSC定向分化为肾系细胞,研究提示iPSC和ESC均可分化为成熟肾小管上皮细胞和足细胞,其中iPSC诱导效率及速度低于ESC,但iPSC具有保持多能性的倾向,激活素具有促进ESC和iPSC定向分化为肾小管样细胞的作用。总之,iPSC具有明确的分化为肾系细胞的潜能,但是由iPSC定向分化为某一种特定的肾脏细胞目前缺乏统一的诱导分化标准,且分化而来的肾脏细胞功能与成熟肾脏细胞相比仍差距。
iPSC在肾脏损伤动物模型中的应用iPSC对肾脏急性缺血再灌注损伤及慢性间质纤维化均具有修复再生作用。Lee等[29]将iPSC通过肾内动脉显微注射到缺血再灌注急性肾损伤大鼠体内发现,iPSC减轻了肾脏病理损伤程度,改善肾功能,显著降低了病死率;该研究还观察到iPSC具有减轻氧化应激、抗炎及抗凋亡效应。将常染色体显性多囊肾病患者体细胞诱导为iPSC,再在这些细胞中筛选发生自发基因修复的iPSC,用于治疗多囊肾病,结果观察到携带有PKD1+/R+的iPSC的成年嵌合体小鼠中囊肿形成的概率明显低于携带有近亲PKD1+/-的iPSC的成年嵌合体小鼠,且与野生型鼠比较无统计学差异[30]。然而目前iPSC治疗肾脏疾病研究局限于小样本观察性研究,其修复再生作用尚待进一步验证,修复再生机制仍不明确。
iPSC免疫原性研究
理论上讲,体细胞来源的iPSC用于自体移植不存在免疫排斥反应。然而,目前缺乏统一稳定的体细胞重编程及再分化体系,iPSC在诱导分化过程中其人类组织相容性抗原(HLA)是否会发生变化,引发免疫排斥反应尚无定论。2011年《Nature》发表论文,将C57BL/6鼠成纤维细胞来源的iPSC与C57BL/6鼠的ESC移植至C57BL/6鼠体内,iPSC引发了免疫排斥反应,无法形成正常的畸胎瘤组织,而ESC则未引起免疫排斥,形成了正常的畸胎瘤。通过全基因组表达谱分析,iPSC形成的不正常的畸胎瘤组织免疫相关基因Hormad1和Zg16过表达,导致iPSC免疫原性的改变[31]。2013年《Nature》再次发表论文,将iPSC定向诱导为皮肤和骨髓组织后再移植至C57BL/6鼠体内,结果显示分化后的iPSC中Hormad1和Zg16并无过表达现象,且未引起免疫排斥反应[32]。iPSC自体移植费时费力,贻误治疗时机,构建不同HLA表型的iPSC库进行异体移植具有广阔的应用前景。
小结:我国慢性肾脏病发病率约10%,迄今仍无有效的方法逆转疾病进展,iPSC是较为理想的肾脏再生资源。然而iPSC诱导及再分化机制仍未阐明,缺乏统一的技术规范。iPSC诱导过程中涉及转录因子激活和病毒基因随机插入,染色质处于不稳定状态,具有较大致瘤风险,安全性尚无保证。此外,目前动物实验中iPSC移植方式及时机缺乏高质量的随机对照试验,已有数据局限于小样本观察性研究,距离其临床应用还有大量工作需要论证。
1Temkin AM,Spyropoulos DD.Induced pluripotent stem cell technology and aquatic animal species.Comp Biochem Physiol C Toxicol Pharmacol,2014,163:3-13.
2Takahashi K,Yamanaka S.Induction of pluripotent stem cells from mouse embryonic and adult fibroblast cultures by defined factors.Cell,2006,126(4):663-676.
3Takahashi K,Tanabe K,Ohnuki M,et al.Induction of pluripotent stem cells from adult human fibroblasts by defined factors.Cell,2007,131(5):861-872.
4Zhao XY,Li W,Lv Z,et al.iPS cells produce viable mice through tetraploid complementation.Nature,2009,461(7260):86-90.
5Nakagawa M,Takizawa N,Narita M,et al.Promotion of direct reprogramming by transformation-deficient Myc.Proc Natl Acad Sci U S A,2010,107(32):14152-14157.
6Kim JB,Zaehres H,Wu G,et al.Pluripotent stem cells induced from adult neural stem cells by reprogramming with two factors.Nature,2008,454(7204):646-650.
7Kim JB,Zaehres H,Araúzo-Bravo MJ,et al.Oct4-induced pluripotency in adult neural stem cells.Cell,2009,136(3):411-419.
8Montserrat N,Ramírez-Bajo MJ,Xia Y,et al.Generation of induced pluripotent stem cells from human renal proximal tubular cells with only two transcription factors, OCT4 and SOX2.J Biol Chem,2012,287(29):24131-24138.
9Stadtfeld M,Nagaya M,Utikal J,et al.Induced pluripotent stem cells generated without viral integration.Science,2008,322(5903):945-949.
10 Woltjen K,Michael IP,Mohseni P,et al.piggyBac transposition reprograms fibroblasts to induced pluripotent stem cells.Nature,2009,458(7239):766-770.
11 Huangfu D,Maehr R,Guo W,et al.Induction of pluripotent stem cells by defined factors is greatly improved by small-molecule compounds.Nat Biotech,2008,26(7):795-797.
12 Marson A,Foreman R,Chevalier B,et al.Wnt signaling promotes reprogramming of somatic cells to pluripotency.Cell Stem Cell,2008,3(2):132-135.
13 Ichida JK,Blanchard J,Lam K,et al.A small-molecule inhibitor of tgf-Beta signaling replaces sox2 in reprogramming by inducing nanog.Cell Stem Cell,2009,5(5):491-503.
14 Esteban MA,Wang T,Qin B,et al.Vitamin C enhances the generation of mouse and human induced pluripotent stem cells.Cell Stem Cell,2010,6(1):71-79.
15 Chen J,Liu J,Yang J,et al.BMPs functionally replace Klf4 and support efficient reprogramming of mouse fibroblasts by Oct4 alone.Cell Res,2011,21(1):205-212.
16 Yoshida Y,Takahashi K,Okita K,et al.Hypoxia enhances the generation of induced pluripotent stem cells.Cell Stem Cell,2009,5(3):237-241.
17 Lin SL,Chang DC,Lin CH,et al.Regulation of somatic cell reprogramming through inducible mir-302 expression.Nucleic Acids Res,2011,39(3):1054-1065.
18 Romagnani P.Toward the identification of a “renopoietic system”? Stem Cells,2009,27(9):2247-2253.
19 Sagrinati C,Netti GS,Mazzinghi B,et al.Isolation and characterization of multipotent progen itor cells from the Bowman’s capsule of adult human kidneys.J Am Soc Nephrol,2006,17(9):2443-2456.
20 Bayart E,Cohen-Haguenauer O.Technological overview of ips induction from human adult somatic cells.Curr Gene Ther,2013,13(2):73-92.
21 Guo X,Zhang YM,Qi ZY,et al.Mouse-induced pluripotent stem cells have the potential to differentiate into induced primordial germ cells.Zhonghua Nan Ke Xue,2011,17(11):966-972.
22 Song B,Niclis JC,Alikhan MA,et al.Generation of induced pluripotent stem cells from human kidney mesangial cells.J Am Soc Nephrol,2011,22(7):1213-1220.
23 Wang WW,Wang W,Jiang Y,et al.Reprogramming of mouse renal tubular epithelial cells to induced pluripotent stem cells.Cytotherapy,2013,15(5):578-585.
24 Zhou T,Benda C,Dunzinger S,et al.Generation of induced pluripotent stem cells from urine.J Am Soc Nephrol,2011,22(7):1221-1228.
25 Schuldiner M,Yanuka O,Itskovitz-Eldor J,et al.Effects of eight growth factors on the differentiation of cells derived from human embryonic stem cells.Proc Natl Acad Sci U S A,2000,97(21):11307-11312.
26 Song B,Smink AM,Jones CV,et al.The directed differentiation of human iPS cells into kidney podocytes.PLOS One,2012,7(9):e46453.
27 Araoka T,Mae S,Kurose Y,et al.Efficient and rapid induction of human iPSCs/ESCs into nephrogenic intermediate mesoderm using small molecule-based differentiation methods.PLoS One,2014,9(1):e84881.
28 Morizane R,Monkawa T,Itoh H,et al.Differentiation of murine embryonic stem and induced pluripotent stem cells to renal lineage in vitro.Biochem Biophys Res Commun,2009,390(4):1334-1339.
29 Lee PY,Chien Y,Chiou GY,et al.Induced pluripotent stem cells without c-Myc attenuate acute kidney injury via downregulating the signaling of oxidative stress and inflammation in ischemia-reperfusion rats.Cell Transplant,2012,21(12):2569-2585.
30 Cheng LT,Nagata S,Hirano K,et al.Cure of ADPKD by selection for spontaneous genetic repair events in Pkd1-mutated iPS cells.PLoS One,2012,7(2):e32018.
31 Zhao T,Zhang ZN,Rong Z,et al.Immunogenicity of induced pluripotent stem cells.Nature,2011,474(7350):212-215.
32 Araki R,Uda M,Hoki Y,et al.Negligible immunogenicity of terminally differentiated cells derived from induced pluripotent or embryonic stem cells.Nature,2013,494(7435):100-104.

