自体外周血造血干细胞移植治疗重型狼疮性肾炎的临床观察
黄湘华 王庆文 胡伟新 陈文萃 张 瑾 刘正钊 龚德华 任 强 周敏林 章海涛 刘志红
系统性红斑狼疮(SLE)是一种可累及多个系统和器官的自身免疫性疾病,好发于育龄期女性,患者10年生存率约70%[1]。肾脏是SLE最主要的受累器官,80%~90%的SLE患者合并狼疮性肾炎(LN)。LN也是我国最常见的继发性肾小球肾炎,其病理分型中重型LN的比例较高。根据我们对1 352例LN病理分型的研究发现,重型LN包括Ⅲ、Ⅳ、Ⅴ、Ⅳ+Ⅴ和Ⅲ+Ⅴ型[2],比例高达80.8%[3]。虽然大部分重型LN对常规免疫抑制疗法有效,但仍有部分患者治疗不能获得缓解,部分患者反复复发。
自体外周血造血干细胞移植(ASCT)是难治性自身免疫性疾病的有效治疗方法。目前国外文献报道ASCT治疗难治复发性SLE的例数已达数百例[4]。 ASCT治疗通过大剂量化疗或结合放疗清除体内异常的免疫细胞,继而回输自体外周血造血干细胞,重建患者的免疫和造血功能[5]。文献报道ASCT治疗SLE可成功地实现自身免疫记忆的清除、重建干细胞水平的免疫耐受系统,使SLE得到长期缓解[6]。从文献报道结果看,ASCT治疗SLE有较高的血液学缓解率,受累器官功能也能得到逆转,5年无进展生存期可达60%。这些研究中仅部分病例合并LN,有关ASCT对重型LN的总体疗效及安全性如何,目前尚无文献报道。本文总结了使用ASCT治疗20例重型LN的临床研究结果。
对象和方法
研究对象2011年7月至2014年1月南京军区南京总医院肾脏科收治的行ASCT治疗的重型LN 20例。所有病例均符合下列标准:(1)符合美国1997年美国风湿病协会修订的SLE诊断标准[7];(2)移植前所有患者均行肾活检,根据2003年国际肾脏病学会/肾脏病理学会(ISN/RPS)分型[8],证实为重型LN;(3)既往接受过至少一种免疫抑制剂治疗半年以上未获得缓解,或复发2次以上,免疫学指标持续活动;(4)有完整的临床及随访资料;(5)估算的肾小球滤过率(eGFR)≥30 ml/(min·1.73m2);(6)无活动性感染;(7)无严重心肺功能障碍;(8)患者及家属签署知情同意书,愿意接受移植。
临床资料临床资料的收集包括起病时间、病程、既往使用的治疗方案、复发次数、主要临床表现、肾外受累器官、狼疮活动指数(SLE-DAI)。实验室指标主要包括血常规、血生化、抗核抗体(ANA)、抗ds-DNA抗体、补体C3/C4、抗心磷脂抗体(ACL)、淋巴细胞亚群、24h尿蛋白定量、尿沉渣红细胞计数等。肾脏病理指标主要有病理类型、活动指数(AI)和慢性指数(CI)评分。
干细胞动员及采集使用环磷酰胺(CTX)联合粒细胞集落刺激因子(G-CSF)动员, CTX3~4 g/m2静脉滴注,分两天使用;G-CSF用量为5~10 μg/(kg·d),在CTX使用后第4天开始,待白细胞回升至>4×109/L时检测CD34+细胞计数,当CD34+细胞数>15个/μl时开始采集,使用费森尤斯血细胞分离机采集外周血干细胞,每次采集处理血容量11~14L,采集目标值为单个核细胞计数>2×108/kg,CD34+细胞计数>2×106/kg。采集后干细胞与细胞冻存液(配比为生理盐水:10%二甲基亚砜:20%人血白蛋白=3∶ 1∶ 1)按等比例混合后分装成60 ml/袋,液氮冻存备用。
预处理及干细胞回输标准预处理方案为CTX每天30~40 mg/kg静脉滴注,连续4 d(干细胞回输前2~5 d),抗胸腺球蛋白多克隆抗体(ATG)每天2.5 mg/kg静脉滴注,连续3 d(干细胞回输前2~4 d),同时碱化和水化尿液,保护肝肾功能。将冻存的干细胞在37~40 ℃ 水浴箱内快速解冻、复苏,经颈内静脉置管快速回输。回输后第2天开始使用G-CSF刺激造血。期间根据患者病情予输血及预防性使用抗生素治疗。
随访及疗效评价患者移植后3月内每月随访一次,后续每3月随访一次。随访检查的主要指标包括尿蛋白定量、尿沉渣红细胞计数、血常规、血生化、ANA、抗ds-DNA抗体、补体C3/C4等。疗效分为完全缓解(CR)、部分缓解(PR)及无效(NR)。CR指尿蛋白定量<0.4 g/24 h,未出现活动性尿沉渣(>5个红细胞/HP,无感染的情况下>5个白细胞/HP,或仅有红细胞/白细胞管型),血清白蛋白≥35 g/L,血清肌酐(SCr)正常;PR指尿蛋白比基础值下降>50%,血清白蛋白≥30 g/L,血清肌酐(SCr)正常;未缓解指未达到CR或PR的患者。总缓解率定义为CR和PR之和。复发是指已经获得CR或PR的患者,24h尿蛋白定量增加≥1.0g伴或不伴尿沉渣红细胞计数增加。患者不良反应分级采用美国国家癌症研究所的常用不良事件术语标准3.0版(CTCAE v3.0)[9]。

结 果
患者基线特征患者行ASCT治疗前的基础临床特征见表1,其中反复复发患者16例,4例患者为治疗半年以上未缓解。起病时患者均有不同程度的肾外受累,其中贫血13例,血小板减少9例,皮疹8例,关节痛6例,狼疮脑病2例。患者移植前LN中位病程为45.5月(24.5~71月),中位复发次数为1次,有3例患者复发3次。SLE-DAI评分平均14.7±4.28分。3例患者移植前合并肾功能不全。移植前诱导治疗方案中有13例患者使用多靶点(他克莫司/环孢素A+霉酚酸酯+泼尼松)治疗,7例患者使用CTX诱导治疗。
干细胞采集情况所有患者均采集成功,采集的CD34+细胞数量平均为(7.5±4.12) ×106/kg。采集过程中16例(80%)患者输注了辐照血小板或红细胞,红细胞平均输注量为(3.1±3.4)U,血小板平均输注为(1.2±1.1)治疗量。采集过程中的主要并发症为发热(55%),其他常见并发症有胃肠道反应(20%)、低钾血症(45%)、低钙血症(15%)、头痛和骨痛(15%)及皮疹(10%),这些反应多与CTX或G-CSF使用相关。

表1 20例患者自体外周血造血干细胞移植治疗前的基线特征
移植情况所有患者均移植成功,造血重建顺利。CTX使用的平均总剂量为(8.1±2.3)g,其中4例患者使用剂量为30 mg/(kg·d),16例使用剂量为40 mg/(kg·d)。ATG用量均为2.5 mg/(kg·d),平均总剂量为(418.8±81.9)mg。患者中位粒缺期为7 d(5.25~7 d),粒细胞植入中位时间为8 d(7~10 d),血小板植入时间的中位时间也为8 d(6~10 d)。抗生素使用的中位天数为11 d(9~12 d)。移植过程患者平均辐照红细胞输注量为(2.0±2.1)U,平均辐照血小板输注量为(1.8±2.2)治疗量。
患者移植期间的主要并发症见表2。发热是移植过程中最主要的并发症,使用ATG过程中,100%患者出现发热症状,与使用大剂量ATG相关。粒缺期发热的患者比例为55%,但未发现血培养阳性患者。其他常见并发症主要为消化道反应,包括恶心呕吐(65%)、黏膜炎(65%)和腹泻(55%)等。骨痛与皮疹也是移植期间的常见并发症。其他少见的并发症有肝酶升高及急性肾损伤,10%患者出现心律失常。大部分不良反应均为1~2级,3级的反应主要是发热和腹泻,未出现4~5级的不良反应。
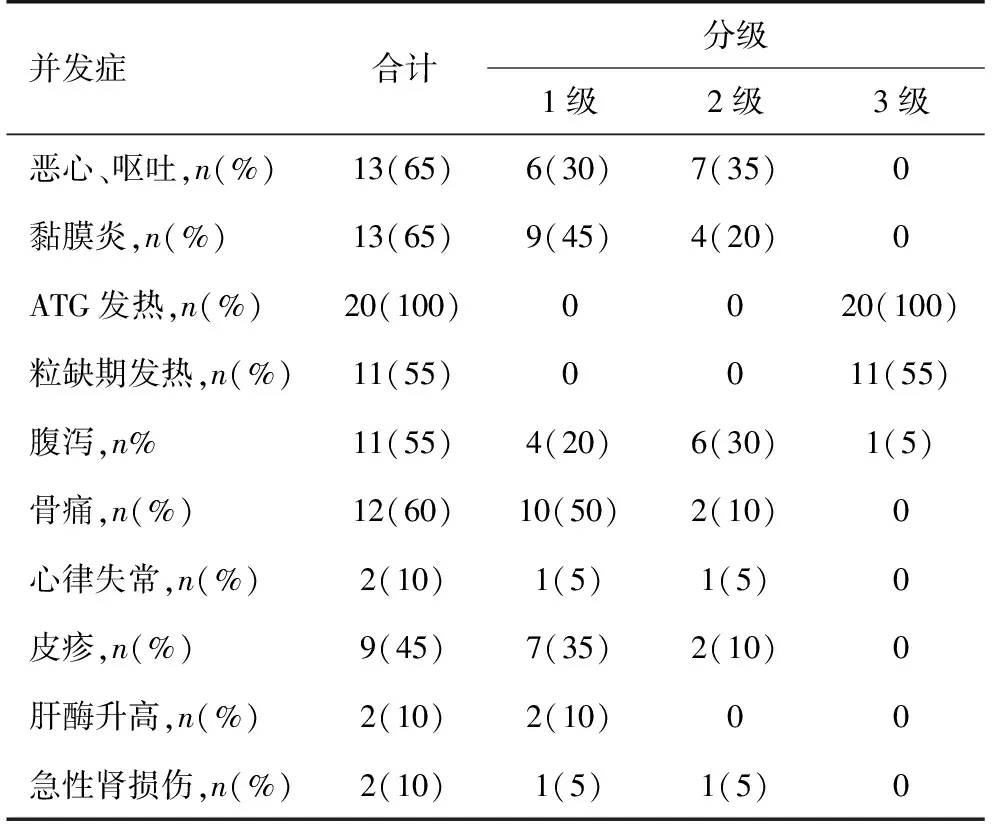
表2 20例患者自体外周血造血干细胞移植过程相关并发症
疗效分析中位随访时间21月(6~36月)。20例患者中2例分别于ASCT后3月和5月死于严重感染。其余18例患者有CR 14例,PR 3例,NR 1例,总体缓解率为85%,其中CR率为70%。从不同随访时间点看,移植后6月的缓解率为55%(11/20),其中完全缓解35%(7/20);移植后12月缓解率为88.9%(16/18),完全缓解为66.7%(12/18);移植后24月的缓解率为72.7%(8/11),完全缓解为63.6%(7/11)。随着移植时间的延长,患者的平均尿蛋白水平较移植前均有明显下降(图1A),患者白蛋白也有明显的升高,所有患者移植后白蛋白均恢复正常(图1B)。从免疫学指标看,ANA滴度在移植近期下降明显,后续波动较大(图1C),其中有5例患者ANA转阴,4例患者ANA较移植前有所下降,其他患者无变化或较前升高。18例患者抗ds-DNA抗体均转阴。补体C3及C4移植后恢复较快,且大部分患者稳定在正常水平(图1D、E)。有12例患者补体C3恢复正常,6例患者较前升高;有17例患者补体C4恢复正常,1例患者较前升高。患者移植后SLE-DAI评分也较移植前有明显下降(图1F),有7例患者SLE-DAI评分为0分。随着移植后时间的延长,缓解率逐月增高(图2A)。患者12月的肾脏缓解率为88.9%,肾脏的中位缓解时间为5月。患者12月的肾脏完全缓解率为72.2%,肾脏的中位完全缓解时间为7月(图2B)。
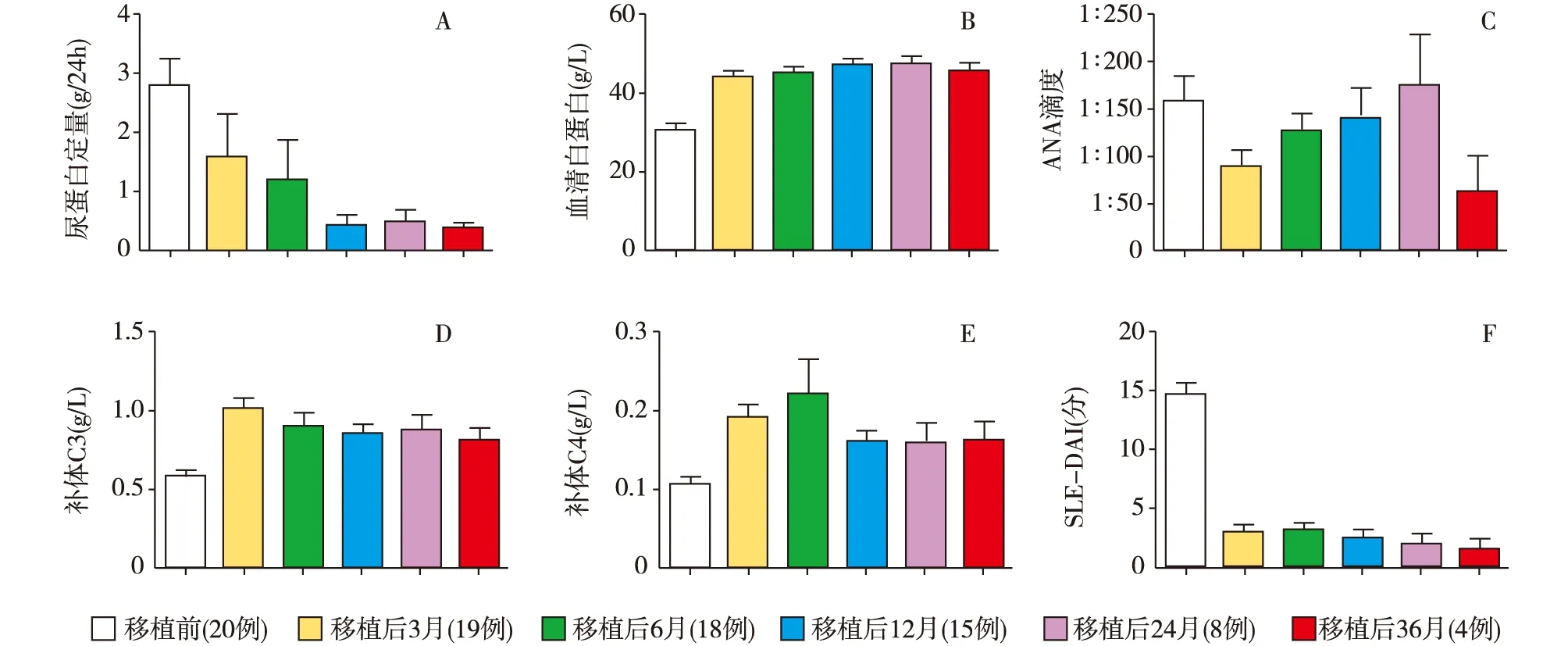
图1 20例患者自体外周血造血干细胞移植治疗前后主要临床指标变化(各时间点指标以均数统计)
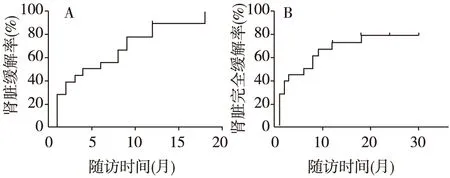
图2 患者的肾脏缓解曲线(A)及完全缓解曲线(B)
预后及随访并发症患者中位随访时间为21月(6~36月)。随访期间共有2例患者死亡。1例为术后3月,死于肺部感染,一例为术后5月因脓毒症死亡。随访期间的并发症较少,带状疱疹感染、白细胞减少和纯红细胞再生障碍性贫血各1例,经对症治疗后均恢复。1例患者术前SCr为182.1 μmol/L,术后肾脏未缓解,SCr缓慢升高。在ASCT治疗后12月开始腹膜透析治疗,其余患者肾功能均正常。2例(11.1%)患者分别在ASCT治疗后15月和27月肾病复发,患者尿蛋白由正常增至1 g/24h以上,分别予雷公藤多苷及他克莫司治疗后获得缓解。患者3年的总体生存率为90%,估算的3年无复发生存率为66%,复发率为11.1%。移植后1年统计有9例患者停用免疫抑制剂,其余患者均予小剂量激素联合免疫抑制剂治疗,包括他克莫司、霉酚酸酯和雷公藤多苷。
讨 论
LN的理想治疗目标是通过纠正患者异常的免疫状态,使肾脏损伤获得长期缓解,并维持肾功能稳定,同时需减少治疗的不良反应。ASCT治疗SLE的机制可能有以下几个方面:通过大剂量化疗药物杀伤患者的免疫细胞,减少治疗抵抗,并延长抗炎反应;通过清除自身反应性细胞来修复自身免疫耐受,而输注的造血干细胞可激活胸腺活性,重建免疫系统;诱导产生对自身抗原的免疫耐受,达到新的免疫平衡,使SLE得到长期缓解[10]。虽然尚无随机对照实验证实ASCT治疗比传统疗法更优,但目前的研究结论认为,ASCT治疗SLE可达50%~70%的5年无病生存率,且对免疫学指标的改善有明显优势[4]。
从本组患者来看,ASCT治疗LN的有效率达85%,其中CR率为70%。临床指标可迅速缓解,肾脏的中位缓解时间仅为5月,免疫学指标在术后3月左右也得到明显改善。短期随访结果来看,患者的近期疗效也较好。从其他研究来看,国际上两组病例数最多的报道,分别来自欧洲和美国。欧洲血液和骨髓移植协作组(EBMT)报道了一组85例SLE患者行ASCT治疗的研究结果,中位随访25月(2~123月),因患者来自不同的中心,采取的预处理方案并不相同,结果显示患者5年的总体生存率为79%,5年无复发生存率为44%[11]。美国西北大学Burt等[12]报道了50例患者的治疗情况,所有患者均采用CTX+ATG的预处理方案,与本研究相同。中位随访29月,患者的5年生存率为84%,5年无复发生存率为50%。50例患者中25例合并LN,其中16例患者获得缓解;4例患者移植后肾功能恶化,进入透析治疗;5例患者移植前已透析治疗,移植后1例死亡,1例肾功能恢复,3例维持透析治疗,但SLE获得缓解。从这些研究结果来看,对于重症难治性SLE,ASCT的疗效显著,明显优于传统治疗方案,即使对治疗反应不佳的患者,后续使用传统治疗方案的反应率也明显提高[4]。此外,ASCT治疗对于合并肺功能不全[13]及抗磷脂抗体综合征[14]的重症SLE患者也有很好的疗效。本研究小样本的结果显示,ASCT治疗重症LN的疗效确切,反应率>90%,虽然有部分患者术后出现复发,但加用免疫抑制药物后可很快控制病情,患者总体预后较好。因本组病例较少,尚未发现LN不同病理分型之间的疗效差异,也未能分析影响患者复发的相关因素。
治疗相关的并发症仍是ASCT在临床应用的最大障碍。文献报道的移植相关死亡率在4%~25%[4]。因各研究之间患者入组标准、预处理方案等存在较大差异,故移植死亡率也有较大的差别。本研究有1例患者移植后100d内死亡,移植相关死亡率为5%。选择合适的患者及治疗时机是降低移植相关死亡率的关键,但目前尚未形成统一的患者入选标准。有学者认为早期治疗,患者脏器功能储备较好,可降低移植相关死亡率,但也有人认为ASCT应限于传统方案无效、疾病进展、反复复发的患者[15]。但多数研究将重型LN纳入了移植入选标准,特别是治疗3~6月无效,或出现临床复发的患者。本组两例死亡的患者均为病程很长的患者,移植前病程分别为192月及132月,患者曾复发多次,已经长期使用多种免疫抑制剂。这类患者移植后严重感染的风险较高,可能不适合ASCT治疗。移植时机的选择可在患者重新诱导治疗后1~3月进行,患者心肺功能应正常,无感染存在。移植后近期患者免疫功能尚未恢复,感染风险仍较高,可采取预防性抗病毒、真菌的药物治疗,但要注意药物本身的不良反应。移植后是否需要继续免疫抑制剂治疗及药物的选择目前尚无统一的意见。本组患者在ASCT术后3月内仅使用小剂量激素,3月后根据血清自身抗体水平决定是否加用免疫抑制剂,但最佳的免疫抑制剂种类和剂量有待进一步研究。
小结:本研究的初步结果显示ASCT治疗重型LN的疗效确切,患者可获得良好的肾脏及免疫学缓解。但应注意ASCT后感染并发症,少部分患者仍可能复发。ASCT治疗LN的远期预后和术后最佳维持治疗方案仍有待进一步研究。
1D′Cruz DP,Khamashta MA,Hughes GR.Systemic lupus erythematosus.Lancet 2007;369(9561):587-596.
2黎磊石,刘志红,鲍浩.狼疮性肾炎//黎磊石,刘志红.中国肾脏病学.北京:人民军医出版社,2008:495-522.
3胡伟新,刘春蓓,孙海鸥,等.1352例狼疮性肾炎的临床与免疫学特征.肾脏病与透析肾移植杂志,2006,15(5):401-408,442.
4Illei GG,Cervera R,Burt RK,et al.Current state and future directions of autologous hematopoietic stem cell transplantation in systemic lupus erythematosus.Ann Rheum Dis,2011,70(12):2071-2074.
5李珍,方峻,夏凌辉.造血干细胞移植治疗系统性红斑狼疮的研究进展.临床内科杂志,2009,26(6):375-378.
6Alexander T,Thiel A,Rosen O,et al.Depletion of autoreactive immunologic memory followed by autologous hematopoietic stem cell transplantation in patients with refractory SLE induces long-term remission through de novo generation of a juvenile and tolerant immune system.Blood,2009,113(1):214-223.
7Hochberg MC.Updating the American College of Rheumatology revised criteria for the classification of systemic lupus erythematosus.Arthritis Rheum,1997,40(9):1725.
8Weening JJ,D′Agati VD,Schwartz MM,et al.The classification of glomerulonephritis in systemic lupus erythematosus revisited.Kidney Int,2004,65(2):521-530.
9National Cancer Institute.Common Terminology Criteria for Adverse Events (CTCAE),v3.0 (http://ctep.cancer.gov/protocolDevelopment/ electronic_applications/ docs/ ctcaev3.pdf ).
10 Nikolov NP,Pavletic SZ.Technology Insight: hematopoietic stem cell transplantation for systemic rheumatic disease.Nat Clin Pract Rheumatol,2008,4(4):184-191.
11 Farge D,Labopin M,Tyndall A,et al.Autologous hematopoietic stem cell transplantation for autoimmune diseases: an observational study on 12 years′ experience from the European Group for Blood and Marrow Transplantation Working Party on Autoimmune Diseases.Haematologica,2010,95(2):284-292.
12 Burt RK,Traynor A,Statkute L,et al.Nonmyeloablative hematopoietic stem cell transplantation for systemic lupus erythematosus.JAMA,2006,295(5):527-535.
13 Traynor AE,Corbridge TC,Eagan AE,et al.Prevalence and reversibility of pulmonary dysfunction in refractory systemic lupus: improvement correlates with disease remission following hematopoietic stem cell transplantation.Chest,2005,127(5):1680-1689.
14 Statkute L,Traynor A,Oyama Y,et al.Antiphospholipid syndrome in patients with systemic lupus erythematosus treated by autologous hematopoietic stem cell transplantation.Blood,2005,106(8):2700-2709.
15 Bertsias G,Ioannidis JP,Boletis J,et al.EULAR recommendations for the management of systemic lupus erythematosus.Report of a Task Force of the EULAR Standing Committee for International Clinical Studies Including Therapeutics.Ann Rheum Dis,2008,67(2):195-205.

