吗替麦考酚酯诱导治疗弥漫增生性狼疮性肾炎的临床疗效
许圣淳 刘正钊 章海涛 陈樱花 陈惠萍 刘志红 胡伟新
吗替麦考酚酯(MMF)已普遍应用于狼疮性肾炎(LN)的临床治疗。随机对照研究和大规模多中心临床试验结果表明,MMF治疗弥漫增生性LN的诱导疗效不劣于静脉环磷酰胺(CTX)冲击疗法,部分研究报道MMF诱导治疗LN的缓解率高于CTX[1,2]。MMF治疗LN研究结果不一的重要原因与研究对象的病理分型不统一有关,包括Ⅲ型、Ⅳ型LN,伴或不伴V型病变。即使研究对象为Ⅳ型LN,病变的性质也不均一,是否有新月体或袢坏死形成,是否伴膜性病变均会影响免疫抑制治疗的临床疗效及肾脏远期预后。
新月体是LN最严重的病理形态,临床病理及预后研究表明,新月体型LN肾功能损害程度显著高于非新月体型LN,且诱导缓解率低,肾脏预后较差[3]。对于该病理类型,选择最佳诱导方案对改善肾脏预后至关重要,而目前关于这方面的研究报道较少。我们既往回顾性分析发现,对于不伴新月体或袢坏死的单纯Ⅳ型LN,静脉CTX和MMF诱导均可达到较高的完全缓解率[4],而以弥漫节段性病变(如新月体或袢坏死)为主的LN,CTX治疗的反应性明显降低,而MMF治疗可明显提高该类型的缓解率。因此,MMF对有新月体或坏死性病变的Ⅳ型LN可能较CTX疗法更具有优越性。
本文选择有新月体的Ⅳ型LN为研究对象,比较MMF与CTX对该病理类型诱导治疗的效果。
对象和方法
研究对象选择2000年1月至2009年6月于南京军区南京总医院肾脏科住院,并符合以下标准者:(1)年龄性别不限;(2)符合1997年美国风湿病协会(ACR)系统性红斑狼疮(SLE)的诊断标准[5];(3)根据1982年世界卫生组织(WHO)病理分型标准[6],肾病理符合Ⅳ型LN,且细胞性和(或)细胞纤维性比例≥15%;(4)24h蛋白尿定量 ≥1.0 g/d;(5)接受间断静脉CTX冲击疗法(IV-CTX)或MMF诱导治疗≥6月。
排除标准包括:(1)住院前半年内已接受正规免疫抑制剂治疗,包括CTX、MMF、环孢素A、他克莫司等,或住院前两月内泼尼松≥50 mg/d疗程超过3周,或住院前3月内接受人免疫球蛋白、肾脏替代或血浆置换、免疫吸附治疗;(2)肾脏慢性化指数(CI)>4分,(3)肾组织病理合并间质血管病变,包括非炎症坏死性血管病变、血栓性微血管病(TMA);(5)病理合并膜性病变;(6)合并活动性感染。
治疗按接受的诱导治疗方案分为MMF组和IV-CTX组。两组均先予甲基泼尼松龙冲击治疗(0.5 g/d ×3d),后续口服泼尼松0.6~0.8 mg/(kg·d),一月后逐渐减量直至10 mg/d维持。
MMF组给予MMF 1.5~2.0 g/d,分两次口服,治疗6月临床获得缓解后减量至0.75~1.0 g/d维持。
IV-CTX组采用间断静脉CTX冲击疗法,每次剂量为0.5~1.0 g/(m2·体表面积),每月一次,连续6月。获得缓解后改硫唑嘌呤(AZA)2 mg/(kg·d)或MMF(0.75~1.0 g/d)维持。
肾组织病理肾组织标本光镜采用石蜡包埋肾组织,行HE、PAS、PASM-Masson及Masson三色染色,计数新月体比例,包括细胞性、细胞纤维性及纤维性新月体,袢坏死、白金耳、透明栓,节段及球性硬化比例,是否合并血管病变。对肾组织活动性指数AI和CI进行半定量评分[7]。
临床资料和实验室检查记录肾活检时临床资料,包括性别、年龄、SLE及LN病程、是否合并高血压、少尿等,评分SLE疾病活动性指数(SLE-DAI)[8]。实验室检查包括:24h尿蛋白定量、尿沉渣红细胞计数、血清白蛋白(Alb)、血清肌酐(SCr),抗核抗体(ANA)、抗双链DNA(ds-DNA)抗体、补体C3、C4、全血细胞计数等。
疗效定义肾脏完全缓解(CR):尿蛋白定量<0.4 g/24h,无活动性尿沉渣,血清白蛋白≥35 g/L,SCr正常。肾脏部分缓解(PR):尿蛋白定量下降至基础值50%以下,且<3 g/24h,且血清白蛋白≥30 g/L,SCr正常或上升不超过基础值15%。总缓解率=CR+PR。无效(NR):未达到CR和PR。
统计学方法数据分析使用SPSS 13.0统计软件,计量资料以均数±标准差或中位数(四分位数)表示,计数资料以构成比表示。两组间计量资料的比较采用t检验或Mann-WhitneyU检验,计数资料比较采用χ2检验或Fisher精确检验。P<0.05为差异有统计学意义,P<0.01为统计学差异显著。
结 果
病例资料符合条件的患者共80例,其中39例接受MMF诱导治疗(MMF组),41例接受IV-CTX诱导治疗(IV-CTX组)。两组患者的基线临床和病理指标均无显著差异(表1、2)。MMF组和IV-CTX组分别有53.8%和53.7%存在大量蛋白尿(≥3.5 g/24h),合并急性肾损伤(AKI)分别为33.3%和36.6%。
诱导治疗疗效MMF组3月(84.6%vs58.7%,P=0.01)和6月的总缓解率(92.3%vs73.1%,P=0.024)均显著高于IV-CTX组,其中CR率MMF组也高于IV-CTX组(3月:23.1%vs9.8%,P=0.106;6月:48.7%vs34.1%,P=0.186),但均无统计学差异(图1)。

表1 两组患者临床资料

表2 两组患者肾组织改变特征
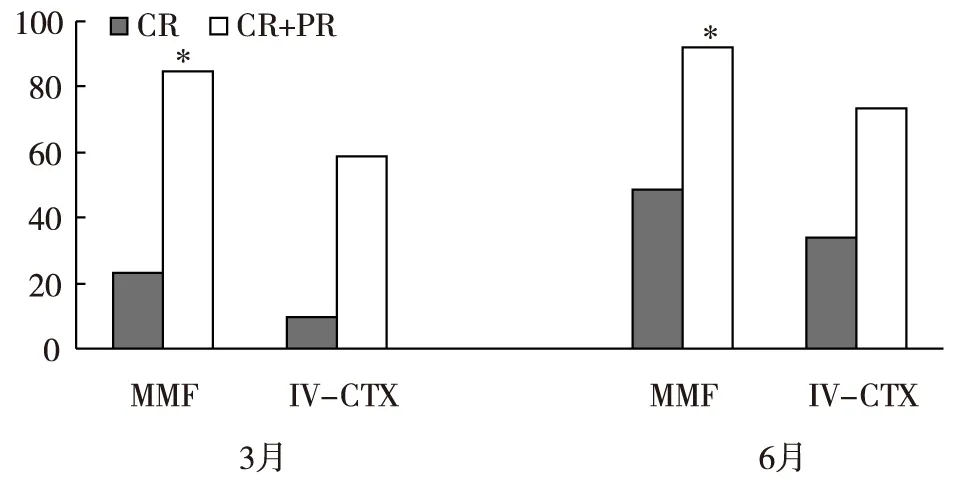
图1 MMF和IV-CTX治疗IV伴新月体LN的诱导疗效
将患者根据新月体比例分为<50%和≥50%两组。新月体比例<50%(n=61,MMF组30例,IV-CTX组31例)患者中MMF治疗6月的总缓解率显著高于IV-CTX组(96.7%vs74.2%,P=0.026),其中CR率分别为46.7%和35.5%(P=0.375)。新月体比例≥50%患者中(n=19,MMF组9例,IV-CTX组10例),MMF和IV-CTX两组总缓解率无差异(77.8%vs60%,P=0.628)(表3)。
免疫指标MMF组诱导6月血清补体C3恢复正常的比例显著高于IV-CTX组(64.1%vs35.9%,P=0.013)。两组ds-DNA转阴率和补体C4恢复正常比例均无显著差异(表4)。
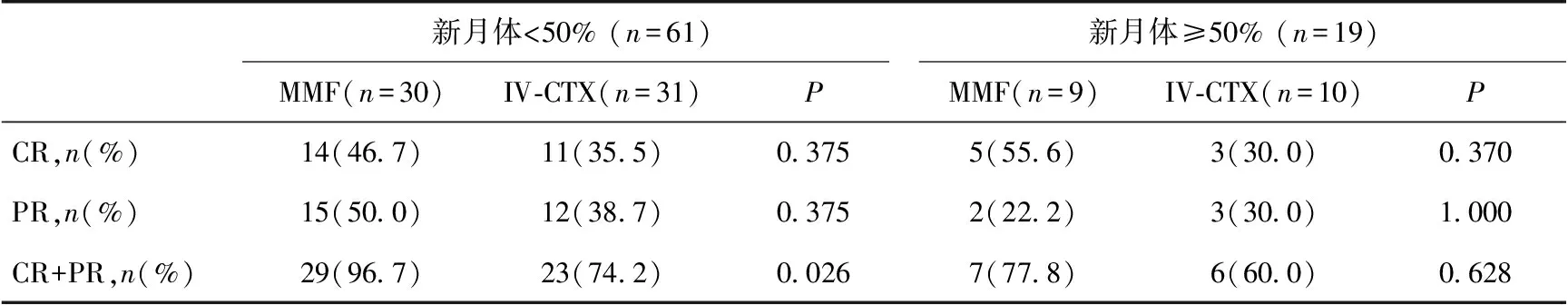
表3 MMF和IV-CTX对不同新月体比例Ⅳ型LN的6月诱导治疗的效果
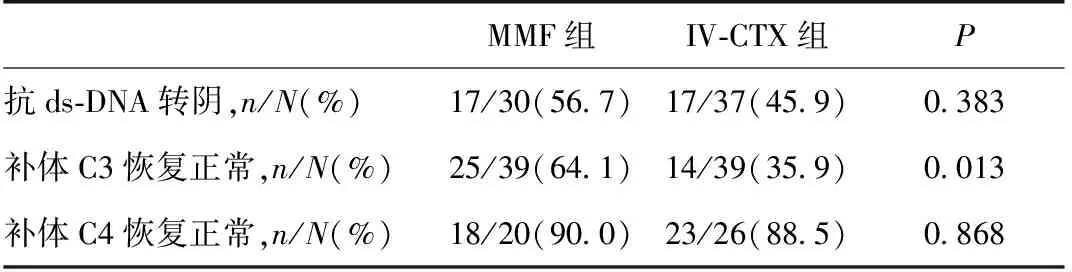
表4 两组患者血清免疫指标改善情况
不良反应两组不良反应总发生率为43.6% 和48.8%(P=0.642),其中MMF组血白细胞减低发生率低于IV-CTX组(5.1%vs19.5%,P=0.052)。MMF组和IV-CTX组恶心呕吐(10.3%vs12.2%)、肺部感染(5.1%vs2.4%)、带状疱疹(5.1%vs2.4%)、肝脏损害(2.6%vs4.9%)、脱发(10.3%vs7.3%)、腹泻(2.6%vs4.9%)发生率均无显著差异。
讨 论
LN发病机制复杂、病理类型多样,其中Ⅳ型LN组织学改变最为混杂,可表现为单纯弥漫内皮系膜增生性病变,可伴新月体、袢坏死等。近年来,新月体型LN(新月体比例≥50%)或伴新月体形成(≥10%)LN的临床病理以及预后也逐步得到关注。我们的研究发现,半数Ⅳ型LN患者伴新月体形成,有新月体的Ⅳ型LN较无新月体的患者表现为更严重的蛋白尿、低蛋白血症和肾功能不全[9],因此,新月体形成是Ⅳ型LN患者肾脏预后不佳的独立危险因素[10]。有学者称之为Ⅳ+Ⅲ型LN,肾脏预后较单纯Ⅳ型LN差。Oudah等[11]报道35例伴新月体形成(≥20%)的LN,其中73.3%合并肾功能不全,53.8%合并肾病范围蛋白尿,平均随访26月时16.7%进入维持性血液透析。因此有新月体形成的Ⅳ型LN肾脏损害更加严重,需要有效的免疫抑制治疗。
Yu等[3]研究报道33例新月体型LN和119例非新月体型LN,>90%患者予IV-CTX冲击治疗,新月体型的治疗CR率显著低于非新月体型LN,提示CTX对有新月体的LN治疗疗效差。我们的一项回顾性研究也发现[4],对于无新月体或袢坏死的单纯弥漫内皮系膜增生性Ⅳ-G型LN,传统IV-CTX冲击疗法和MMF的诱导缓解率相似,治疗6月的CR率均高达50%。而对于有弥漫新月体或袢坏死的Ⅳ-S型LN,CTX的诱导疗效显著降低,6月的CR率仅为16.7%,MMF治疗可提高Ⅳ-S型的诱导缓解率。提示伴新月体形成的Ⅳ型LN,MMF诱导治疗的疗效可能优于IV-CTX。
本研究选择在弥漫内皮系膜增生基础上、伴新月体形成(≥15%)的Ⅳ型LN为研究对象,并排除了膜性病变、间质血管病变如TMA等影响疗效及预后的病理改变,探讨MMF治疗是否能提高伴有新月体形成Ⅳ型LN的疗效,发现与传统IV-CTX组比较,MMF组显著提高了诱导缓解率。MMF治疗组从治疗3月开始总缓解率即显著高于IV-CTX组。表明对有新月体形成(≥15%)的Ⅳ型LN,临床可首选MMF诱导治疗方案以获得更高的缓解率,从而提高远期肾脏存活率。对新月体不同比例亚组进行分析发现,新月体比例<50%的病例,MMF治疗缓解率显著高于IV-CTX。对新月体比例≥50%的患者(即新月体型LN),MMF组总缓解率和CR率也均高于IV-CTX组,表明不同比例新月体形成的Ⅳ型LN,MMF治疗均能获得较高的缓解率。既往有研究比较了MMF和CTX治疗新月体型LN(新月体比例≥50%)的诱导疗效[12],发现MMF和CTX诱导6月缓解率相似(23.1%vs21.7%),但缓解率均低于本文结果。分析原因可能与研究对象及病情轻重不同有关。本研究的病例排除了既往应用免疫抑制剂治疗、肾组织慢性病变重、合并V型、Ⅳ-S型、病情重且需要血液净化治疗及合并肾间质血管病变的患者,故本文病例病程短(3月),病理类型相对单一,CI指数低(CI<1.5),因而治疗缓解率较高。
MMF独特的作用机制及新月体发病机制的研究可作为MMF改善新月体病变的理论依据。新月体形成是一种最严重的肾小球损伤形式,通常发生于肾小球毛细血管炎症、毛细血管袢完整性破坏,进而导致巨噬细胞、T细胞和血浆蛋白浸润至包囊及壁层上皮细胞增殖[13]。LN动物模型以及LN患者的研究均表明,细胞间黏附分子1(ICAM-1)和血管细胞黏附分子1(VCAM-1)在新月体的发生中起到重要的作用[14,15]。肾小球尤其是毛细血管内皮ICAM-1和VCAM-1表达显著增加,促进了白细胞在内皮表面的聚集及内皮下迁移。针对ICAM-1的特异性抗体和通过建立ICAM-1基因敲除模型,可显著改善LN模型鼠血管炎病变、抑制新月体形成[14]。MMF主要通过抑制鸟嘌呤从头合成途径的限速酶-次黄嘌呤核苷酸脱氢酶(IMPDH),进而高度选择性地抑制T和B淋巴细胞增殖[16]。另外,因鸟嘌呤合成受到抑制,MMF可抑制黏附分子的糖基化和减低其表达水平。体内外试验表明,MMF可以通过减少炎细胞或血管内皮细胞黏附分子的表达,而起到抑制炎细胞黏附和内皮浸润的作用[15,17,18]。鉴于MMF独特的抑制血管内皮炎症反应的机制,可以推断MMF可以针对性改善LN的血管炎样病变。
早期个案报道发现,部分CTX治疗抵抗的LN,给予MMF治疗后可达到缓解[19-23]。部分RCT研究发现MMF较CTX增加诱导缓解率[24],但大规模多中心Aspreva狼疮治疗研究(ALMS)表明[1],与CTX相比,MMF诱导治疗LN并未提高诱导缓解率( 56.2%vs53.0%,P=0.58)。但该项研究入组对象的病理类型混杂多样,包括Ⅲ型、Ⅳ型伴/不伴膜性病变。不同病变提示不同的发病机制,MMF能否特异性地改善特殊病变类型LN,如新月体病变是临床研究要阐述的问题。本文选择在弥漫增生性病变为背景的基础上,合并新月体形成(≥15%)的LN为研究对象,并排除间质血管病变、膜性病变等常见且明确的影响LN预后的病理形态患者,以确保病理类型相对单一,发现MMF治疗该病理类型可以提高传统CTX方案的诱导疗效。但本研究为单中心回顾性分析,且样本量较小。MMF和CTX治疗伴新月体形成或新月体性LN的疗效比较,需前瞻性、大样本RCT研究加以验证。
基于发病机制的研究、肾病理分型规范化及随机对照研究的循证医学证据,LN患者治疗方案的选择将会更加个体化,以达到更加快速、充分地诱导临床缓解、消除肾脏病理改变。
1Appel GB,Contreras G,Dooley MA,et al.Mycophenolate mofetil versus cyclophosphamide for induction treatment of lupus nephritis.J Am Soc Nephrol,2009,20(5):1103-1112.
2Mak A,Cheak AA,Tan JY,et al.Mycophenolate mofetil is as efficacious as,but safer than,cyclophosphamide in the treatment of proliferative lupus nephritis:a meta-analysis and meta-regression.Rheumatology (Oxford),2009,48(8):944-952.
3Yu F,Tan Y,Liu G,et al.Clinicopathological characteristics and outcomes of patients with crescentic lupus nephritis.Kidney Int,2009,76(3):307-317.
4Xu S,Liu Z,Chen H,et al.Diffuse segmental and pure diffuse global proliferative glomerulonephritis:different patterns of class IV lupus nephritis.Clin Nephrol,2014,81(6):411-418.
5Hochberg MC.Updating the American College of Rheumatology revised criteria for the classification of systemic lupus erythematosus.Arthritis Rheum,1997,40(9):1725.
6Weening JJ,D’Agati VD,Schwartz MM,et al.The classification of glomerulonephritis in systemic lupus erythematosus revisited.Kidney Int,2004,65(2):521-530.
7Austin HA 3rd,Muenz LR,Joyce KM,et al.Diffuse proliferative lupus nephritis:identification of specific pathologic features affecting renal outcome.Kidney Int,1984,25(4):689-695.
9Chen S,Tang Z,Zhang Y,et al.Significance of histological crescent formation in patients with diffuse proliferative lupus nephritis.Am J Nephrol,2013,38(6):445-452.
10 Austin HA 3rd,Boumpas DT,Vaughan EM,et al.High-risk features of lupus nephritis:importance of race and clinical and histological factors in 166 patients.Nephrol Dial Transplant,1995,10(9):1620-1628.
11 Oudah N, Al Duhailib Z, Alsaad K, et al. Glomerulonephritis with crescents among adult saudi patients outcome and its predictors. Cline Exp Med, 2012,12(2):121-125.
12 Tang Z,Yang G,Yu C,et al.Effects of mycophenolate mofetil for patients with crescentic lupus nephritis.Nephrology (Carlton),2008,13(8):702-707.
13 Tarzi RM,Cook HT,Pusey CD.Crescentic glomerulonephritis:new aspects of pathogenesis.Semin Nephrol,2011,31(4):361-8.
14 Moon KC,Park SY,Kim HW,et al.Expression of intercellular adhesion molecule-1 and vascular cell adhesion molecule-1 in human crescentic glomerulonephritis.Histopathology,2002,41(2):158-165.
15 Lewis MJ,D’Cruz D.Adhesion molecules,mycophenolate mofetil and systemic lupus erythematosus.Lupus,2005,14(Suppl 1):s17-26.
16 Allison AC,Eugui EM.Mycophenolate mofetil and its mechanisms of action.Immunopharmacology,2000,47(2-3):85-118.
17 Huang Y,Liu Z,Huang H,et al.Effects of mycophenolic acid on endothelial cells.Int Immunopharmacol,2005,5(6):1029-1039.
18 Raab M,Daxecker H,Karimi A,et al.In vitro effects of mycophenolic acid on the nucleotide pool and on the expression of adhesion molecules of human umbilical vein endothelial cells.Clin Chim Acta,2001,310(1):89-98.
19 Glicklich D,Acharya A.Mycophenolate mofetil therapy for lupus nephritis refractory to intravenous cyclophosphamide.Am J Kidney Dis,1998,32(2):318-322.
20 Wallman L,Stewart G,Chapman J,et al.Mycophenolate mofetil for treatment of refractory lupus nephritis:four pilot cases.Aust N Z J Med,2000,30(6):712-715.
21 Fu YF,Liu GL.Mycophenolate mofetil therapy for children with lupus nephritis refractory to both intravenous cyclosphosphamide and cyclosporine.Clin Nephrol,2001,55(4):318-321.
22 Dooley MA,Cosio FG,Nachman PH,et al.Mycophenolate mofetil therapy in lupus nephritis:clinical observations.J Am Soc Nephrol,1999,10(4):833-839.
23 胡伟新,刘志红,陈惠萍,等.霉酚酸酯治疗顽固性Ⅳ型狼疮性肾炎.肾脏病与透析肾移植杂志,1998,7(6):511-515.
24 Ginzler EM,Dooley MA,Aranow C,et al.Mycophenolate mofetil or intravenous cyclophosphamide for lupus nephritis.N Engl J Med,2005,353(21):2219-2228.

