腹膜透析患者6分钟步行试验与炎症指标的关系
郑冬霞 张 琳 严 豪 黄佳颖 顾爱萍 倪兆慧 钱家麒 方 炜
终末期肾病(ESRD)患者普遍存在运动能力降低,其运动能力是与其年龄相匹配正常人的60%~70%[1]。运动能力受损造成了透析患者总体健康、生活质量的下降,并影响了患者预后[2]。我们前期的研究显示6分钟步行试验(6MWT)与腹膜透析(PD)患者的全因死亡密切相关,可作为预测PD患者预后的一个指标[3]。
并发症、日常活动减少、抑郁等传统危险因素在透析患者运动能力的降低中起着重要作用[4]。近来的研究提示一些新的危险因素可能与ESRD患者运动能力降低密切相关。这些新的危险因素包括炎症性肌肉消耗、贫血、营养不良、心血管疾病(CVD)、骨病、电解质紊乱、肺淤血等[5-7]。在透析患者中,这些因素均与炎症密切相关[8],但目前炎症对PD患者运动能力的影响还不清楚。
为此,本研究通过检测PD患者血浆炎症因子的水平,并对患者进行6MWT的测定,探讨炎症对PD患者6MWT的影响。
对象和方法
研究对象选取2010-05-01至2011-04-30在上海交通大学医学院附属仁济医院PD中心规律随访的患者。入选标准:(1)年龄>18岁;(2)规律PD>3月;(3)病情稳定;(4)能够耐受6MWT。排除标准:(1)妊娠;(2)入选前30d内发生腹膜炎或其他需要静脉使用抗生素的感染、创伤及手术;(3)活动受限,无法进行6MWT。所有患者均进行6MWT,记录患者的6分钟步行距离(6MWD)。此研究经医院伦理委员会批准,所有入选患者均签署知情同意书。
研究方法
6MWT患者在病房的走廊内往返走动,步履缓急由患者根据自己的体能决定。在旁监测的人员适度鼓励患者快走,每2分钟报时一次。如患者体力难支可暂时休息或终止试验。6分钟后试验结束,监护人员记录患者步行距离、运动前后的氧饱和度(SpO2)及呼吸困难Borg评分。
资料采集及临床指标测定收集入选患者的人口统计学资料,包括性别、年龄、透析龄、原发病、心血管并发症(包括冠状动脉疾病、外周血管疾病和脑血管疾病)等。收集24h的尿液和PD液评估患者的透析充分性尿素氮清除指数(Kt/V)及肌酐清除率(Ccr),采用肌酐清除率和尿素氮清除率的算术平均值计算残余肾功能(RRF)。测定血清白蛋白、前白蛋白、血清肌钙蛋白(cTnI)、高敏C反应蛋白(hs-CRP)、血红蛋白、血脂、钙、磷等指标。应用西门子ACUSON512型探头频率为3.0MHZ的彩色多普勒超声进行超声心动图测定。超声测量指标包括:左室舒张末期内径、左室收缩末期内径、舒张期室间隔厚度、左心室后壁厚度及左室射血分数(LVEF)。根据中国人体表面积公式和Devereux公式计算体表面积及左室心肌重量指数(LVMi)。所有患者入选后均采集血标本5ml,留取血浆和血清,测定血浆白细胞介素(IL-6)、五聚素3(PTX3)及氨基末端B型利钠肽前体(NT-proBNP)的水平。
血浆PTX3、IL-6的测定采用ELISA法测定血浆PTX3、IL-6的浓度,按照试剂盒(Quantikine©,R&D systems)说明书进行操作。
血清NT-proBNP的测定采用电化学发光双抗体夹心法进行快速测定,选用德国Roche system独立便携性分析仪,德国罗氏NT-proBNP免疫测定试剂盒,严格按照仪器及试剂说明书进行操作。
统计学方法用SPSS 16.0统计软件进行数据分析。正态分布的计量资料用均数±标准差表示,非正态分布的计量资料用中位数(四分位数间距)表示。非正态分布的变量用对数法使其转换为正态分布。组间比较采用t检验或Mann-Whitney非参数检验。计数资料以例(%)表示,组间比较采用卡方检验。采用Pearson相关、多元逐步回归分析炎症指标与6MWD的关系,ROC曲线分析PTX3在评估PD患者6MWD中的价值。P<0.05为差异有统计学意义,P<0.01为统计学差异显著。
结 果
患者基线资料共入选100例患者,其中男性52例、女性48例,平均年龄56.0±12.7岁,中位透析龄为41.1月(18.6~72.3月),患者终末期肾衰竭原发病包括慢性肾小球肾炎40例(40%),糖尿病肾病10例(10%),高血压肾硬化10例(10%),多囊肾1例(1%),梗阻性肾病2例(2%),其他及病因不详37例(37%)。其中有17例(17%)患者合并糖尿病,8例(8%)合并心血管并发症。患者临床指标资料见表1。

表1 入选患者一般资料及临床资料
患者6MWT结果本组患者中位6MWD为400(310~460)米;6MWT前SpO2(始)为99%±1%,6MWT后SpO2(末)为98%±1%,SpO2变化值(ΔSpO2)中位数为1%(0~1%),试验后较试验前无明显变化(P=0.125)。6MWT前Borg评分(始)为0(0~0),6MWT后Borg评分(末)为1(0~2),Borg评分变化值(ΔBorg)为1(0~2),试验后较试验前无明显变化(P=0.075)。
PD患者6MWD的相关因素分析相关分析结果显示,6MWD与患者年龄(r=-0.475,P<0.001),lnNT-proBNP(r=-0.217,P=0.031),lnhs-CRP(r=-0.231,P=0.025),lnPTX3(r=-0.271,P=0.009),lnIL-6(r=-0.270,P=0.008)成负相关,与收缩压(r=0.256,P=0.011),舒张压(r=0.370,P<0.001),LVEF(r=0.261,P=0.013),前白蛋白(r=0.297,P=0.003),nPCR(r=0.362,P<0.001)呈正相关。与其他指标无明显相关性。
炎症对PD患者6MWD的影响对患者的血清白蛋白、血红蛋白、lnhs-CRP、lnIL-6、lncTnI等因素校正后,多元逐步回归显示lnPTX3是6MWD的独立影响因素,lnPTX3每增加1个单位,6MWD缩短16.1%,患者年龄、女性、舒张压、 lnNT-proBNP也是6MWD的独立影响因素(表2)。
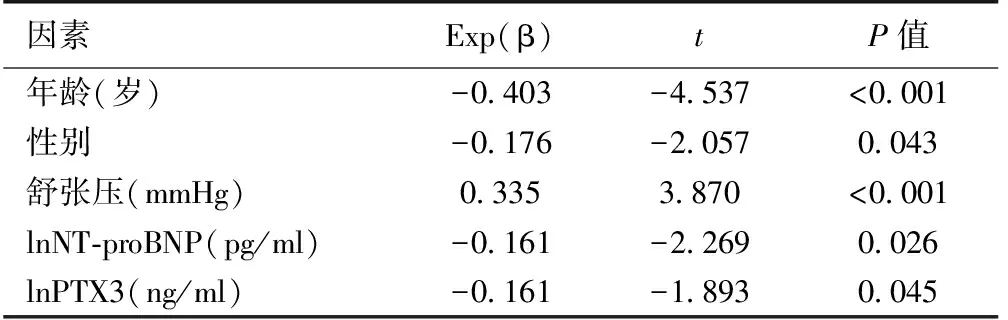
表2 多元逐步回归分析炎症指标与6MWD关系
ROC曲线评价PTX3对6MWD的诊断价值以PTX3=1.90 ng/ml为截点时,P=0.001,95%CI为0.598~0.806,ROC曲线下面积为0.702,PTX3评估PD6MWD的灵敏度为77.6%,特异度为55.3%(图1)。

图1 PTX3对腹膜透析患者6MWD的预测价值
讨 论
本研究探讨了炎症对PD患者6MWD的影响,研究结果显示PTX3与PD患者6MWD独立相关,提示系统性炎症显著影响PD患者的运动能力。
6MWT是一项简单易行的运动试验。2002年和2005年美国心脏病学会(ACC/AHA)慢性心力衰竭的诊断和治疗指南中推荐将6MWT作为评估慢性心力衰竭患者运动能力的一项指标[9]。近年研究发现,在血液透析(HD)患者中,6MWD与运动峰值耗氧量(pVO2)同样密切相关,Kohl等[10]通过检测HD患者的6MWT和pVO2指标发现,6MWD与pVO2显著相关。且6MWT在HD患者中的应用重复性好、可靠性高[11]。提示6MWT可用于评估ESRD患者的运动能力。我们前期的研究也显示6MWT与PD患者的全因死亡密切相关,可作为预测PD患者预后的一个指标[3]。
本研究发现炎症指标PTX3是PD患者6MWD的独立影响因素,提示炎症可显著影响PD患者的运动能力。与本研究结果相似,Anand等[12]采用最大活动得分(MAS)和校正活动得分(AAS)评估了296例刚开始接受透析治疗的患者的功能状态,发现,在进行多因素校正后,机体活动得分与C反应蛋白(CRP)成显著负相关,提示炎症状态可导致透析患者运动能力降低。机体的运动能力主要取决于骨骼肌的质量与功能。在炎症状态下,骨骼肌的分解加速,而且,炎症所造成的营养不良与心血管功能的受损都会影响骨骼肌的功能[8]。
PTX3是新近发现的一个炎症因子,与经典的短五聚体-CRP属于同一个超家族。但是与CRP不同的是,CRP是由肝细胞分泌的急性时相蛋白。而PTX3在肝脏外,由树突细胞、单核细胞、巨噬细胞、平滑肌细胞、成纤维细胞和内皮细胞分泌产生,反映系统性炎症,不受IL-6的影响。因此PTX3被认为是炎症性疾病的真正标志物。PTX3属于大分子物质(分子量40.6 kD),肾功能的下降会造成PTX3清除减少而滞留体内,此外,机体在内皮系统受损、心肌梗死及多种免疫性疾病中都会合成分泌大量的PTX3[13,14],所以PTX3的水平在慢性肾脏病(CKD)患者中明显升高,而且能够预测CKD 5期患者的死亡,且不受传统危险因素及CRP的影响[15]。PTX3可预测心力衰竭患者的预后[16]。Suzuki等[17]对196例心力衰竭患者前瞻性随访655d结果发现,PTX3水平与美国纽约心脏病协会分级(NYHA)密切相关,PTX3较高的患者心血管事件发生率要明显高于PTX3低的患者。Dubin等[18]对986例冠心病患者随访37月发现,基线log PTX3每增加1个单位,发生心力衰竭的风险增加80%,且不受肾功能及CRP的影响。在一项包括2 690例心力衰竭患者的研究中,Latini等[19]报道PTX3与NYHA成正相关,且能够预测心力衰竭再入院情况。动物研究发现,PTX3可通过细胞外信号调节激酶1/2(ERK1/2)及核因子κB(NF-κB)信号通路直接介导心肌细胞增生造成左室功能障碍[20]。PTX3与心功能密切相关,这可能也是本研究PTX3显著影响6MWD的原因之一。
PTX3能够促进动脉粥样硬化的发生发展。炎症刺激使巨噬细胞、内皮细胞等产生PTX3,参与动脉粥样硬化的发生过程[21]。动脉粥样硬化斑块中的内皮细胞、巨噬细胞、平滑肌细胞和泡沫细胞又能继续表达PTX3,加重斑块的发展[22]。以上研究都提示了PTX3可能为局部血管炎性反应和心血管系统损伤的标志物。在ESRD伴有外周血管疾病的患者中,PTX3明显升高[23]。PTX3较高患者的血管病变可能更严重,造成骨骼肌缺血缺氧,这可能也是PTX3影响PD患者6MWD的原因。
但是有些研究并未发现透析患者的运动能力受到炎症的影响[24]。这些研究所用的炎症因子多为CRP和IL-6,这与本研究结果也是相似的。在我们的分析中,CRP、IL-6与6MWD在单因素分析中有意义,但是经多因素校正后,这种相关性失去意义。但是我们引入了一个新的炎症指标PTX3,并且发现PTX3能够影响患者的6MWD。PTX3能独立于其他炎症指标影响PD患者的运动能力,可能是由于PTX3比CRP、IL-6能更好地反映系统性炎症,而且与内皮功能、动脉粥样硬化的关系更密切[25]。但是相关报道较少,还需要更多大样本的研究来证实。
综上所述,本研究结果提示PD患者6MWD受PTX3的影响,炎症与PD患者运动能力的关系值得进一步深入研究,通过减少PD患者的糖负荷、改善胰岛素抵抗、避免腹膜炎、保护残肾功能及应用新型透析液等来减轻全身性炎症可能会提高患者的运动能力。
1Johansen KL.Physical functioning and exercise capacity in patients on dialysis.Adv Renal Replace Ther,1999,6(2):141-148.
2Painter P.Physical functioning in end-stage renal disease patients:update 2005.Hemodial Int,2005,9(3):218-235.
3郑冬霞,方炜,倪兆慧,等.6分钟步行试验在腹膜透析患者中的应用及其对预后的影响.中华肾脏病杂志,2014,30(7):499-505.
4Gariballa SE,Sinclair AJ.Nutrition,aging and ill health.Br J Nutr,1998,80(1):7-23.
5Feroze U,Noori N,Kovesdy CP,et al.Quality-of-life and mortality in hemodialysis patients:roles of race and nutritional status.Clin J Am Soc Nephrol,2011,6(5):1100-1111.
6McMahon LP,McKenna MJ,Sangkabutra T,et al.Physical performance and associated electrolyte changes after haemoglobin normalization:a comparative study in haemodialysis patients.Nephrol Dial Transplant,1999,14(5):1182-1187.
7Faria Rde S,Fernandes N,Lovisi JC,et al.Pulmonary function and exercise tolerance are related to disease severity in pre-dialytic patients with chronic kidney disease:a cross-sectional study.BMC Nephrol,2013,14:184.
8Sietsema KE,Amato A,Adler SG,et al.Exercise capacity as a predictor of survival among ambulatory patients with end-stage renal disease.Kidney Int,2004,65(2):719-724.
9Hunt SA,Abraham WT,Chin MH,et al.ACC/AHA 2005 guideline update for the diagnosis and management of chronic heart failure in the adult:a report of the American College of Cardiology/American Heart Association Task Force on practice guidelines (writing committee to update the 2001 guidelines for the evaluation and management of heart failure):developed in collaboration with the American College of Chest Physicians and the International Society for Heart and Lung Transplantation:endorsed by the Heart Rhythm Society.Circulation,2005,112(12):e154-235.
10 Kohl Lde M,Signori LU,Ribeiro RA,et al.Prognostic value of the six-minute walk test in end-stage renal disease life expectancy:a prospective cohort study.Clinics (Sao Paulo),2012,67(6):581-586.
11 Overend T,Anderson C,Sawant A,et al.Relative and absolute reliability of physical function measures in people with-stage renal disease.Physiother Can,2010,62:122-128.
12 Anand S,Chertow GM,Johansen KL,et al.Association of Self-Reported Physical Activity with laboratory markers of nutrition and inflammation:the Comprehensive Dialysis Study.J Ren Nutr,2011,21(6):429-437.
13 Nauta AJ,de Haij S,Bottazzi B,et al.Human renal epithelial cells produce the long pentraxin PTX3.Kidney Int,2005,67(2):543-553.
14 Kanda R,Hamada C,Kaneko K,et al.Pentraxin 3 as a new biomarker of peritoneal injury in peritoneal dialysis patients.J Artif Organs,2013,16(1):66-73.
15 Tong M,Carrero JJ,Qureshi AR,et al.Plasma pentraxin 3 in patients with chronic kidney disease:associations with renal function,protein-energy wasting,cardiovascular disease,and mortality.Clin J Am Soc Nephrol,2007,2(5):889-897.
16 Matsubara J,Sugiyama S,Nozaki T,et al.Incremental prognostic significance of the elevated levels of pentraxin 3 in patients with heart failure with normal left ventricular ejection fraction.J Am Heart Assoc,2014,3(4):e000928.
17 Suzuki S,Takeishi Y,Niizeki T,et al.Pentraxin 3,a new marker for vascular inflammation,predicts adverse clinical outcomes in patients with heart failure.Am Heart J,2008,155(1):75-81.
18 Dubin R,Li Y,Ix JH,et al.Associations of Pentraxin-3 with Cardiovascular Events,Incident Heart Failure and Mortality Among Persons with Coronary Heart Disease:Data from the Heart and Soul Study.Am Heart J,2012,163(2):274-279.
19 Latini R,Gullestad L,Masson S,et al.Pentraxin-3 in chronic heart failure:the CORONA and GISSI-HF trials.Eur J Heart Fail,2012,14(9):992-999.
20 Suzuki S,Shishido T,Funayama A,et al.Long pentraxin PTX3 exacerbates pressure overload-induced left ventricular dysfunction.PLoS One,2013,8(1):e53133.
21 Wang AY.Cardiovascular risk factors in peritoneal dialysis patients revisited.Perit Dial Int,2007,27(Suppl 2):s223-227.
22 Klouche M,Peri G,Knabbe C,et al.Modified atherogenic lipoproteins induce expression of pentraxin-3 by human vascular smooth muscle cells.Atherosclerosis,2004,175(2):221-228.
23 Boehme M,Kaehne F,Kuehne A,et al.Pentraxin 3 is elevated in haemodialysis patients and is associated with cardiovascular disease.Nephrol Dial Transplant,2007,22(8):2224-2229.
24 Zamojska S,Szklarek M,Niewodniczy M,et al.Correlates of habitual physical activity in chronic haemodialysis patients.Nephrol Dial Transplant,2006,21(5):1323-1327.
25 Zhou Y,Ni Z,Zhang J,et al.Plasma pentraxin 3 may be a better marker of peripheral artery disease in hemodialysis patients than C-reactive protein.Vasc Med,2013,18(2):85-91.

