牡丹雄蕊多糖的提取工艺研究
周远明,刘 帅,郑国生,马传利,史美丽
(青岛农业大学,山东青岛266109)
牡丹(Paeonia suffruticosa Andr.)为芍药属木本植物,其根皮即牡丹皮是一种重要的中药材,俗称“丹皮”,药效显著,研究较多[1-9]。我国民间有将牡丹雄蕊制成雄蕊茶饮用的习惯,因其具有降糖、降血脂和降血压等效果,也逐渐引起了人们的关注。
多糖是牡丹中重要的化学成分之一,在机体免疫调节、降血糖、抗衰老等方面有较强活性[10]。目前尚未见牡丹雄蕊多糖的研究报道。作者在此采用热水法从牡丹雄蕊中提取多糖,并对提取工艺进行研究,以期为开发利用牡丹雄蕊多糖提供参考。
1 实验
1.1 材料、试剂与仪器
牡丹雄蕊,采集于青岛农业大学牡丹园,经青岛农业大学郑国生教授鉴定品种为“凤丹”。
石油醚、乙醇、浓硫酸、葡萄糖、丙酮、苯酚、乙醚等试剂均为分析纯。
微型植物粉碎机,天津泰斯特;超低温冰箱,日本SANYO;电子天平,德国Sartorius;恒温水浴锅,上海森信;超声细胞破碎仪,德国Hielscher;RE-52型旋转蒸发仪,上海亚荣;循环水式真空泵,浙江黄岩求精真空泵厂;U-2900型紫外可见分光光度计,日本HITACHI;高速离心机,Eppendorf。
1.2 标准曲线的绘制[11]
准确移取0.00mL、0.20mL、0.40mL、0.60 mL、0.80mL、1.00mL、1.20mL、1.40mL、1.60mL的0.04mg·mL-1的葡萄糖标准溶液,分别置于10 mL试管中,加入适量蒸馏水至2.0mL,各加5%苯酚溶液1.0mL,振荡摇匀后滴加浓硫酸5.0mL,静置10min,摇匀,室温放置20min,于波长490nm处测定吸光度。以吸光度A为纵坐标、葡萄糖浓度c(μg· mL-1)为横坐标绘制标准曲线,拟合得回归方程:A=0.0139c-0.0117(R2=0.9983)。
1.3 牡丹雄蕊多糖的提取
1.3.1 工艺流程
牡丹雄蕊→阴干、粉碎→超声-冻融法破壁→石油醚脱脂→80%乙醇除还原糖和寡糖→热水提取→浓缩→95%乙醇沉淀→4 800r·min-1离心→沉淀冷冻干燥→粗多糖。
1.3.2 提取方法
1)牡丹雄蕊破壁:收集未散粉的牡丹雄蕊200g,阴干,粉碎,过40目筛。向牡丹雄蕊中加入10BV的蒸馏水,搅拌,置于超低温(-80℃)冰箱中冷冻12h。然后投入80℃水浴锅中水浴1h,解冻;再经200W超声处理20min。以上过程再重复2次,真空干燥,粉碎,得破壁牡丹雄蕊。
2)牡丹雄蕊脱脂:取破壁牡丹雄蕊,加600mL石油醚于60℃回流提取6h,重复1次,抽滤,所得固体为脱脂破壁牡丹雄蕊。
3)牡丹雄蕊除还原糖、寡糖:向脱脂破壁牡丹雄蕊中加入80%乙醇600mL,于85℃回流提取6h,重复1次,抽滤,所得固体真空干燥,得到除还原糖、寡糖和脱脂的破壁牡丹雄蕊(即处理后雄蕊)。
4)牡丹雄蕊多糖的提取:取处理后雄蕊1.0g,加15mL蒸馏水于90℃提取2h,提取2次;合并提取液,过滤,滤液减压浓缩;浓缩液加入3BV的95%乙醇,过夜沉淀;于4 800r·min-1离心10min,弃上清液,沉淀冷冻干燥,即得牡丹雄蕊粗多糖。
1.4 牡丹雄蕊多糖提取率的测定
取牡丹雄蕊粗多糖溶于100mL蒸馏水中,取2.50mL溶液至25mL容量瓶中,定容。取1.0mL上述溶液置于10mL试管中,按1.2方法测定吸光度,由回归方程求得多糖质量。多糖提取率按下式计算:

2 结果与讨论
2.1 单因素实验结果与分析
2.1.1 提取温度对牡丹雄蕊多糖提取率的影响(图1)
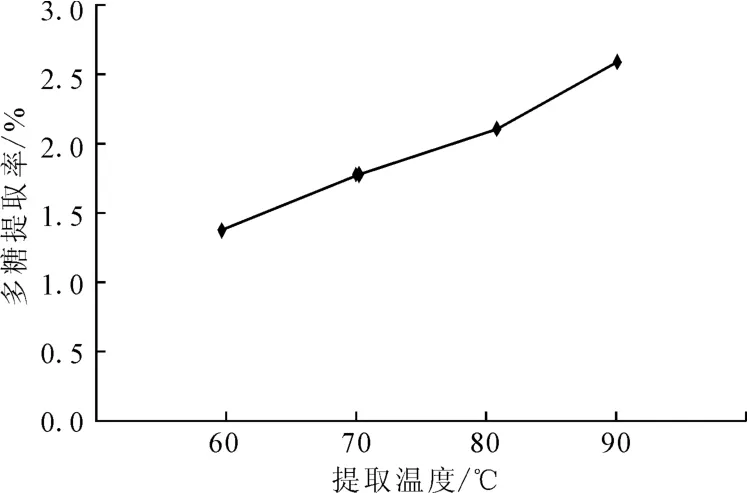
图1 提取温度对多糖提取率的影响Fig.1 The effect of extraction temperature on extraction rate of polysaccharides
由图1可知,牡丹雄蕊多糖的提取率随提取温度的升高而增大。由于多糖是活性物质,提取温度过高可能破坏其结构,影响其生物活性;且提取温度越高,能耗越大。因此,初步选择提取温度为90℃。
2.1.2 料液比对牡丹雄蕊多糖提取率的影响(图2)
由图2可知,随着热水用量的增加,牡丹雄蕊多糖的提取率先增大后减小;当料液比(g∶mL,下同)为1∶20时达到最大值,考虑到热水用量过多会使提取液浓缩的能耗增大、时间延长,对多糖结构产生不利影响,而料液比为1∶15时多糖提取率已经较高,因此,初步选择料液比为1∶15。

图2 料液比对多糖提取率的影响Fig.2 The effect of solid-liquid ratio on extraction rate of polysaccharides
2.1.3 提取时间对牡丹雄蕊多糖提取率的影响(图3)
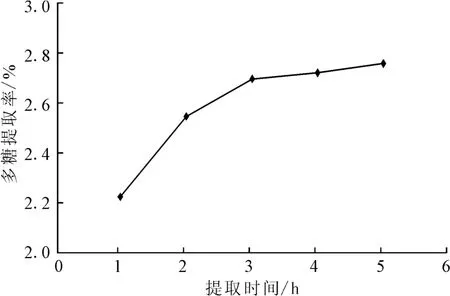
图3 提取时间对多糖提取率的影响Fig.3 The effect of extraction time on extraction rate of polysaccharides
由图3可知,随着提取时间的延长,多糖提取率不断增大:提取1~2h时提取率增加迅速,之后增幅趋缓,3h后多糖提取率增加不明显。考虑到提取时间过长可能会破坏多糖的结构,同时效率降低、能耗增大,因此,初步选择提取时间为3h。
2.1.4 提取次数对牡丹雄蕊多糖提取率的影响(图4)
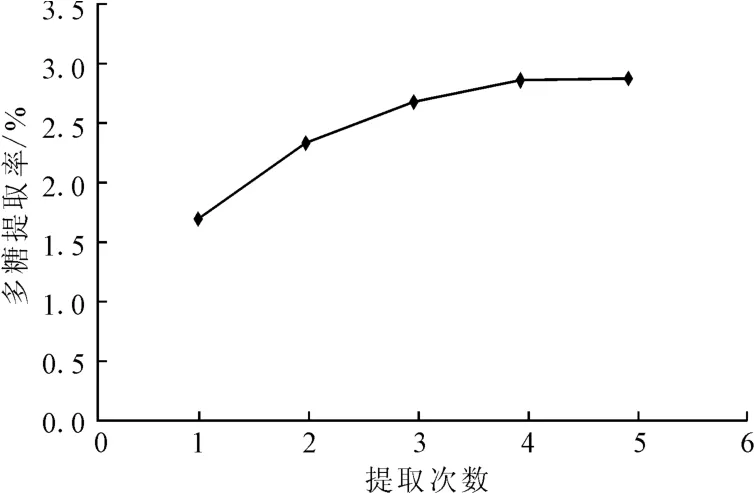
图4 提取次数对多糖提取率的影响Fig.4 The effect of extraction times on extraction rate of polysaccharides
由图4可知,提取次数增加,牡丹雄蕊多糖提取率增大;但提取3次之后,牡丹雄蕊多糖提取率增加缓慢,表明多糖已基本浸出。由于提取次数的增加会使后续的浓缩能耗增大而增加成本,因此,初步选择提取3次。
2.2 正交实验结果与分析
在单因素实验的基础上,以提取温度(A)、料液比(B)、提取时间(C)、提取次数(D)为考察因素,以牡丹雄蕊多糖提取率为考察指标,进行L9(34)正交实验以优化提取工艺条件,正交实验的结果与分析见表1。
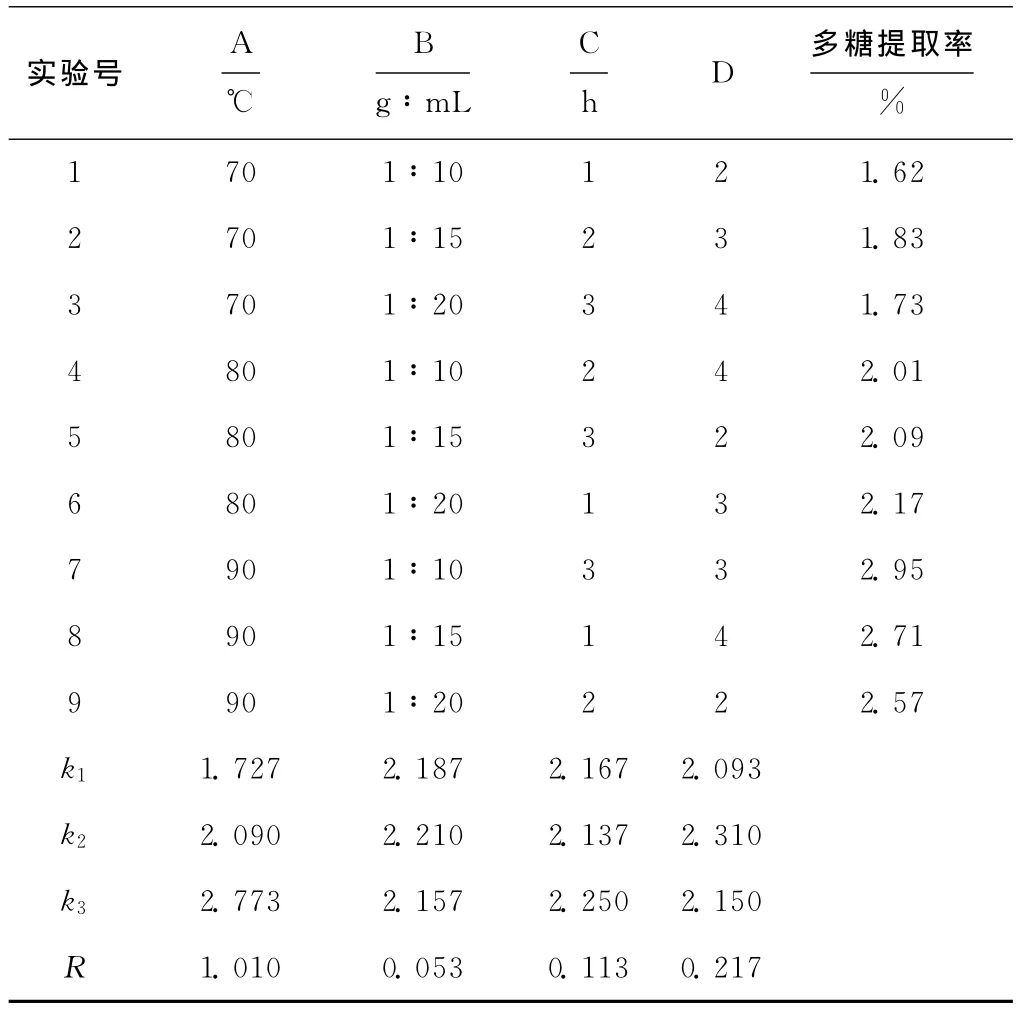
表1 正交实验结果与分析Tab.1 The results and analysis of orthogonal experiment
由表1可知,各因素对牡丹雄蕊多糖提取率的影响大小依次为:提取温度>提取次数>提取时间>料液比,最佳提取工艺为A3B2C3D2,即提取温度90℃、料液比1∶15、提取时间3h、提取3次。
在最佳提取工艺条件下进行验证实验,牡丹雄蕊多糖提取率为3.06%,高于正交实验的最高提取率,表明所确定优化工艺条件有效。
3 结论
采用热水法浸提牡丹雄蕊多糖,通过正交实验确定最佳提取条件为:提取温度90℃、料液比1∶15(g∶mL)、提取时间3h、提取3次,在此条件下,牡丹雄蕊多糖提取率为3.06%。
[1] CHOU T C.Anti-inflammatory and analgesic effects of paeonol in carrageenan-evoked thermal hyperalgesia[J].British Journal of Pharmacology,2003,139(6):1146-1152.
[2] DU Q,FENG G Z,SHEN L,et al.Paeonol attenuates airway inflammation and hyperresponsiveness in a murine model of ovalbumin-induced asthma[J].Canadian Journal of Physiology and Pharmacology,2010,88(10):1010-1016.
[3] 高健,相海鹰,许同桃,等.丹皮酚及其席夫碱衍生物的抑菌性研究[J].化学试剂,2007,29(1):59-60,62.
[4] 孙国平,沈玉先,张玲玲,等.丹皮酚对HepA荷瘤小鼠免疫调节和抑瘤作用研究[J].中国药理学通报,2003,19(2):160-162.
[5] 计春燕,谭诗云,刘长青.丹皮酚对人大肠癌细胞凋亡和细胞周期以及患者预后的影响[J].中国临床康复,2005,9(6):122-124.
[6] 周军,周丽,侯德仁,等.丹皮酚对Aβ诱导的AD模型大鼠脑细胞凋亡因子的影响及作用机理[J].中药材,2011,34(5):758-762.
[7] XIAO K,SONG Q H,ZHANG S W,et al.A pyrrole derivative fromPaeonia suffruticosa[J].Natural Product Research,2008,22(18):1614-1619.
[8] 李世朋,张培哲,张露露,等.芍药苷对阿尔茨海默病模型大鼠学习记忆能力的影响[J].时珍国医国药,2012,23(12):3035-3036.
[9] 刘洋,崔广智,张艳军,等.芍药苷对皮质酮损伤大鼠皮层神经元的预防性保护作用[J].中国中药杂志,2010,35(2):208-210.
[10] 洪浩,王钦茂,赵帜平,等.丹皮多糖-2b对2型糖尿病大鼠的抗糖尿病作用[J].药学学报,2003,38(4):255-259.
[11] 宋棋芬,徐茂义,黄越燕.复方桑黄颗粒中总多糖提取工艺研究[J].亚太传统医药,2012,8(9):41-43.

