一株枯草芽孢杆菌对芘的降解特性及代谢途径的研究
姚 俊,喻 婵,靳竞男
(北京科技大学土木与环境工程学院环境与能源国际合作基地,北京100083)
多环芳烃(polycyclic aromatic hydrocarbons,PAHs)是常见的一类环境污染物[1-2],广泛分布于水体、空气及土壤中。由于其在环境中的半衰期较长和致癌、致畸、致突变的性质而日益受到人们的重视[3]。PAHs具有较低的水溶性[4],高分子量的PAHs在环境中的存留时间较长,导致这类化合物在环境中很难被去除[5]。美国环保局在20世纪80年代初将16种未带分支的PAHs确定为环境中的优先控制污染物[6]。利用微生物去除环境中的PAHs因费用低、易操作及不造成二次污染而逐渐成为研究热点[7]。
作者从大港油田原油样品中筛选获得1株可以以芘(代表性PAHs)作为唯一碳源和能源进行生长的菌株,对其降解特性和降解产物进行了测定,进一步提出了该菌株对芘的降解代谢途径。
1 实验
1.1 样品及培养基
原油样品取自大港油田港西区块58-8-3#油井。
无机盐培养基(g·L-1)[8]:(NH4)2SO43,KH2PO40.5,Na2HPO4·12H2O 1.26,MgSO4· 7H2O 0.54,FeCl3·6H2O 0.05,FeSO4·7H2O 0.03,MnSO4·H2O 0.015,ZnSO4·7H2O 0.024,CoCl2· 6H2O 0.366,调节pH值至7.2~7.4。固体培养基中添加2%的琼脂,121℃灭菌30min。
LB培养基(g·L-1):胰蛋白胨10,酵母粉5,NaCl 10,调节pH值至7.0。固体培养基中添加2%的琼脂,121℃灭菌30min。
1.2 菌种筛选
将样品以2%的接种量接种于以芘为唯一碳源的无机盐培养基中,好氧条件下于28℃、180r·min-1摇床培养7d,相同条件下转接1次。采用稀释涂平板法涂于以芘为唯一碳源的无机盐固体培养基上,于28℃恒温摇床培养7d形成单菌落。挑取生长迅速、边缘整齐的菌落接入无机盐培养基中,摇瓶复筛,得到目的菌株。
1.3 芘降解菌株的鉴定
将目的菌株在28℃LB培养基中振荡培养至对数生长期,取1.5mL培养液以12 000r·min-1离心,收集菌体。采用OMEGA公司提供的细菌基因组DNA小量快速提取试剂盒提取该菌株的总DNA,将其置于-20℃保存,备用。
以总DNA为模板,采用引物27F(5′-AGAGTT TGATCCTGGCTCAG-3′)和1492R(5′-GGTTACCTTGTTACGACTT-3′)[9]进行PCR扩增。反应体系20μL,其中PCR mix 10μL,总DNA 0.5μL,正、反引物各0.4μL,ddH2O 8.7μL。PCR扩增程序为:94℃预变性5min;94℃变性30s,56℃退火30s,72℃延伸90s,35个循环;最后72℃延伸10min。PCR产物经过纯化后,进行琼脂糖凝胶电泳。
16SrDNA序列由华大基因公司测定。测定结果在GenBank上与已知种属的16SrDNA序列进行Blast比对[10],利用Mega4对获得的同源性序列进行分析并构建系统进化树。
1.4 菌株生长曲线的测定
目的菌株经LB液体培养基活化后,取1mL菌液接种于芘浓度为100mg·L-1的50mL无机盐培养基中进行培养,待OD600≈0.25时,以2%的接种量接入以芘为唯一碳源的无机盐培养基中,于28℃、180r ·min-1进行培养,每个样品做3个平行,以未接菌株的无机盐培养基为空白,每2d测1次OD600。
1.5 芘降解率的测定
活化菌株在芘浓度为100mg·L-1的培养基中进行培养,待OD600≈0.25时,以2%的接种量接入以芘为唯一碳源的无机盐培养基中,于28℃、180r· min-1进行培养。取5mL正己烷与5mL菌液混合,超声数分钟后,静置约10min分层。收集上层有机相和下层水相。重复此操作2次,合并有机相,弃下层水相。将有机相过无水硫酸钠柱除去水分,蒸发浓缩至2mL,进行GC-MS分析。
1.6 芘降解代谢产物的测定
GC-MS条件:进样口无分流模式,温度250℃,HP-5弹性石英毛细管色谱柱(30m×0.25mm,0.25 μm),柱子流量为1.1mL·min-1,炉温60℃保持1 min,以15℃·min-1升到150℃保留1min,再以6℃·min-1升到320℃保留10min。进样口和检测器的温度分别为250℃和300℃。载气(氦气)流速为1.1mL·min-1。空白样品为未接菌的样品。
2 结果与讨论
2.1 菌株的鉴定
经过富集、驯化及纯化,筛选得到1株芘降解菌株,命名为USTB-Y。菌体形态为杆状,菌落呈圆形,边缘呈锯齿状,中间凸起,乳黄色,表面光滑,湿润。
将测得的16SrDNA序列在GenBank中进行Blast比对,获得的同源性序列均为Bacillus属,其中与Bacillus amyloliquefaciens strain BC7的同源性高达97%。进一步构建系统进化树,确定该菌株在所属种属中的亲缘关系,如图1所示。

图1 芘降解菌USTB-Y的系统进化树Fig.1 Phylogenetic positions of USTB-Y on 16SrDNA analysis
从图1可以看出,USTB-Y和Bacillus amyloliquefaciens strain BC7的亲缘关系最近,可以推断此菌株属于芽孢杆菌属。
2.2 菌株USTB-Y对芘的降解特性(图2)

图2 菌株USTB-Y的生长曲线及芘降解率随时间变化曲线Fig.2 The growth curve of strain USTB-Y and the variation curve of pyrene degradation rate with time
从图2可以看出,菌株USTB-Y在以芘为唯一碳源的无机盐培养基中生长经历延迟期、对数期、稳定期及衰亡期这4个时期,在第8d时生长速率达到最快,OD600值为0.206,较以LB为培养基时的生长速率慢,可能是由于无机盐培养基是一种缺陷型培养基,细菌在此培养基中生长能力较差。
从图2还可以看出,菌株USTB-Y逐渐降解芘,在16d时对芘的降解率高达约56%,由于此时培养基中的菌株大部分处于衰亡期,所以基本认为测定的降解率为最高。表明,USTB-Y是1株能够有效降解芘的菌株。
2.3 芘降解代谢产物的测定
通过GC-MS分析,检测到菌株USTB-Y对芘的降解过程中产生的一系列代谢产物,如图3所示。
从图3可以看出,检测到的代谢产物有1-羟基芘、芘酮、邻苯二甲酸酯和1-羟基苯。
根据所检测到的代谢产物,参考Bacillus amyloliquefaciens strain BC7,推测菌株USTB-Y降解芘可能存在的代谢途径,如图4所示。
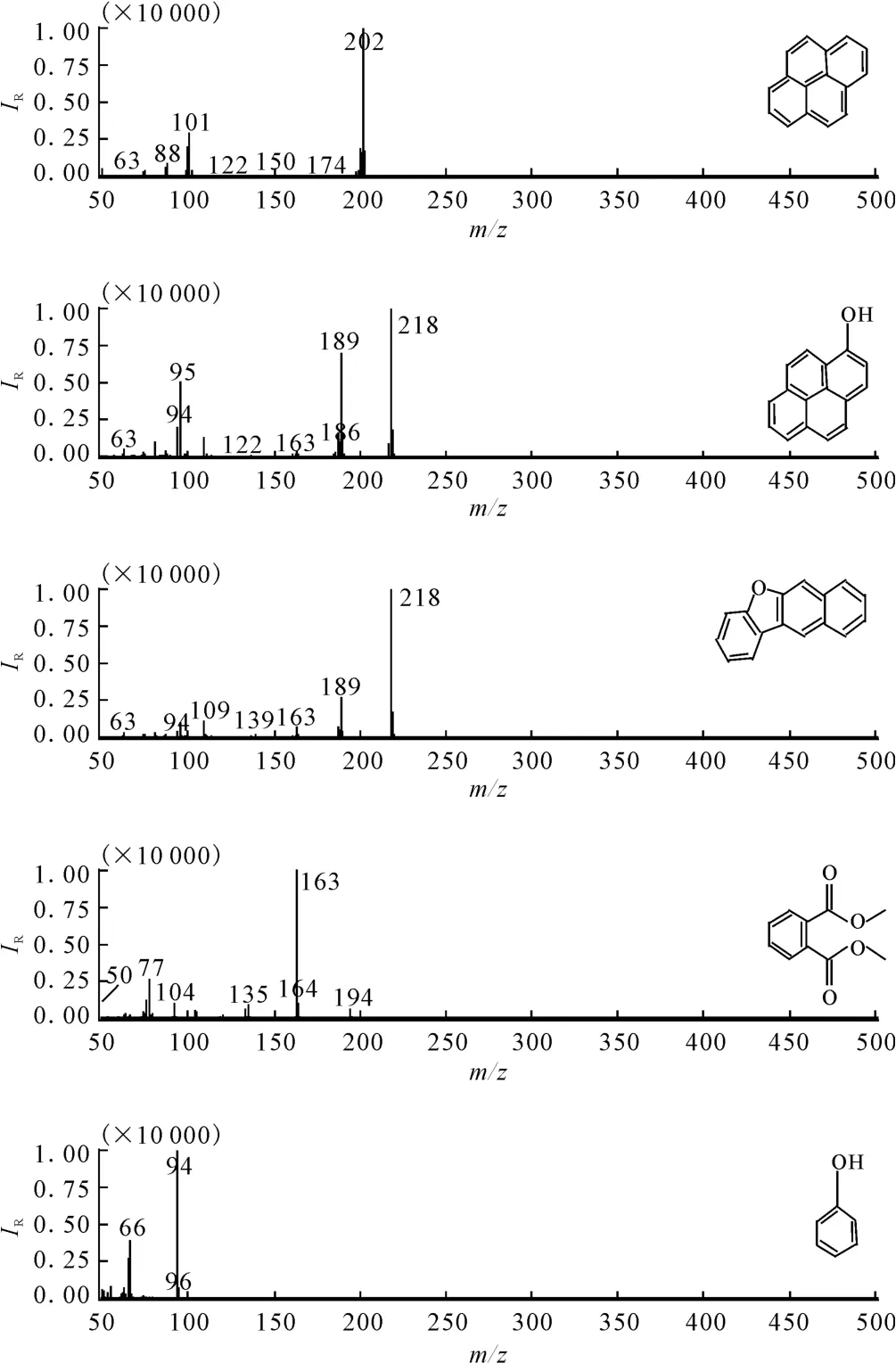
图3 菌株USTB-Y降解芘的代谢产物Fig.3 The metabolites formed from pyrene utilization by strain USTB-Y
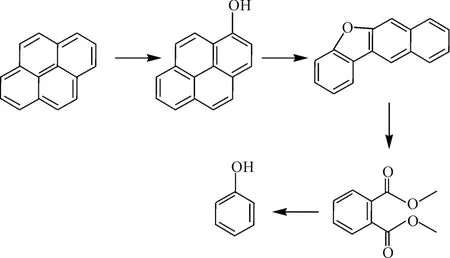
图4 菌株USTB-Y降解芘的可能代谢途径Fig.4 Proposed pathway for the degradation of pyrene by strain USTB-Y
从图4可以看出,菌株USTB-Y以芘为唯一碳源和能源进行生长的过程中,芘的芳香环上4位的碳首先受到单加氧酶或双加氧酶的攻击,形成水二醇;进一步转化为1-羟基芘,接着转化为芘酮或其它代谢产物;再进一步降解形成邻苯二甲酸酯,转化为邻苯二甲酸,最终进入三羧酸循环被完全降解。
3 结论
自大港油田港西区块58-8-3#油井原油样品中筛选得到1株能以芘为唯一碳源和能源生长的菌株USTB-Y。形态鉴定及16SrDNA鉴定表明,此菌株属于芽孢杆菌属,与Bacillus amyloliquefaciens strain BC7的同源性高达97%。对其生长曲线及对芘的降解率测定表明,在以芘为唯一碳源的无机盐培养基中培养16d后,芘的降解率高达56%,被认为是对芘具有高效降解效果的菌株。进一步对菌株USTB-Y降解芘的代谢产物进行测定,提出了该菌株降解芘的可能代谢途径。
[1] 仉磊,袁红莉.一株菲降解细菌的分离及特性[J].环境科学,2005,26(1):159-163.
[2] WILCKE W.Polycyclic aromatic hydrocarbon(PAHs)in soil—A review[J].Journal of Plant Nutrition and Soil Science,2000,163:229-248.
[3] 吉云秀,邵秘华.多环芳烃的污染及其生物修复[J].交通环保,2003,24(5):33-36.
[4] BALBA M T,AWADHI A N,DAHER A R.Bioremediation of oil contaminated soil:Microbiological methods for feasibility assessment and field evaluation[J].Journal of Microbial Methods,1998,32(2):155-164.
[5] LI X W,LIU Z P.Mircobiol biodegradation of petroleum hydrocarbons[J].Acta Microbiology Sin,2002,42(6):764-767.
[6] MUSAT F,GALUSHKO A,JACOB J,et al.Anaerobic degradation of naphthalene and 2-methylnaphthalene by strains of marine sulfate-reducing bacteria[J].Environmental Microbiology,2009,11(1):209-219.
[7] 邹德勋,骆永明,滕应,等.多环芳烃长期污染土壤的微生物强化修复初步研究[J].土壤,2006,38(5):652-656.
[8] 崔俊华,金文彪,孙宏量.高效石油降解菌筛选驯化研究[J].上海环境科学,2002,20(6):283-285.
[9] YUAN H Y,YAO J,MASAKORALA K,et al.Isolation and characterization of a newly isolated pyrene-degrading Acinetobacter strain USTB-X[J].Environmental Science and Pollution Research,2013,21(4):2724-2732.
[10] HADIBARATA T,KRISTANTI R A.Biodegradation and metabolite transformation of pyrene by basidiomycetes fungal isolate Armillaria sp.F022[J].Bioprocess and Biosystem Engineering,2013,36(4):461-468.

