交联于蛋膜上的纳米颗粒增强的尿酸酶生物传感器
曹淑超
(河南省气象科学研究所,河南郑州 450003)
0 引言
随着生命科学的发展进入分子水平,有人预言21世纪将是检验医学的世纪,即从分子水平对疾病进行诊断和治疗。这就要求临床生物化学检验准确、快速、简便、标本微量化、方法标准化、且经济实用。生物传感器正是在此要求下出现的一类跨领域、多学科的前沿诊断仪器。国内外对生物传感器展开了广泛深入地研究,已经研制出了葡萄糖生物传感器、乳糖生物传感器、尿酸酶生物传感器、DNA生物传感器、BOD生物传感器、测酚生物传感器等多种类别的生物传感器,来满足人们在临床检验、气象环境监测和生化分析等领域中的需求[1-9]。
目前研制出的传感器存在着各种各样的弊端,难于从根本上提高其稳定性、选择性、灵敏度、准确度和响应速度等性能。因此,寻找新材料、新方法制备电流响应值高生物传感器,例如引入纳米颗粒来增强传感器的各项性能指标是研究的重要方向[10-14]。
鸡蛋膜厚约7 μm,含有约90%的蛋白质,是半透性膜。用蛋膜制备酶电极是一种简单、经济的方法,且因为酶未直接涂覆在电极上,电极更新方便;选用蛋膜来制备酶膜,为今后制备一次性酶试纸条提供了一个方向。
实验将纳米二氧化硅凝胶和尿酸酶紧贴于蛋膜上,将酶膜紧贴于普鲁士蓝(PB)修饰的玻碳电极表面,然后以自制铂片电极为对电极、甘汞电极为参比电极,组成三电极体系,制成尿酸酶生物传感器。当体液中的尿酸通过酶膜时,与酶进行反应,检测出该处产生的反应电流,然后将其换算成尿酸浓度加以显示。应用尿酸酶传感器测定人体血和尿中尿酸的浓度,是一种准确、快速、简便的方法,可帮助诊断肾炎、白血病和肿瘤等疾病。
1 尿酸酶生物传感器的工作原理
尿酸酶生物传感器的工作原理是:尿酸在尿酸酶作用下,被分子氧氧化成尿囊素,并产生二氧化碳和过氧化氢。根据反应前后氧的消耗,用电极监测溶液中氧的变化,就可推算出尿酸的浓度,其工作机理如图1所示。
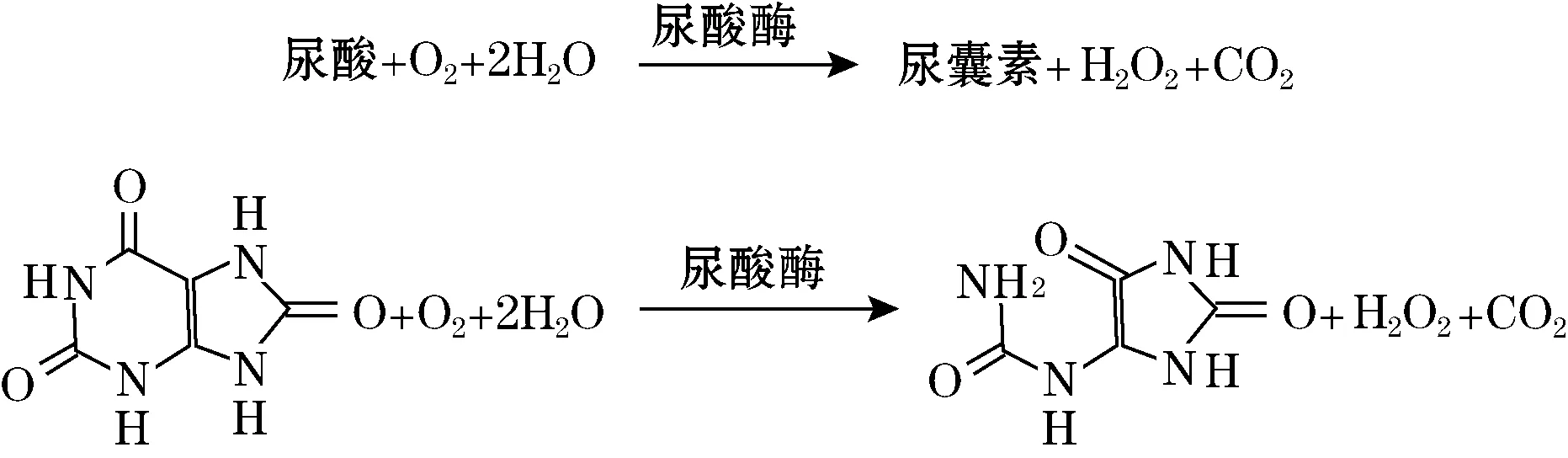
图1 尿酸在尿酸酶作用下的反应机理
2 实验部分
2.1仪器与试剂
仪器:玻碳电极(天津兰力天仪器有限公司),铂电极(自制,铂片长×宽×厚为5 mm×4 mm×0.25 mm),甘汞电极(上海雷磁),CHI600型电化学工作站(上海辰华仪器有限公司)。
试剂:尿酸酶(4.6 units/mg,Sigma公司),尿酸(国药集团化学试剂有限公司),牛血清白蛋白(BR),戊二醛(CP),磷酸氢二钠,磷酸二氢钾(AR),氯化钠(AR),正硅酸乙酯,鸡蛋,气透膜,改性纳米二氧化硅(自制),实验用水为二次蒸馏水。
2.2尿酸酶电极的制备
取新鲜鸡蛋壳小心剥离蛋膜,依次用NaCl溶液、蒸馏水清洗;称取12.5 mg牛血清白蛋白(BSA)溶于250 μL 10 g/L尿酸酶溶液中;将蛋膜平铺于洁净的玻片上,小心裁取直径为1 cm的圆形膜;在膜上依次滴加25 μL尿酸酶-牛血清白蛋白混合溶液、改性纳米二氧化硅凝胶液、5 μL 2%戊二醛溶液,室温放置3~4 h,置4 ℃冰箱冷藏过夜;过夜后的蛋膜用磷酸缓冲液(PBS)漂洗数次;将酶膜紧贴于PB修饰的玻碳电极表面,覆盖气透膜,即制成尿酸酶电极[15-16]。
实验流程如图2所示。
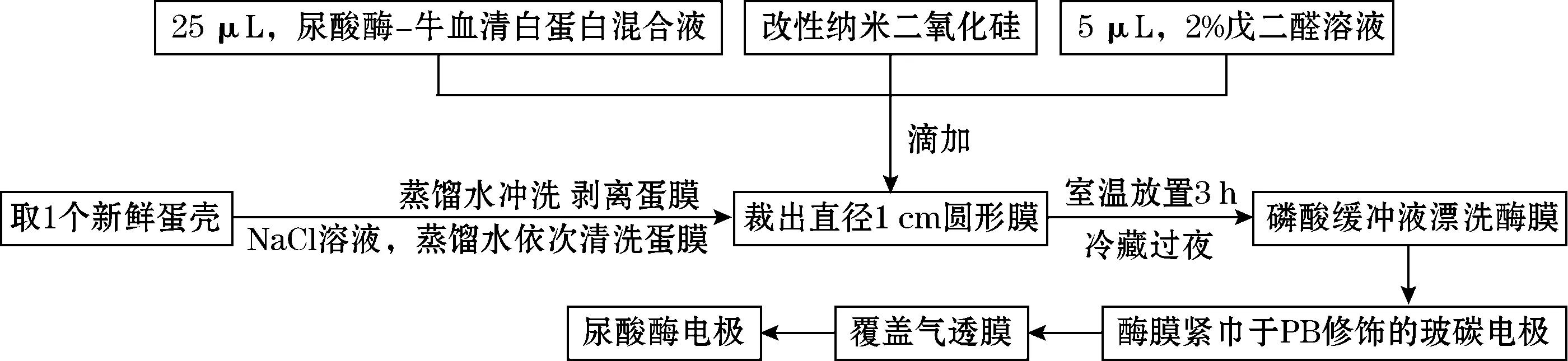
图2 纳米颗粒增强的尿酸酶电极制作示意图
2.3实验方法
采用三电极体系进行检测:制作的尿酸酶电极为工作电极,自制铂片电极为对电极,饱和甘汞电极为参比电极,底液为0.1 mol/L的KCl 磷酸盐缓冲溶液,在一定的温度下进行检测。测量时,先将三电极置于缓冲溶液中,加一电压于工作电极(0.4 Vvs SCE),当背景电流值减小至一恒定值时,将电极放至被测尿酸溶液中,分别记录不同时间的电流响应值,扣除初始背景电流值,即为被测尿酸浓度的电极电流响应值。
3 影响因素分析
3.1尿酸酶量的影响
电极上固定的酶量对传感器的响应有显著影响。随着酶固定量的增加,灵敏度增大,但线性范围略有缩小。这是因为电极上固定的酶量多时,催化尿酸反应的速度就快,此时产生的过氧化氢不能及时在电极表面被还原,从而使线性范围变窄。综合考虑灵敏度、线性范围及经济因素,最终选择每支电极固定1.5 U的尿酸酶。
3.2尿酸浓度的影响
测量不同浓度尿酸的响应信号,使得电极响应与尿酸浓度呈良好的线性关系,酶电极在不同浓度的尿酸中的循环伏安如图3所示。a为112.5 μg/mL;b为75 μg/mL;c为37.5 μg/mL;d为7.5 μg/mL;e为0 μg/mL确定尿酸酶生物传感器检测尿酸浓度的线性响应范围,如图4 所示。实验测定尿酸浓度的线性响应范围为7.5~112.5 μg/mL.在pH 6.5的缓冲溶液中,对37.5 μg/mL的尿酸进行平行测定11次,测得RSD为2.5%,表明重现性较好。
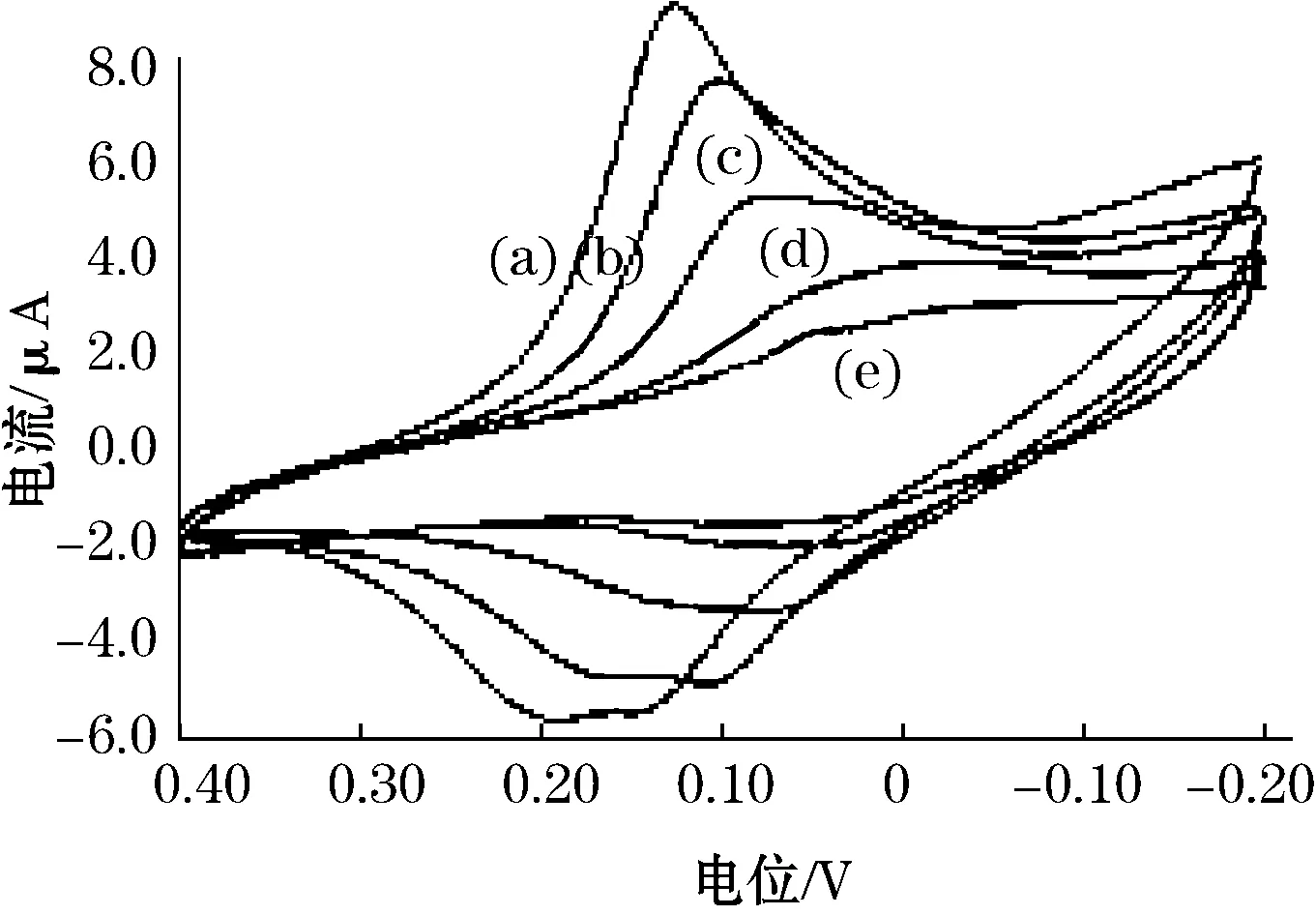
图3 酶电极在不同浓度的尿酸中的循环伏安图
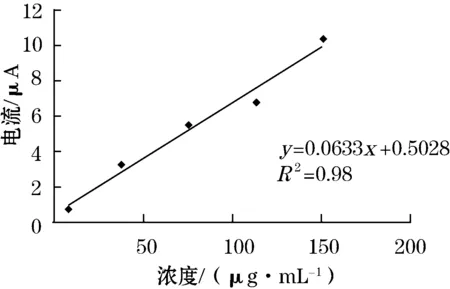
图4 尿酸浓度与响应电流线性关系图
3.3纳米二氧化硅的影响
酶电极的性能是由酶的催化活性、酶活性中心和导电基质之间电子交换速率决定的。纳米颗粒比表面积大、表面自由能高,吸附能力较强,把纳米颗粒引入到传感器研究中,可以使更多的酶分子固定在纳米颗粒表面。另外,由于纳米颗粒尺寸很小,有可能与酶内部的FAD亲水基团发生作用,从而引起酶构型上的变化。这种变化使得酶的活性中心FAD更接近底物,提高了酶的催化效率。改性纳米SiO2颗粒对生物分子具有很好的选择吸附性,可望实现纳米颗粒与酶分子活性中心及电极之间的直接电化学作用,增强生物传感器的灵敏度。该实验对添加纳米二氧化硅凝胶、添加改性的纳米二氧化硅凝胶所制备的尿酸酶生物传感器进行了比较,如图5所示。实验证明添加改性的纳米二氧化硅有增强电流响应信号的作用。
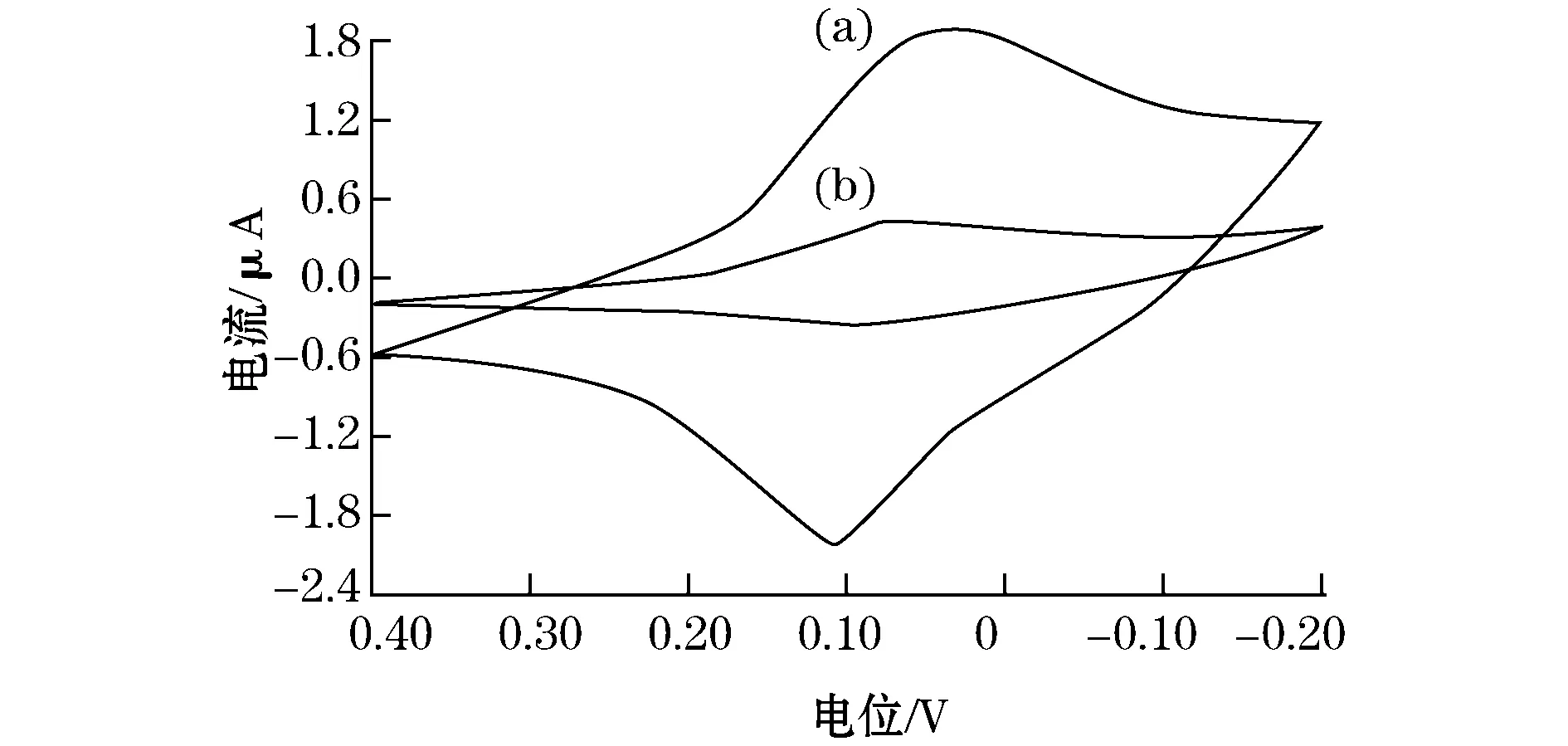
图5 添加改性纳米SiO2凝胶(a)与添加未改性纳米的SiO2凝胶(b)的循环伏安图
3.4缓冲溶液pH值的影响
缓冲溶液pH值对酶催化反应速率和酶的活性有较大影响。尿酸酶最适宜pH范围较宽。综合考虑酶的活性以及响应电流的最大的灵敏度,选择最适宜的pH值为6.5。
3.5温度的影响
温度的变化将影响酶的活性及酶催化反应速率。在10~35 ℃范围内考察氧化峰电流与温度的关系,发现氧化峰电流随温度的升高而增大。考虑温度较高时酶易变性失活,选择最适宜的温度25 ℃.
3.6工作电极的影响
将酶膜分别固定在铂电极、玻碳电极、石墨电极上,观察响应电流的灵敏度,选择最适宜的固定电极-玻碳电极进行实验。
3.7干扰试验
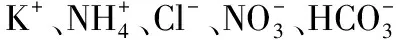
4 结束语
该方法研制的尿酸酶生物传感器具有操作简单、分析速度快、灵敏度高、所需试样少的特点,通过进一步研究后,有望应用于临床,帮助诊断肾炎、白血病和肿瘤等疾病。
参考文献:
[1]潘涛.生物传感器的概述和研究进展.江苏广播电视大学学报,2002,6(12):55-56.
[2]姚学鹏,刘绍琴.生物传感器用于农药残留检测的研究进展:现状,挑战及未来展望.食品安全质量检测报,2013,4(1):54-60.
[3]王明珠,徐斐,曹慧,等.用于农药残留快速检测的酶生物传感器研究进展.传感器与微系统,2012,31,3(3):4-7.
[4]习霞,明亮.基于壳聚糖/SiO2杂化膜固定酪氨酸酶生物传感器测定水中苯酚.冶金分析,2010,30(5):1-5.
[5]冯东,李雪梅,王丙莲,等.冷却肉中糖原的生物传感器检测.
食品科技,2003,38(3):252-255.
[6]王会友,王涛,王振宇,等.固定化小麦酯酶生物传感器的制备及应用.食品工业科技,2011,32 (3):385-389.
[7]韩文彪,蔡谨,石瑞,等.葡萄糖氧化酶生物传感器的构建和性能研究.齐鲁药事,2012,31(6):311-315.
[8]刘亚欣,姚玉峰,黄博,等.基于组织液超滤提取的MEMS血糖检测传感器.纳米技术与精密工程,2013,11(3):202-210.
[9]ANTIOCHIA R,MOVASSAGHI K,LIPON P,et al.Determination of the Antioxidant Capacity of Different Types of Bread and Flour Using a Superoxide Dismutase Biosensor.J.Chem.Chem.Eng.,2012,6:199-208.
[10]PANG Y,ZENG Guangming,TANG Lin,et al.Lassase biosensor using magnetic multiwalled carbon nanotubes and chitosan/silica hybrid membrane modified magnetic carbon paste electrode.J.Cent.South Univ.Technol,2011,18:1849-1856.
[11]李晶,杨晓英.新型碳纳米材料——石墨烯及其衍生物在生物传感器中的应用.化学进展,2013,25(2/3):380-396.
[12]吴勇.无机纳米材料与电流型酶生物传感器.廊坊师范学院学报:自然科学版,2010,10(6):76-78.
[13]万谦,肖国光,杨平华,等.基于碳纳米管修饰电极的酶生物传感器研究进展.广东化工,2010,37(1):112-114.
[14]张卫军,卢丽敏,万其中,等.基于纳米氧化铝/壳聚糖无机-有机复合纳米材料的辣根过氧化酶生物传感器.分析测试学报,2010,29(4):353-358.
[15]邓健,廖力夫,袁亚莉,等.乳酸氧化酶共价交联于蛋膜上制备乳酸传感器.分析试验室,2002,21(6):64-66.
[16]邓健,袁亚莉,许金生,等.葡萄糖氧化酶共价交联于蛋膜上的葡萄糖传感器.分析化学,1998,26(10):1257-1259.

