南海北部海区浮游植物粒级结构生物光学反演模型的验证与评价*
王桂芬,周 雯,林俊芳,王国青,赵文静,3,曹文熙
(1.热带海洋环境国家重点实验室(中国科学院南海海洋研究所),广东 广州510301;2.麻省大学波士顿分校,美国马萨诸塞州波士顿市02125-3393;3.华南环境科学研究所(环境保护部),广东广州510655)
浮游植物是海洋的初级生产者,其粒级结构的变化不仅影响藻细胞光利用率和光合固碳效率,同时也影响着整个海洋生态系统的能量和物质传输。研究浮游植物粒级结构变化特征及其环境驱动因素是当前海洋学研究的热点问题之一[1,2]。近年来,随着水色卫星遥感技术的不断发展,采用生物光学算法反演浮游植物粒级结构分布获得了重视[3];该方法突破了传统测量方法在时空范围内的限制,为获取全球海区浮游植物粒级结构的大时空尺度变化提供了重要手段。
浮游植物粒径变化与水体生物光学参数存在紧密联系。近年来,基于理论模拟和大量现场调查数据分析,研究学者从海水叶绿素a浓度、浮游植物吸收系数及后向散射系数、水色光谱等光谱信号变化的角度出发,结合生态学分布规律,相继建立了多种浮游植物粒级结构的光学遥感监测方法,并将其应用于大时空水色遥感数据的处理[3-14]。Brewin等[6]曾对当前存在的浮游植物粒级结构反演方法进行了综述比较,研究发现:各种算法表现出类似的反演精度,Micro和Pico的反演精度要高于Nano;不同方法针对一类和二类水体的反演精度各有差异;同时指出高质量现场实测数据的积累验证非常重要。
南海是西太平洋诸多边缘海中最大的一个,通过海峡与我国东海、Java海和Sulu海相连,北部拥有宽阔的陆架区,与我国华南沿岸和越南沿岸相接。基于多年航次调查,人们研究发现河口、沿岸、陆架到外海,水体类型表现出明显差异;水体的营养盐结构产生了较大的变化,相应地浮游植物粒级结构表现出明显的海区差异[15-18]。Pan等[19]曾尝试基于区域调整后的浮游植物种群反演方法对南海北部海区主导浮游植物功能群进行遥感监测,并建立了微微型浮游植物丰度的经验反演模式。2004年以来,依托中国科学院南海海洋研究所组织的南海北部开放航次,对南海生物光学特性进行了综合调查。基于部分航次调查数据,研究了南海北部浮游植物粒级结构变化与生物光学参数(包括浮游植物吸收光谱、叶绿素a浓度等)之间的关系[20,21],并逐步尝试建立了定性分析或定量推算浮游植物粒级结构的模型[22-25]。初步研究发现,叶绿素a浓度、浮游植物吸收光谱变化可作为提取南海浮游植物粒级结构变化的重要指针。
本文拟综合多年航次调查数据,对南海海区浮游植物粒级结构分布及其与生物光学参数之间的关系进行深入分析,对现有几种浮游植物粒级结构反演算法进行比较验证和区域性优化,最终提出适合于南海北部海区、具有较高精度的浮游植物粒级结构反演算法。
1 数据与方法
1.1 数据
本文研究所采用的数据为2004-2008年中科院南海海洋研究所组织的秋季南海北部开放航次和珠江口、大亚湾近海调查航次所获取的aph和PSC数据。数据获取时间及站位、样品信息如表1,站位分布如图1。
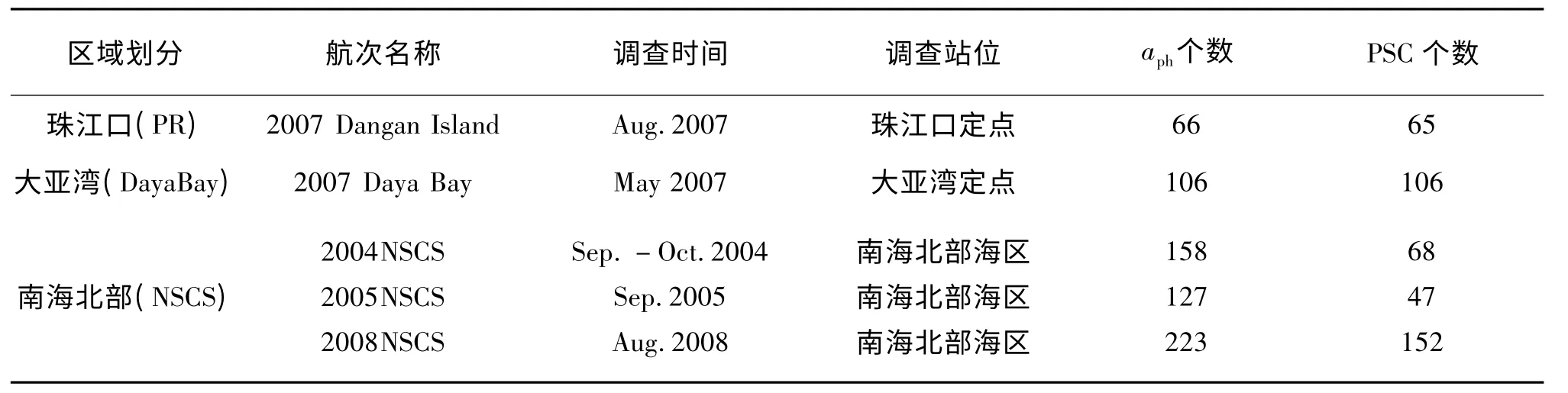
表1 2004-2008年南海北部航次调查信息表Tab.1 Cruise information in the Northern South China Sea between 2004-2008
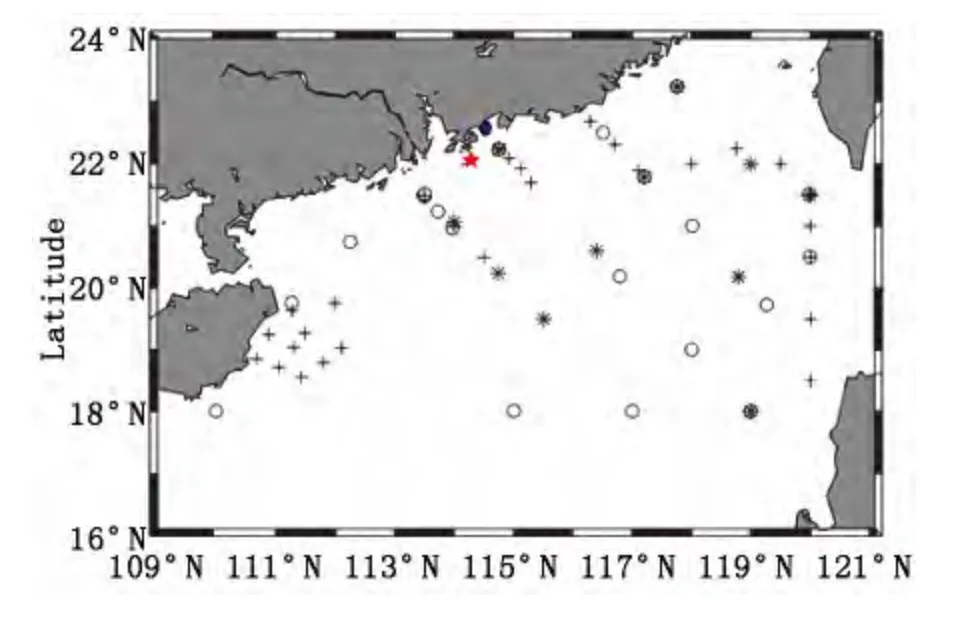
图1 2004-2008年南海北部浮游植物粒级结构调查站位分布图,2004NSCS(O),2005NSCS(*),2008NSCS(+),2007DayaBay(蓝色◇),2007PR(红色☆)Fig.1 Stationmap in the Northern South ChinaSeafrom 2004 to 2008.2004NSCS(O),2005NSCS(*),2008NSCS(+),2007DayaBay(Blue◇),2007PR(Red☆)
1.2 颗粒物吸收光谱测量
采用定量滤膜技术对海水悬浮颗粒物的吸收光谱进行测量。用Niskin采水器分别采集了标准层深度的海水,低压情况下将一定体积(0.5-4 L)的水样过滤到直径25 mm、孔径0.7μm的WhatmanGF/F滤膜上,采用T方法利用Helios紫外可见分光光度计扫描富集有颗粒物的样品滤膜的吸收光谱ap(λ),波段范围设为350-750 nm。将样品滤膜放入冰箱中避光、冰冻保存。回实验室后,用约90%的甲醇溶液浸泡样品滤膜90-180 min,以萃取样品滤膜上的色素,测量沉积在滤膜上的非藻类颗粒物的吸收a NAP(λ)。采用了750 nm处的吸收值对总颗粒物吸收光谱和非藻类颗粒物吸收光谱进行基线校正,以消除后向散射光损失带来的影响[26,27]。采用Roesler等[28]的方法对测量过程中光程放大影响进行校正,分别计算出总颗粒物和非藻类颗粒物的光谱吸收系数,两者相减得到浮游植物吸收系数aph(λ)。
1.3 叶绿素a浓度及分粒级叶绿素a浓度
叶绿素a的浓度([Chl a])采用荧光法测得,所用仪器Turner-Design 10型荧光光度计,有关测量方法见文献[29],叶绿素a标样的型号为C5753,购自Sigma公司。同时分析了部分水样不同粒级藻类的叶绿素a的浓度,并把粒径大于20μm的藻类归为小型浮游植物(Micro),粒径介于3-20μm之间的藻类归为微型浮游植物(Nano),粒径介于0.45(或0.7)-3μm的藻类归为微微型浮游植物(Pico);通过过滤、测定各粒径范围的叶绿素a浓度,计算出各粒径范围叶绿素a浓度与水样叶绿素a总浓度的比例,即分别为小型(RMicro)、微型(RNano)、微微型(RPico)浮游植物所占的比例。
1.4 现有几种反演算法的介绍
1.4.1 模型1:主导浮游植物粒级结构的生物光学指针“阈值”的划分 Hirata等[11]提出的基于叶绿素a浓度、浮游植物吸收光谱变化的PSC分类阈值方法,根据叶绿素a浓度划分的各粒级浮游植物主导时的阈值分别为:Pico<0.25 mg m-3;Nano:0.25-1.3 mg m-3;Micro>1.3 mg m-3;根据443 nm浮游植物吸收系数划分的各粒级浮游植物主导时的阈值分别为:Pico<0.024 m-1;Nano:0.024-0.060 m-1;Micro>0.060 m-1.
1.4.2 模型2:基于光谱形状变化提取的定性粒径指数 Ciotti等[7,8]建立了混合光谱模型,由归一化浮游植物吸收光谱提取表征粒级结构变化的粒径参数S<f>,表示如下:
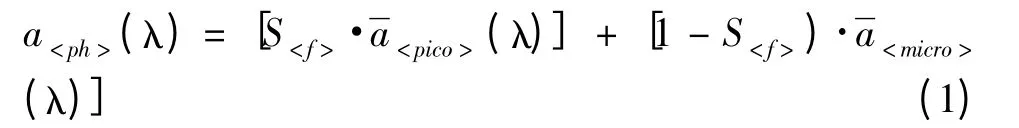
1.4.3 模型3:基于总叶绿素a浓度提取浮游植物粒级结构的经验关系模型 基于叶绿素a浓度与PSC之间的关系变化特征,人们建立了双组分和三组分模型用于表征其关系,其基础在于对浮游植物生物量与粒级结构之间存在着一定的自然变化规律,在低叶绿素a浓度的水体中较小粒径的浮游植物占据主导,而在较高叶绿素a浓度的水体中往往是较大粒径的浮游植物占据主导[30,31]。
Sathyendranath等[32]最早提出双组分模型,将叶绿素a浓度分为较大粒径和较小粒径藻类细胞的贡献之和,随着浮游植物生物量的增大,较小粒径所贡献的叶绿素a浓度逐步增大达到一定的阈值,表示如下:
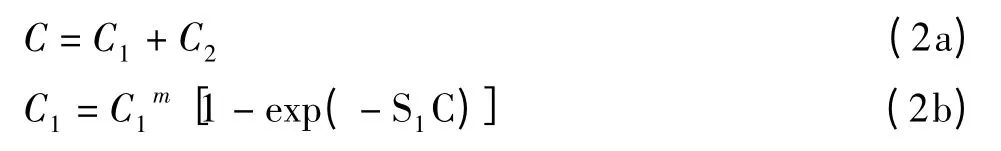
三组分模型是Sathyendranath等[32]所建立的两组分模型的一个延伸[4,9],分别对应小型(micro-)、微型(nano-)以及微微型(pico-)三个粒级,并基于全球多个海区的调查数据建立了参数化模型。

1.4.4 模型4:基于浮游植物吸收光谱和叶绿素a浓度提取不同粒级叶绿素a浓度贡献 基于Sathyendranath等[32]提 出 的 双 组 分 模 型,Devred等[10]将浮游植物吸收光谱表示为:
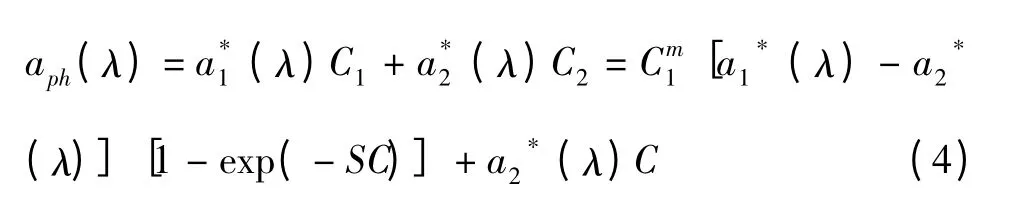
三组分模型将浮游植物吸收系数表示为Micro、Nano和Pico三个粒级结构浮游植物的吸收贡献,如下:

基于现场实测数据,Devred等[9,10]、Brewin等[5]采用非线性优化算法推算得到了典型海区不同粒级浮游植物比吸收光谱,并进一步应用于浮游植物吸收光谱的重组及水色遥感数据的分析。研究结果发现,因海水环境因素不同和数据测量方法上的差异,不同粒级对应的浮游植物比吸收光谱这一基础向量在不同海区存在着很大的差异。
单独基于总叶绿素a浓度或者耦合浮游植物吸收光谱来共同反演PSC的算法近年来得到了不断完善和应用,这一类方法可实现了PSC的定量反演,且反演结果连续。在复杂海洋环境影响下,该方法反演精度仍有待于提高,区域性现场数据验证及修正是必要的。
2 结果和讨论
2.1 PSC的分布特征
综合多航次数据分析浮游植物粒级结构与叶绿素a浓度之间的关系(图2),可以发现,随着海水中叶绿素a浓度的增大,Micro级/Pico级浮游植物相对贡献均有明显增高/降低的趋势,Nano级浮游植物贡献变化较为复杂,总体呈现先增大后减小的趋势。三粒级浮游植物所占的叶绿素a浓度随着总叶绿素a浓度的增大,均呈现出正向变化趋势:低叶绿素a浓度区间内,Micro级叶绿素a浓度(Cm)与叶绿素a浓度的关系分布相对分散,而Pico级叶绿素a浓度(Cp)与叶绿素a浓度之间的关系分布相对集中;在高叶绿素a浓度区间内,呈现出相反的特征。Nano级叶绿素a浓度在整个区间内的分散性相对一致。这种分布变化特征与Brewin等[4,5]针对全球不同海区调查结果一致。
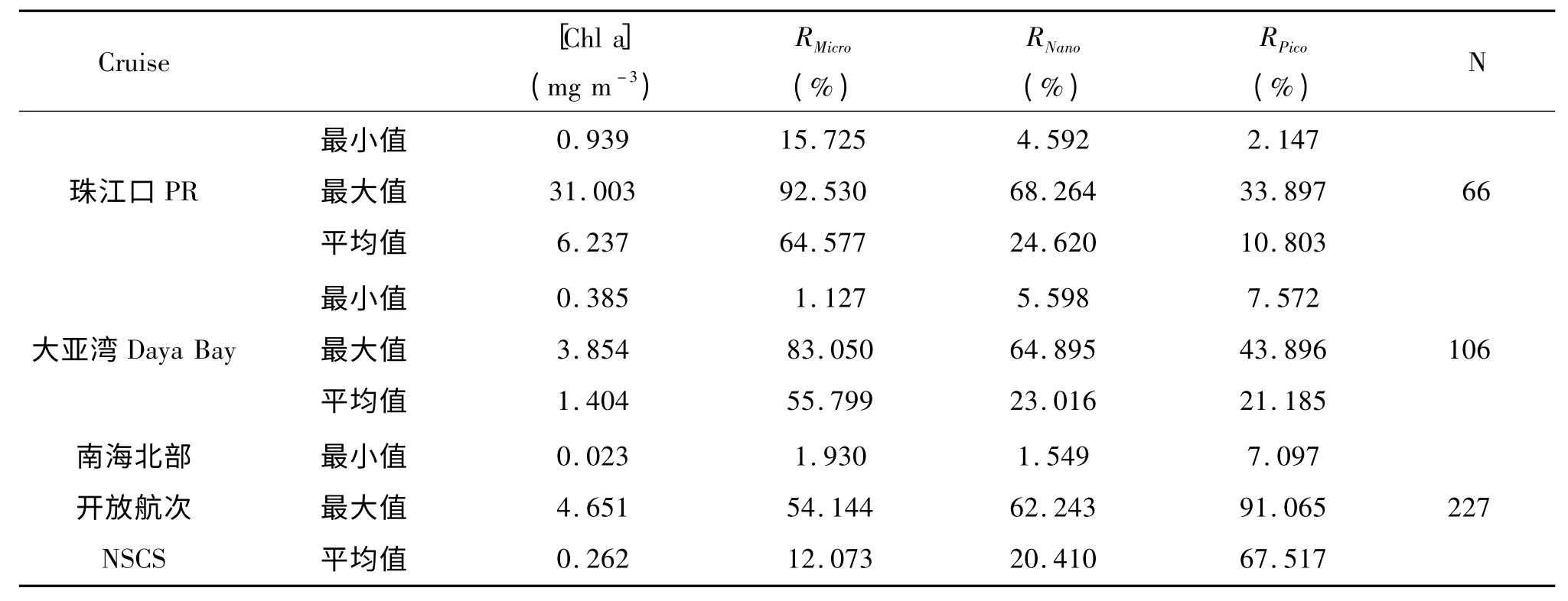
表2 各航次浮游植物粒级结构变化Tab.2 Variations of phytoplankton size structure(PSC)for different cruises
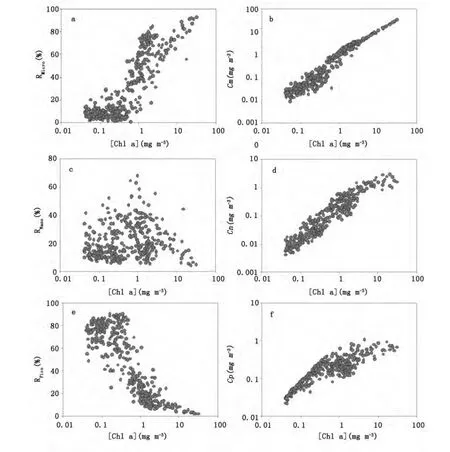
图2 南海北部海区叶绿素a浓度与浮游植物粒级结构(相对比例及分粒级叶绿素a浓度)的关系分布图Fig.2 Variations of phytoplankton size structure(size-specific fractions and size-fractioned chlorophyll a)with the total chlorophyll a concentration
南海北部外海水体的调查结果显示,绝大部分水体的叶绿素a浓度在0.50 mg m-3以内分布,平均值约为0.262 mg m-3。对应图2和表2可以看出,南海北部外海水体中Pico级浮游植物占据主导地位,平均为67.5%;部分站点Nano级浮游植物也有相对重要的贡献。而对于近岸调查站点,叶绿素a浓度分布在0.385-31.003 mg m-3之间,Micro级浮游植物占据较高的贡献,珠江口和大亚湾航次调查的平均值分别为64.58%和55.80%。
基于已有的PSC反演算法,可通过叶绿素a浓度或浮游植物吸收系数aph(443)的阈值对主导粒级结构进行分类;亦可以建立定量函数关系,对各粒级浮游植物所贡献的叶绿素a浓度进行反演。根据Brewin等[6]比较分析可知,现场数据调查方法及数据处理方式的不同造成的基础数据本身的差异也是造成模型反演误差的重要来源之一。因此,本文首先将南海北部海区的调查数据与国际公认的用于水色遥感验证的NOMAD数据[33]进行比较,分析叶绿素a浓度及浮游植物吸收光谱数据的相关关系。
2.2 南海北部水体叶绿素a浓度和浮游植物吸收光谱的关系分析(与NOMAD比较分析)
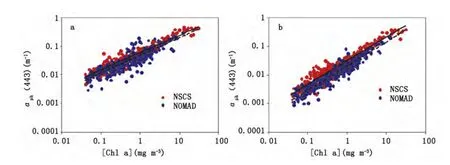
图3 南海北部海区浮游植物吸收系数(443和670 nm)与叶绿素a浓度之间的关系分布(黑色实线),与NOMAD数据(黑色虚线)集比较Fig.3 Variations of phytoplankton absorption at 443 and 670 nm with the chlorophyll a concentration in NSCS(solid line)(compared with the NOMAD dataset(dashed line))
图3选取了叶绿素a浓度的两个主要吸收峰附近波段(443 nm和670 nm)进行比较分析。综合南海北部各航次数据分析,浮游植物吸收系数与叶绿素a浓度之间存在明显的幂指数相关特性,与NOMAD数据集呈现出类似的变化趋势。同等叶绿素a浓度情况下,443 nm浮游植物吸收系数的变化范围类似。但对于670 nm波段的浮游植物吸收系数,南海北部海区的数据相对较高。这种差异可能来源于现场调查数据采集及数据处理方法的不同。采用QFT测量浮游植物吸收光谱的过程中,测量方式和光程放大因子的选择是引起差异的重要来源。
南海北部海区的数据,我们采用了Roesler等[28]进行了放大因子校正,而目前文献报道中采用的校正因子不一,主要包括Mitchell和Kiefer[34]、Mitchell[26]、Bricaud等[27]、Cleveland等[35]。本文以2004年采集的160组数据为例,比较不同beta因子计算得到的浮游植物吸收光谱之间的差异,发现采用这些校正因子计算得到的浮游植物吸收系数相对偏低,aph(443)的偏差(RMSE(%))在9.7%-19.6%之间,偏差相对较小;而aph(670)的偏差相对较大,在15.1%-43.2%之间。针对QFT方法光程放大因子的选择,多数研究发现β因子与样品滤膜的光学密度ODf有关,采用不同模式(吸收法、透过法、透过-反射法)、是否加载积分球、滤膜本身等都对结果都有较大的影响[36]。
本文拟在实测浮游植物吸收光谱数据基础上,建立PSC反演算法,必须对算法的基础向量进行区域性验证或调整。
2.3 不同PSC反演算法的比较、验证及精度分析
2.3.1 浮游植物主导粒级结构的划分
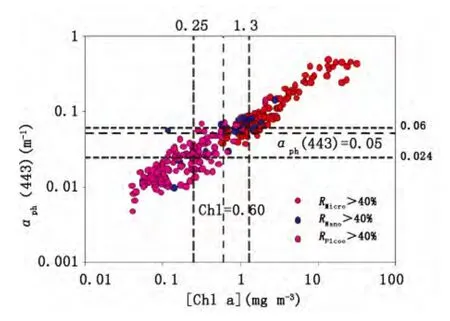
图4 不同粒级主导下叶绿素a浓度与a ph(443)关系分布图Fig.4 Scatterplot of the chlorophyll a concentration and a ph(443)with different dominant phytoplankton size class
采用Hirata等[11]选取的浮游植物吸收系数(aph(443))及叶绿素a浓度(Chl a)的阈值,确定主导粒级结构,如图4所示。对于叶绿素a浓度小于0.25 mg m-3的水体样品,多分布在南海北部外海水体,PSC平均为(9.8%,16.8%和73.4%),Pico级浮游植物占据主导,RPico高于40%的样品超过了95%;叶绿素a浓度大于1.3 mg m-3的水样,多是位于沿岸调查水体,PSC平均为66.3%,20.8%和12.9%,Micro级别浮游植物占据主导,大于40%的样品为91.5%。当叶绿素a浓度处于0.25-1.3 mg m-3之间的水体,PSC平均为33.3%、26.1%和40.6%,Pico级浮游植物依然具有较高的比率,RNano高于40%的样品仅占16%。
对于aph(443)低于0.024 m-1的水体,Pico级浮游植物占据主导,平均贡献约为73.2%,aph(443)高于0.06 m-1的水体,Micro级浮游植物占据主导,平均叶绿素贡献为60.5%;两者的判别精度分别为95%和85%;两者之间的Nano级浮游植物占据的比例仅平均为22.7%。
采用Hirata等[11]的阈值对南海北部海区浮游植物主导粒级进行划分,无论采用叶绿素a浓度或aph(443),Pico级主导或Micro级主导的精确度较高,但是对于Nano级别划分的结果精度较差。这与南海北部海区浮游植物粒级结构分布本身有明显的关系,由图2可知,PSC表现出Pico级和Micro级主导交替变化的特征,Nano级的贡献相对较低,绝大部分样品(91%)都在40%以内。
针对南海北部水体,可选定叶绿素a浓度或aph(443)的阈值对Micro和Pico主导粒级结构进行划分,相应的叶绿素a浓度在0.60 mg m-3附近,aph(443)在0.05 m-1附近。采用这类方法,依据叶绿素a浓度或aph(443)单一参数,只能较为定性地实现对主导粒级的划分,对于Pico/Nano,以及Nano/Micro主导的水体,存在明显的重叠现象,难以精确的划分。这种方法的精确度还依赖于遥感反演叶绿素a浓度或aph(443)的精度。
2.3.2S<f>的变化趋势
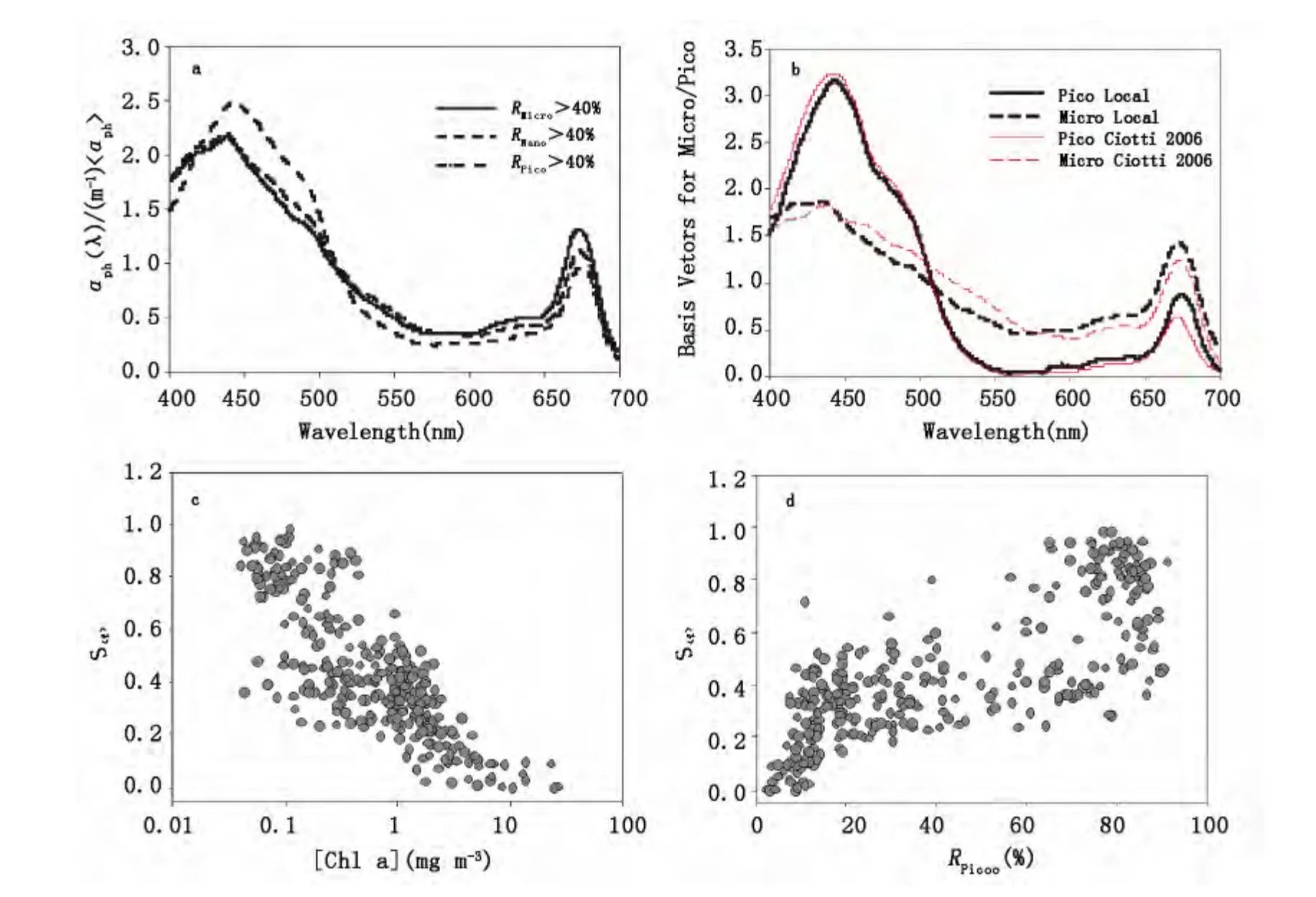
图5 a)不同浮游植物粒级结构主导(>40%)下平均归一化吸收光谱比较,b)区域调整后基础向量(Basis vectors)与文献Ciotti et al[8]的比较;(c)推算得到的S<f>与叶绿素a浓度之间的关系;(4)S<f>与R Pico之间的关系分布Fig.5 a)Normalized phytoplankton spectra for different dominant PSC;(b)local adjusted basis vectors compared with that in Ciotti et al.[8];(c)-(d)Deduced S<f>with the chlorophyll a concentration and the size-specific fraction of Pico-phytoplankton
综合现场调查数据,分析了三个粒级的相对贡献分别高于40%的情况,平均的归一化吸收光谱对比,如图5a,可见Micro和Pico主导下aph归一化光谱具有明显差异。如图5b为采用南海北部海区实测数据调整后本地化基础向量(Basis Vectors)与Ciotti等[8]采用的基础向量的比较。采用非线性优化算法推算得到的S<f>随叶绿素a浓度的增大而减小,在近岸和外海水体呈现出明显的差异,随着Pico级所占比例的增大而增大。与采用Ciotti等[8]基础向量的分析结果比较,区域性调整后基础向量的运用,减小了对近岸水体归一化浮游植物吸收光谱的模拟误差,绝大部分样品模拟的相对偏差均方根(RMSE(%))可控制在30%以内。进一步研究发现,反演得到的S<f>与采用Ciotti等[8]基础向量得到的结果亦有很好的线性相关特征,R2达到了0.986.S<f>参数是一个较为定性的概念,可以从整体上描述浮游植物粒级结构的变化;该模型亦可应用于水色遥感反演过程中浮游植物吸收光谱的重组。
2.3.3 基于叶绿素a浓度建立的三组分模型根据浮游植物生物量与粒级结构之间的关系,建立的双组分或三组分模型可实现对分粒级叶绿素a浓度的定量反演。本文参照公式对其进行参数化模拟。参照Brewin等[4]采用MAE(3)和MAE(%)对模型的偏差进行描述:
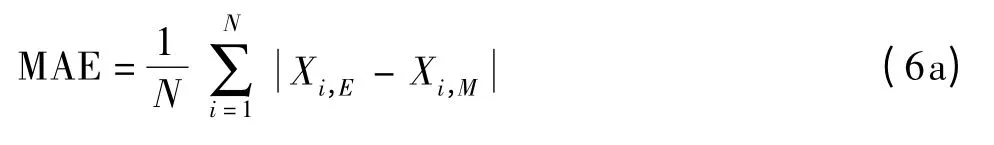

其中Xi,E表征模型反演得到的分级叶绿素a浓度(C)或对总叶绿素a浓度的贡献(F),Xi,M表示实测值,N为样品个数。
经过质量控制后叶绿素a浓度低于10 mg m-3的样本数共有372组,本文选取三分之二的样本248组进行建模,三分之一的样本124组数据进行验证。建模数据所覆盖的叶绿素a浓度范围在0.039-8.774 mg m-3之间,平均值为1.004 mg m-3(Std=1.435 mgm-3)。采用Matlab程序中非线性优化算法(Levenberg-Marquardt)对式(7)进行参数化,
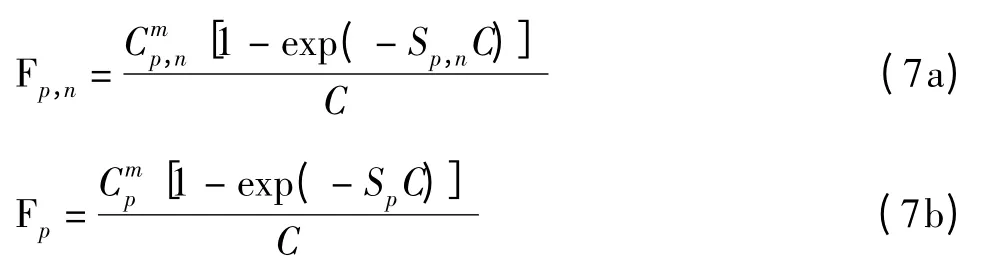
根据区域实测分级叶绿素a浓度推算得到的浮游植物粒级结构(PSC)与总叶绿素a浓度之间的函数关系,如表3和图6。可见,基于实测数据建立的参数化模型可以较好地模拟浮游植物粒级结构随总叶绿素a浓度的分布规律。Brewin等[4]针对NOMAD数据集建立的模型对Cp,n的拟合效果较好,但是相对低估了Pico级浮游植物贡献,高估了Nano级浮游植物的贡献。

表3 基于总叶绿素a浓度建立的三组分模型参数(与Brewin等[4]NOMAD数据建模比较)Tab.3 Model parameters for the three component model based on the total chlorophyll a concentration compared with that for NOMAD dataset by Brewin et al[4]

表4 采用124组独立数据对本文建立的三组分模型及Brewin等[4]模型的验证结果Tab.4 Validation results for the three component model in this study,compared with that by Brewin et al.[4]with the independent 124 data.

图6 采用非线性优化拟合得到的三组分模型。分粒级叶绿素a浓度(C)及其贡献(F)与总叶绿素a浓度之间的关系分布,红色实线代表拟合曲线,蓝色虚线代表Brewin等[4]模型Fig.6 (a)-(d)shows the three-component model plotted against the raw size-specific chlorophyll values;(h)shows the size-specific fractional contribution(F)as a function of total chlorophyll a concentration.(Red solid line:our model;Blue dashed line from Brewin et al.[4]for NOMAD dataset
采用124组样本对模型进行验证,结果如表4和图7所示。模型参数的区域化调整更适合于南海北部水体浮游植物粒级结构的分布趋势。采用单一叶绿素a浓度反演得到的Pico及Nano-pico所贡献的叶绿素a浓度相对偏差较小,分别为23%和31.6%左右,与采用Brewin等[4]推算得到的结果相当,反演得到的Micro和Nano级叶绿素a浓度的相对偏差稍大,分别为64.76%和54.43%,优于Brewin等[4]模型的反演结果。由图7可见,对于叶绿素a浓度较低的清洁水体,Micro和Nano级别反演结果离散性偏大;而对于叶绿素a浓度较高的混浊水体,Pico和Nano-Pico级别反演结果有明显的离散。这种分布特征与外海清洁水体和沿岸混浊水体中主导粒级分布有关。
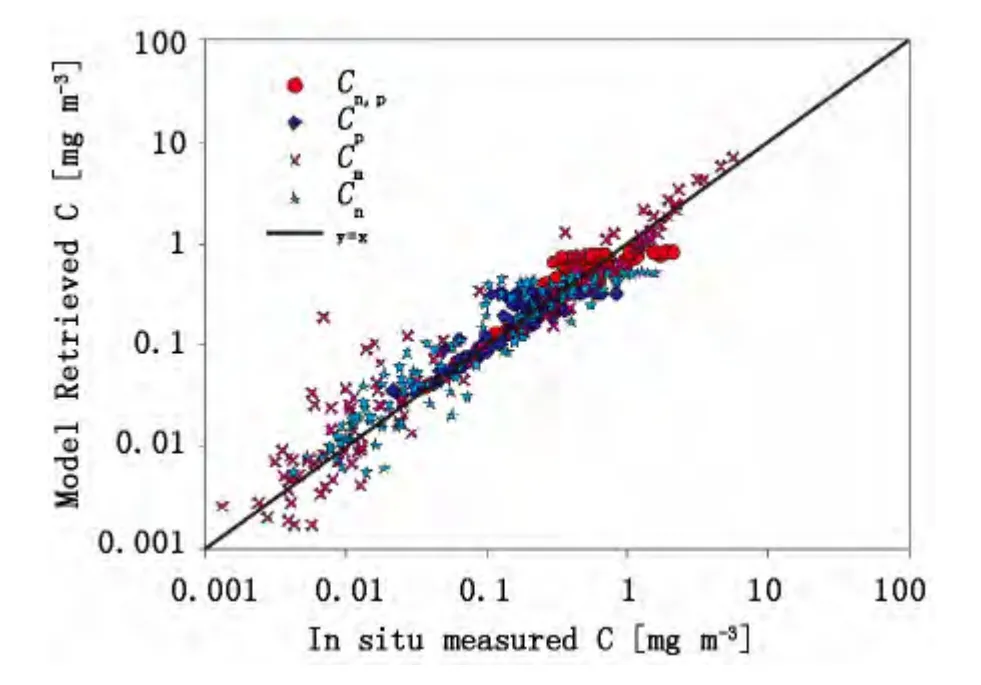
图7 采用124组数据验证模型,得到的各粒级叶绿素a浓度与实测数据的比较Fig.7 Comparisons between the in situ size-specific chlorophyll-a concentration and the estimated value from the model,using the independent dataset(124 samples)
2.3.4 基于叶绿素a浓度和浮游植物吸收光谱的三组分模型
该类模型将浮游植物吸收光谱可表示为三个粒级浮游植物的吸收贡献,
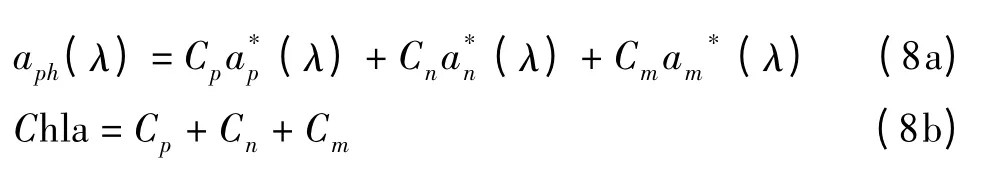
在色素打包效应影响下,不同粒级浮游植物比吸收光谱呈现处不同的分布特征。综合南海北部海区实测数据统计发现,当不同粒级浮游植物占据主导时,浮游植物的比吸收光谱存在明显的差异(如图8a)。公式中,ap*(λ)、an*(λ)、am*(λ)、三个基础向量的选择与调查海区浮游植物吸收光谱的影响因素有关,同时又受制于浮游植物吸收光谱测量分析方法。Brewin等[5]基于NOMAD数据集提取了三个基础向量,对比分析了不同环境水体下比吸收光谱的差异。王国青等[24]在2007年珠江口、大亚湾航次以及2008年南海北部航次数据分析基础上,提取了5个波段的三个粒级浮游植物的比吸收系数,进一步应用于水色遥感数据的处理。图8b给出了王国青等[24]与Brewin等[5]的所采用的三个基础向量,即三个粒级浮游植物比吸收系数的比较。
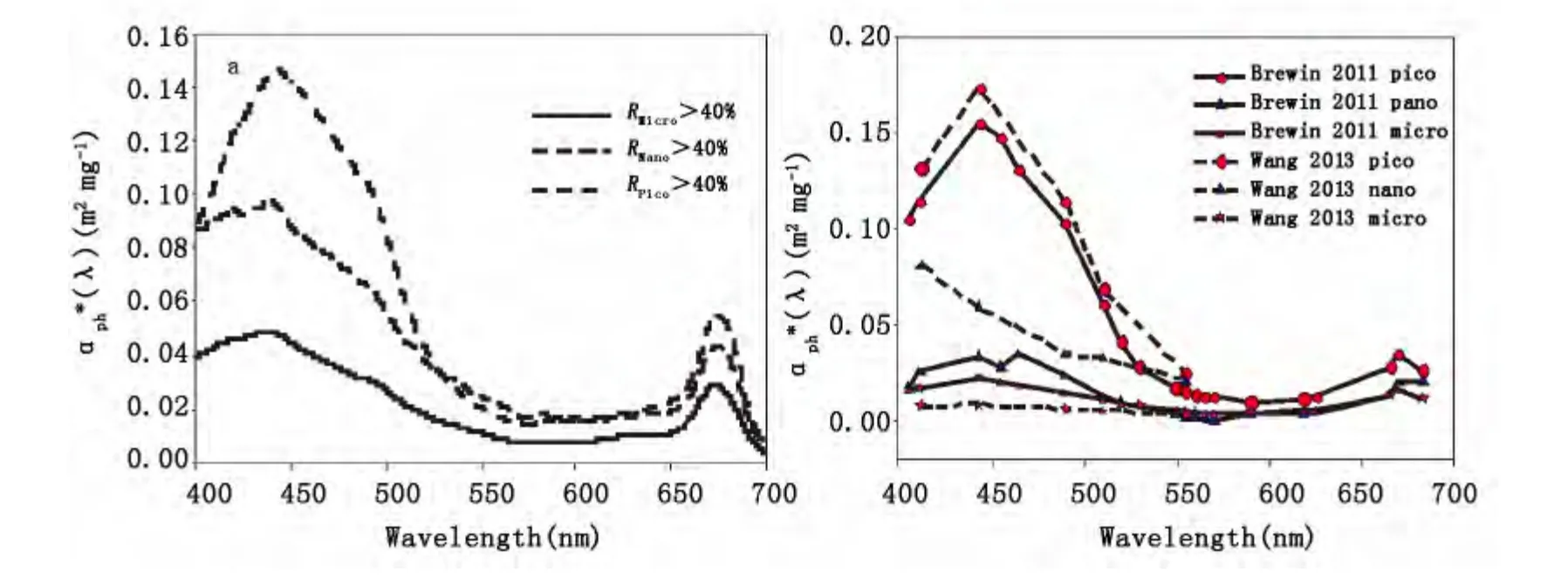
图8 (a)不同粒级主导下平均的浮游植物比吸收光谱分布;(b)Brewin等[5]与王国青等[24]采用的三粒级浮游植物比吸收系数基础向量的比较Fig.8 (a)Averaged chlorophyll-a specific phytoplankton absorption(a*(λ))for different PSC;(b)Size-specific a*(λ)coefficients from Brewin et al.[5]and Wang et al[24]
本文基于南海北部数据,采用这两种基础向量和实测粒级结构数据对浮游植物吸收光谱进行重组,计算得到的误差(RMSE(%))范围多在30-50%之间分布,且效果要优于Brewin等[5]采用NOMAD数据的模拟结果。因此,本文拟选用这两类基础参量结合实测总叶绿素a浓度数据,从浮游植物比吸收光谱中提取浮游植物的粒级结构信息。
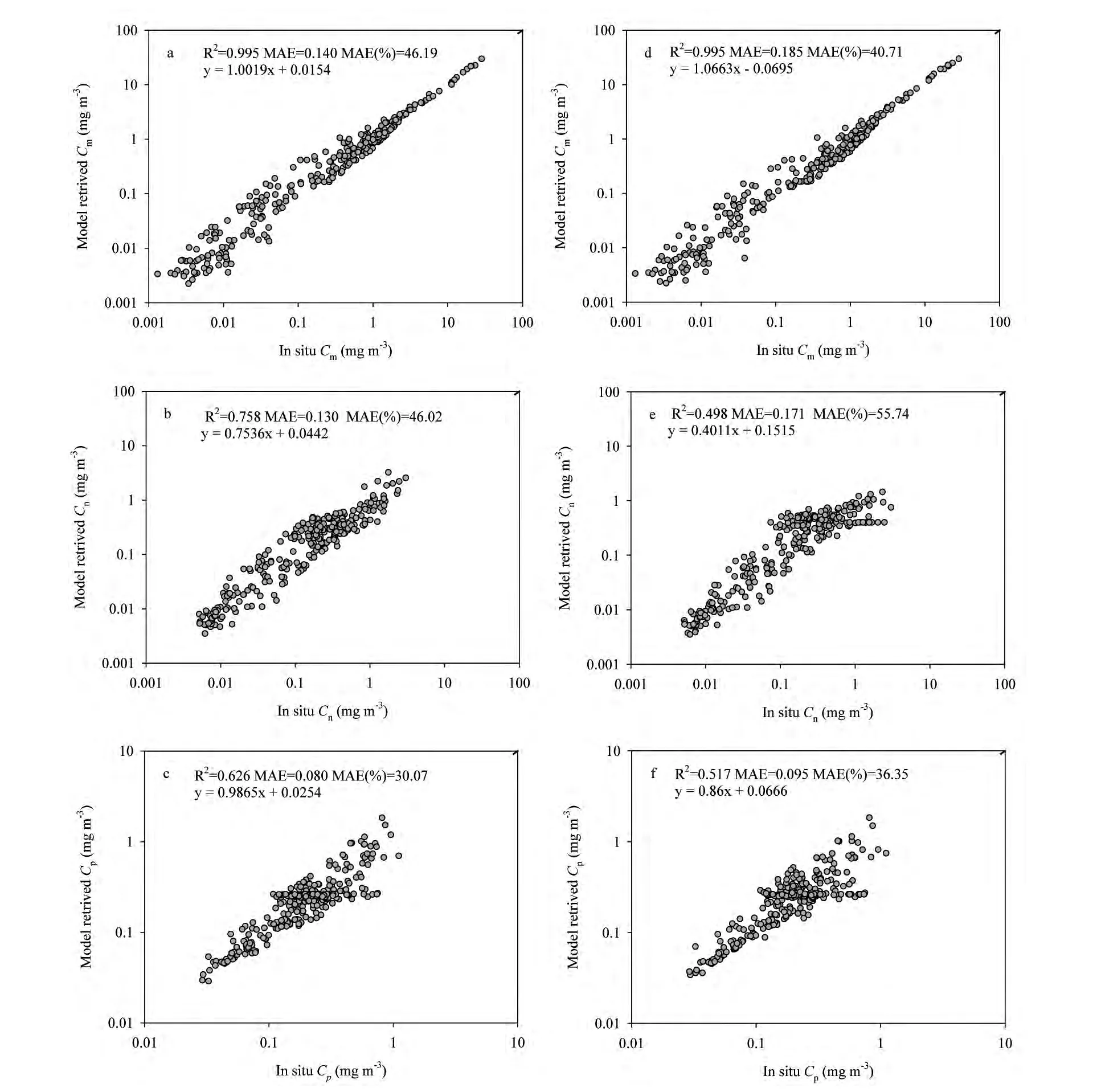
图9 基于浮游植物吸收光谱和总叶绿素a浓度推算得到的各粒级叶绿素a浓度比较;(a)-(c)、(d)-(f)分别为采用王国青等[24]和Brewin2011[5]基础向量反演得到的结果Fig.9 Estimated size-specific chlorophyll-a concentration from a ph(λ)and[Chl a]based on the basis vectors from Wang et al.[24](a-c)and Brewin et al.[5](d-f)
采用优化算法进行计算时,本文研究发现,如果仅仅设置各组分叶绿素a浓度在0-Tchla为上下限,回归得到的数据分布较为分散。然而实际环境中,分粒级叶绿素a浓度与总叶绿素a浓度之间的关系呈现出一定的变化规律(图2)。因此本文在计算过程中,综合公式(8)求解得到各组分所贡献的叶绿素a浓度,对三个未知参数的上下限进行设定,下限设定为趋势线(图6)以下20%范围,上限设定为总叶绿素 浓 度 的95%。类 似 地,Brewin等[5]、Devred等[9,10]也曾耦合叶绿素a浓度于PSC之间的关系,从浮游植物吸收光谱中提取PSC信息。本文采用这种方法,使得反演结果更满足物理意义的需求,如图9所示,反演得到的数据较为均匀地分布在y=x线上下,上限的设置放宽到总叶绿素a浓度的95%,有效提高了叶绿素a浓度较高时反演的pico和Nano级别叶绿素a浓度与实测数据之间的相关性。这种变化规律与Goericke[31]的研究结果相一致。采用王国青等[24]基础向量,模型反演得到的Micro、Nano和Pico级浮游植物的叶绿素a浓度相对偏差的平均值分别为46.19%,46.02%和30.07%,实测值与反演值之间的线性相关的R2分别为0.995、0.758和0.626,且线性拟合斜率在1.0附近。采用Brewin2011基础向量推算得到的结果相对偏差较为类似,实测值与反演值之间的线性相关的R2分别为0.995、0.498和0.517,Micro和Pico线性关系的拟合斜率在1.0附近,Nano和Pico的线性相关程度稍差。与仅采用叶绿素a浓度建立的三组分模型相比,综合浮游植物吸收光谱和叶绿素a浓度的模型提高了反演结果的收敛性,反演得到Pico级叶绿素浓度误差在30%左右,但Micro和Nano级叶绿素浓度的反演精度提高;尤其是采用本地化基础向量推算得到Micro和Nano级别叶绿素浓度误差仅在46%左右。
2.4 讨论
本文综合了当前几种典型的反演算法,由浮游植物吸收光谱和叶绿素a浓度对南海北部海区浮游植物粒级结构进行反演比较和验证。研究结果表明,叶绿素a浓度、浮游植物吸收光谱、比吸收光谱等与PSC之间存在紧密的联系。采用单一参数(如叶绿素a浓度、浮游植物吸收系数)等,可以较为定性地对较大或较小粒径浮游植物的主导程度进行描述。然而,粒级结构划分方法的缺点在于其精度与叶绿素a浓度、浮游植物吸收系数等参数的测量或估算精度有着紧密的联系,易造成反演的误差。本文针对南海北部海区水体提出的对Pico和Micro主导粒级进行分类的阈值有一定的参考作用。基于归一化浮游植物吸收光谱形状的变化,对浮游植物粒级信息进行提取的方法具有一定的优势,归一化之后消除了浮游植物吸收系数本身的测量精度影响,可定性表征浮游植物粒级结构的总体变化趋势。另外,由于本文采取的浮游植物吸收光谱的光程放大因子校正与Ciotti等[7-8]采用的方法一致,可以采用这种模型可以实现浮游植物吸收光谱的重组;该模型的缺点在于单一参数的定性概括描述,难以精确估算粒级结构;由Bricaud等[14]的研究结果亦可以发现,全球 与叶绿素a浓度之间存在着内在的联系,仅可表征其变化趋势。
基于叶绿素a浓度和进一步耦合浮游植物吸收系数提取三个粒级浮游植物的色素浓度及其贡献,是近年来应用较多的算法。本文建立的基于叶绿素a浓度反演PSC的三组分模型,对Brewin等[5]针对NOMAD数据集建立的模型进行了微小调整,应用于南海北部外海水体的反演表现出较高的精度,采用124组数据进行独立验证Cm,Cn,Cp的误差分别为64.76%、54.43%和31.6%。但是低叶绿素a浓度时的Micro及高叶绿素a浓度水体中的Pico及Nano级反演结果存在较大的离散性,受制于模型本身,进一步耦合浮游浮游植物吸收系数,利用了浮游植物比吸收系数与粒级结构之间的紧密联系以及PSC随叶绿素a浓度的变化趋势,反演结果Pico的精度在30%左右,对Micro和Nano反演精度有所提高;尤其是采用王国清等[19]本地化基础向量反推得到的Micro和Nano级叶绿素a浓度的误差在46%左右,且反演值与实测数据的线性相关程度有所增强,线性拟合斜率在1.0附近分布。
3 结论
南海北部海区浮游植物粒级结构与叶绿素a浓度、浮游植物吸收光谱之间的紧密联系。本文综合多航次不同环境水体数据,对已有模型进行了验证和比较分析,对模型所采用的基础向量进行了区域性调整或验证,同时指出了不同反演算法所存在的限制。在定性描述浮游植物主导粒级结构的基础上,提出基于叶绿素a浓度的三组分模型以及进一步耦合浮游植物吸收光谱反演浮游植物粒级结构模型,可定量地提取三个粒级所贡献的叶绿素a浓度,对于Pico级叶绿素a浓度的反演精度在30%左右,对Micro和Nano级叶绿素a浓度的反演精度在46%左右,且线性相关程度明显增强。综合浮游植物吸收光谱和叶绿素a浓度两类参数,可避免采用单一参数产生的系统误差,提高模型在沿岸水体的反演精度,可应用于历史数据的推广应用和水色遥感数据处理。
海洋环境中浮游植物分布及其生物光学特性的变化相当复杂,在已有规律基础上,研究耦合多参数的非线性优化模型可能是今后突破的方向。为了扩大模型的应用范围,提高其在中国海浮游植物粒级结构的反演精度,需要耦合不同水体环境的数据,统一调查规范,逐步建立高质量基础数据库。
致谢:感谢中国科学院南海海洋所“实验3”号科考船南海北部开放航次资助,感谢全体科考队员和船员的辛苦劳动。
[1] 宁修仁,蔡昱明,李国为,等.南海北部微微型光合浮游生物的丰度及环境调控[J].海洋学报,2003,25(3):83-97.NING Xiuren,CAIYumin,LIGuowei,et al.Photosynthetic Pico plankton in the northern South China Sea[J].Acta Oceanologica Sinica,2003,25(3):83-97.
[2] 黄邦钦,刘媛,陈纪新,等.东海、黄海浮游植物生物量的粒级结构及时空分布[J].海洋学报,2006,28(2):156-164.HUANG Bangqin,LIU Yuan,CHEN Jixin,et al.Temporal and spatial distribution of size-fractionized phytoplankton biomass in East China Seaand Huanghai Sea[J].Acta Oceanologica Sinica.2006,28(2):156-164.
[3] IOCCG(2014).Phytoplankton Functional Types from Space[R].Sathyendranath S.(ed.),Reports of the International Ocean-Colour Coordinating Group,No.15,IOCCG,Dartmouth,Canada.
[4] BREWIN R J W,SATHYENDRANATH S,HIRATA T,et al.Athree-component model of phytoplankton size class for the Atlantic Ocean[J].Ecological Modelling,2010,221(11):1472-1483.
[5]BREWIN R JW,DEVRED E,SATHYENDRANATH S,et al.Model of phytoplankton absorption based on three size classes[J].Applied Optics,2011,50(2):4535-4549.
[6]BREWIN R JW,HARDMAN-MOUNTFORD N J,LAVENDER SJ,et al.An intercomparison of bio-optical techniques for detecting dominant phytoplankton size class from satellite remote sensing[J].Remote Sensing of Environment,2011,115(2):325-339.
[7] CIOTTI A M,LEWISM R,CULLEN JJ.Assessment of the relationship between dominant cell size in natural phytoplankton communities and the spectral shape of the absorption coefficient[J].Limnol Oceanogr,2002,47(2):404-417.
[8] CIOTTI A M,BRICAUD A.Retrievals of a size parameter for phytoplankton and spectral light absorption by Colored Detrital Matter from water-leaving radiances at SeaWiFS channels in a continental shelf region of Brazil[J].Limnol Oceanogr:Methods,2006,4:237-253.
[9] DEVRED E,SATHYENDRANATH S,STUART V,et al.A three component classification of phytoplankton absorption spectra:Application to ocean-color data[J].Remote Sensing of Environment,2011,115(9):2255-2266.
[10] DEVRED E,SATHYENDRANATH S,STUART V,et al.A two-component model of phytoplankton absorption in the open ocean:Theory and applications[J].Journal of Geophysical Research,2006,111(C3):C03011.
[11] HIRATA T,AIKEN J,HARDMAN-MOUNTFORD N,et al.An absorption model to determine phytoplankton size classes from satellite ocean colour[J].Remote Sensing of Environment,2008,112(6):3153-3159.
[12] UITZ J,CLAUSTRE H,MOREL A,et al.Vertical distribution of phytoplankton communities in Open Ocean:An assessment based on surface chlorophyll[J].Journal of Geophysical Research,2006,111(C8):C08005.
[13] BRICAUD A,MEJIA C,BLONDEAU-PARISSIER D,et al.Retrieval of pigment concentrations and size structure of algal populations from their absorption spectra using multilayered perceptrons[J].Applied Optics,2007,46(8):1251-1260.
[14] BRICAUD A,CIOTTIA M,GENTILIB.Spatial-temporal variations in phytoplankton size and colored detrital matter absorption at global and regional scales,as derived from twelve years of SeaWiFS data(1998-2009)[J].Global Biogeochemical Cycles,2012,26:GB1010.
[15] NING X,CHAI F,XUE H,et al.Physical-biological oceanographic coupling influencing phytoplankton and primary production in the South China Sea[J].Journal of Geophysical Research,2004,109(C10):C10005.
[16] 陈纪新,黄邦钦,刘媛,等.应用特征光合色素研究东海和南海北部浮游植物的群落结构[J].地球科学进展,2006,21(7):738-746.CHEN Jixin,HUANGBangqin,LIU Yuan,et al.Phytoplankton community structure in the transects across East China Sea and Northern South China Sea determined by analysis of HPLC photosynthetic pigment signatures[J].Advances in Earth Science,2006,21(7):738-746.
[17] 柯志新,黄良民,谭烨辉,等.2007年夏季南海北部浮游植物的物种组成及丰度分布[J].热带海洋学报,2011,30(1):131-143.KE Zhixin,HUANG Liangmin,TAN Yehui,et al.Species composition and abundance of phytoplankton in the northern South China Sea in summer 2007[J].Journal of Tropical Oceanography,2011,30(1):131-143.
[18] LIU H,CHANG J,TSENG CM,et al.Seasonal variability of picoplankton in the Northern South China Sea at the SEATSstation[J]. Deep-SeaResearch II,2007,54(14-15):1602-1616.
[19] PAN X,WONG G T F,HO T Y,et al.Remote sensing of Pico phytoplankton distribution in the northern South China Sea[J].Remote Sensing of Environment,2013,128:162-175.
[20] 王桂芬,曹文熙,许大志,等.南海北部水体浮游植物比吸收系数的变化[J].热带海洋学报,2005,24(5):1-10.WANG Guifen,CAO Wenxi,XU Dazhi,et al.Variations in specific absorption coefficients of phytoplankton in northern South China Sea[J].Journal of Tropical Oceanography,2005,24(5):1-10.
[21] WANG G F,CAO W X,XU D Z,et al.Variability of phytoplankton absorption in the northern South China Sea:Influence of the size structure and pigment composition of algal populations[J].Acta Oceanologica Sinica,2007,26(2):12-25.
[22] 王桂芬,曹文熙,周雯,等.基于南海北部海区浮游植物吸收光谱斜率变化的粒级结构反演[J].热带海洋学报,2010,29(2):25-32.WANG Guifen,CAO Wenxi,ZHOU Wen,et al.Retrieval of phytoplankton size structure based on the spectral slope of phytoplankton absorption in the northern South China Sea[J].Journal of Tropical Oceanography,2010,29(2):25-32.
[23] 梁少君,曹文熙,王桂芬,等.基于浮游植物吸收光谱提取粒径参数[J].热带海洋学报,2010,29(2):59-64.LIANG Shaojun,CAOWenxi,WANGGuifen,et al.Retrieval of phytoplankton size parameter from phytoplankton absorption spectra[J].Journal of Tropical Oceanography,2010,29(2):59-64.
[24] WANG G Q,CAO W X,WANG G F,et al.Phytoplankton size class derived from phytoplankton absorption and chlorophyll-a concentrations in the northern South China Sea[J].Chinese Journal of Oceanology and Limnology,2013,31(4):750-761.
[25] LIN J,CAOW X,WANGGF,et al.Satellite-observed variability of phytoplankton size classes associated with a cold eddy in the South China Sea[J].Marine pollution bulletin,2014,83(1):190-197.
[26] MITCHELL B G.Algorithms for determining the absorption coefficient for aquatic particulates using the quantitative filter technique[C].Proc SPIE,1990,1302:137-148.
[27] BRICAUD A,STRAMSKID.Spectral absorption coefficients o f living phytoplankton and nonalgal biogenous matter:A comparison between the Peru upwelling area and the Sargasso Sea[J].Limnology and Oceanography,1990,35(3):562-582.
[28] ROESLER CS.Theoretical and experimental approaches to improve the accuracy of particulate absorption coefficients derived from the quantitative filter technique[J].Limnology and Oceanography,1998,43(7):1649-1660.
[29] PARSONST R,MAITA Y,LALLI C M.A manual of chemical and biological methods for seawater analysis[M].Oxford:Pergamon Press,1984.
[30] YENTSCH C S,PHINNEY D A.A bridge between ocean optics and microbial ecology[J].Limnology and Oceanography,1989,34(8):1694-1705.
[31] GOERICKE R.The size structure of marine phytoplanton-What are the rules?[R].California Cooperative Oceanic Fisheries Investigations Reports,2011,52:198-204.
[32] SATHYENDRANATH S,COTA G,STUART V,et al.Remote sensing of phytoplankton pigments:A comparison of empirical and theoretical approaches[J].International Journal of Remote Sensing,2001,22(2-3):249-273.
[33] WERDELL P J,BAILEY S.W.An improved bio-optical dataset for ocean color algorithm development and satellite data product validation[J].Remote Sensing of Environment,2005,98:122-140.
[34] MITCHELL B G,KIEFER D A.Chlorophyll a specific absorption and fluorescence excitation spectra for light-limited phytoplankton[J].Deep-Sea Research,1988,35(5):639-663.
[35] CLEVELAND J S,WEIDEMANN A D.Quantify ing absorption by aquatic particles:a multiple scattering correction for glass fiber filters[J].Limnology and Oceanography,1993,38(6):1321-1327.
[36] ROTTGERS R,GEHNKE S.Measurement of light absorption by aquatic particles:Improvement of the quantitative filter technique by use of an integrating sphere approach[J].Applied Optics,2012,51(9):1336-1351.

