PI3K/AKT及MEK/ERK信号通路抑制剂对结直肠癌血管内皮细胞管道形成的作用
郝志楠 郑勇斌 肖高春 李盛波
武汉大学人民医院胃肠外科,湖北武汉430060
PI3K/AKT及MEK/ERK信号通路抑制剂对结直肠癌血管内皮细胞管道形成的作用
郝志楠 郑勇斌 肖高春 李盛波
武汉大学人民医院胃肠外科,湖北武汉430060
目的探讨PI3K/AKT信号通路抑制剂(LY294002)及MEK/ERK信号通路抑制剂(PD98059)对结直肠癌血管内皮细胞管道形成的影响。方法实验分为对照组和实验组,其中对照组分正常组和二甲基亚砜(DMSO)组(0.1%DMSO),实验组分PI3K/AKT信号通路抑制剂组LY294002及MEK/ERK信号通路抑制剂组PD98059(实验组设4个浓度梯度),比较结直肠癌血管内皮细胞在不同抑制剂浓度(2.5、5、10、20μmol/L)作用下在Matrigel胶上管道形成的情况,6 h后观察并取每个孔上、下、左、右、中5个区域中的图片,测其管道形成的总长度,每组均设3个复孔,数据以均数±标准差表示,采用SPSS 16.0软件进行统计分析,以P<0.05为差异有统计学意义。结果对照组中正常组与DMSO组两者管道形成总长度之间差异无统计学意义[(4.16±0.26)mm比(4.17±0.18)mm],而实验组管道形成总长度较对照组都有明显减少(P<0.05)。其中LY294002浓度在2.5、5、10、20μmol/L管道形成的长度分别为(3.08±0.51)、(2.65±0.24)、(2.02±0.18)、(1.08±0.13)mm,而PD98059管道形成的长度分别为(3.39± 0.18)、(2.98±0.12)、(2.53±0.18)、(1.88±0.12)mm,随着浓度的增加,管道形成长度逐渐减少,差异有统计学意义(P<0.05)。LY294002与PD98059相比,在相同浓度下,LY294002管道形成长度较PD98059减少(P<0.05)。结论PI3K/AKT信号通路抑制剂及ERK/MEK信号通路抑制剂能够明显抑制结直肠癌血管内皮细胞的管道形成,且随着抑制剂浓度的升高,管道形成能力进一步降低,PI3K/AKT信号通路抑制剂抑制肿瘤血管内皮细胞管道形成的能力比ERK/MEK信号通路抑制剂明显。
PI3K/AKT抑制剂(LY294002);ERK/MEK抑制剂(PD98059);结直肠癌血管内皮细胞;管道形成
肿瘤侵袭和转移是多阶段、多基因参与的过程,转移相关基因的调节涉及复杂的机制及多条信号传导途径,目前研究的热点主要集中在细胞信号传导通路与恶性肿瘤的关系[1-4],细胞信号传导通路在恶性肿瘤形成和发展中多个环节具有重要的作用,其中血管形成在恶性肿瘤的生成和转移中最重要,肿瘤的生长和转移需要有新生血管的形成,如果没有血管新生,肿瘤生长不会超过1~2 cm,当实体肿瘤生长达到一定程度时,进一步生长就有依赖于新生血管的形成来提供肿瘤生长所需的氧和其他营养物质[5],肿瘤血管新生是由于肿瘤细胞分泌促血管生成因子,这些分子可能产生于肿瘤细胞或周围基质细胞,进而激活内皮细胞,激活的内皮细胞降解其基底膜,内皮细胞迁移、扩增、形成血管,肿瘤血管的形成类似于胚胎血管发育的过程,它是一项复杂精密的工程,各种信号途径在血管发育中起着重要的作用,信号通路在生理性及病理性血管生成中发挥重要的调控作用,可以直接影响血管重构、血管稳定性、血管平滑肌细胞的分化,动静脉发生选择等,细胞受体接收外界信号到最后做出综合性应答,不仅是一个信号转导过程,更重要的是将外界信号进行逐步放大的过程。健康时血管增生处于严格控制之下并仅发生在胚胎发育、子宫内膜调节和伤口修复时,但在许多病理情况下如肿瘤、类风湿性关节炎、动脉硬化等,血管形成的持续失控状态驱动疾病的恶化,肿瘤的生长与转移依赖血管生成建立丰富的血液循环,以供应肿瘤组织异常旺盛的生化代谢以及瘤细胞的繁殖与转移。在肿瘤血管新生中内皮细胞迁移、相互融合并形成管状结构是血管形成过程中的重要环节,如能抑制这一环节,就可对肿瘤的血管形成起到抑制作用,因此抑制肿瘤的新生血管就可以抑制肿瘤的生长,血管生成抑制剂的研究逐渐成为肿瘤研究的热点和肿瘤治疗的新策略。血管生成抑制剂可能提高传统化疗、放疗的疗效,肿瘤消退期的患者应用血管生成抑制剂有可能使微小转移处于静息状态,从而控制肿瘤的转移和复发。PI3K/AKT信号通路中的p110亚单位不仅能够调节内皮细胞的迁移和屏障功能,同时对血管形成也有重要作用。此外,血管内皮细胞中的ras基因持续活化能直接调节PI3K信号通路,来诱导肿瘤血管畸变;MEK/ERK信号通路是将细胞表面受体信号转导至细胞核的关键,控制着细胞多种生理过程,参入细胞的增殖、迁移与分化、细胞形态的维持、细胞骨架的构建、细胞凋亡和细胞恶变等多种生物学反应。PI3K/AKT信号通路和MEK/ERK信号通路是2个比较重要的信号通路,为了研究它对肿瘤血管形成的影响,本实验以结肠癌细胞SW480为例,观察PI3K/AKT信号通路抑制剂及MEK/ERK信号通路抑制剂对肿瘤血管内皮细胞管道形成长度的影响,以此评估其血管新生程度,从而探索信号通路抑制剂在肿瘤血管新生的作用,为肿瘤的治疗和预防提供一种新的辅助治疗手段。
1 材料与方法
1.1 主要试剂
人结肠癌细胞系SW480(武汉大学保藏中心)、人脐静脉内皮细胞(HUVEC)来自武汉大学消化实验室保存,PD98059,LY294002购自碧云天公司,胎牛血清购自个Gibco公司,DMEM-F12培养基购自Hyclone公司,细胞培养瓶,培养板,Matrigel胶胶购自BD公司,倒置相差显微镜日本Olympus。
1.2 主要实验材料和仪器
CO2恒温培养箱、倒置相差显微镜、超净工作台、37℃恒温烤箱等。
1.3 肿瘤血管内皮细胞的诱导
人脐静脉内皮细胞(HUVEC)自液氮中取出后,即放于37℃水浴箱中,震荡复融20~60 s,待管中内容物完全溶解,把细胞悬液加入10mL离心管,再缓慢加入8 mL 10%的胎牛血清完全培养液,1000 r/min,3 min离心后弃上清,加入适量培养基溶解沉淀细胞,移入25 mL培养瓶内,置37℃、5%CO2培养箱内培养,2~3 d换液1次,当细胞融合到80%左右时传代培养。SW 480细胞用含10%的DMEM-F12培养,当细胞融合达到80%的时候换为无血清的DMEM-F12培养液,0.22μm的滤膜过滤,-80℃保存备用。用含体积分数为50%的SW480细胞上清DMEM-F12培养48 h,当融合至80%时收集细胞,即为肿瘤血管内皮细胞(Td-EC)[6],该细胞具有结肠癌肿瘤细胞活性的肿瘤内皮细胞,当Td-EC处于对数生长期时,用于做管道形成试验。
1.4 细胞的同步化
采取血清饥饿法[7],用无血清培养基同步化Td-EC 24 h,使不同细胞同步于G0~G1期,实验前24 h将对数生长期的Td-EC用无血清培养基同步化,便于对实验结果的分析。
1.5 药物浓度的准备
公司提供PI3K抑制剂LY294002及MEK抑制剂PD 98059用无血清培养基将其稀释为浓度2.5、5、10、20μmol/L供实验时使用。二甲基亚砜(DMSO),分子量为78.13,将其用无血清培养基稀释为0.1%DMSO,供实验时使用。
1.6 管道形成实验
采用BD公司Matrigel胶,使用前应从-20℃转移至4℃待其自然溶化(如过夜放置),同时将实验需要与Matrigel胶接触的96孔板、200μL移液吸头均应预冷于4℃,铺胶所有过程均在冰上操作。在96孔板的每个孔内缓慢加入50μL BD Matrigel胶,不稀释。小心摇动使胶分布在孔的各个部位,避免产生气泡,同时在冰上静止5 min,使胶能够铺平,然后将96孔板水平轻轻放入5%CO2、37℃细胞培养箱中1 h,使用前需用无血清培养基轻洗Matrigel胶,水化基底膜。铺胶完毕后,应用细胞计数法计算细胞浓度,方法是用血细胞计数板计数细胞悬液中的细胞数目,以测定细胞增殖的状态和调整接种细胞浓度。消化法计数同步化细胞使其浓度为3×105个/mL,取100μL即含3×104个细胞,离心后弃上清,按照实验设计要求,分为对照组、实验组,实验组根据抑制剂浓度的不同分为2.5、5、10、20μmol/L,将已配好浓度的液体分别加入离心后的细胞中,充分混匀后加入96孔板中,将96孔板放入CO2、37℃恒温培养箱中培养。6 h后在倒置相差显微镜(10×20)下观察,并采集图像,每个孔取上、下、左、右、中5个区域.每个区域随机取一张图片,通过实验室中奥林巴斯倒置相差显微镜中的cellsens standard软件对每张图片进行测量,测出每张图片上管道形成的总长度(单位mm),每个实验均设3个复孔,每组有15个数据。
1.7 统计学方法
采用统计软件SPSS 16.0对实验数据进行分析,计量资料数据以均数±标准差(x±s)表示,各组数据比较用单因素方差分析,组间两两比较用q检验。计数资料以率表示,采用χ2检验。以P<0.05为差异有统计学意义。
2 结果
2.1 PI3K/AKT信号通路抑制剂对结直肠癌血管内皮细胞管道形成的结果
采用单因素方差分析比较,对照组中结直肠癌血管内皮细胞在Matrigel基质胶上形成管道状结构,逐渐相连呈网状,而实验组形成的管道长度较对照组均减少,差异有统计学意义(P<0.05);q检验比较结果显示,随着抑制剂浓度增高,各组管道形成总长度逐渐减少,差异有统计学意义(P<0.05)。见表1。图1结果显示,对照组中的正常组和0.1%DMSO组即开始由原来的多角形变成长梭形,并向Matrigel基质胶中延伸生长,而后呈线形排列成管状结构,6 h后多个管状结构相互连接形成三维网状结构;而在2.5μmol/L组可以看到一定数量的管腔结构,大部分为数量较长的线状结构,在5μmol/L组中的管腔结构较2.5μmol/L组有所减少,多为线性结构,在10μmol/L组和20μmol/L组中基本上看不到管腔形成,10μmol/L组可见看到较多内皮细胞组成的线形结构,而在20μmol/L组中看到的内皮细胞皮细胞均为圆形,基本上无线性结构。

表1 LY294002对结直肠癌血管内皮细胞管道形成的影响
2.2 ERK/MEK信号通路抑制剂对结直肠癌血管内皮细胞管道形成的结果
方差分析结果显示,不同浓度PD98059作用结直肠癌血管内皮细胞6 h后形成管腔结构情况是不同的,各组间差异有统计学意义(P<0.05),提示随着PD98059浓度的增高,管道形成长度逐渐减少,见表2。由图2可见,在浓度为20μmol/L时,看不到管腔结构,有少量较短的内皮细胞连接在一起的线状结构,多数为单个的圆形内皮细胞,而在10μmol/L时,线状结构较20μmol/L数量多一些,在5μmol/L时可以看到少量的管腔结构,2.5μmol/L时可以看到多一些管腔结构,连接成三维网状,对照组可见多个管状结构相互连接形成三维网状结构。
2.3 PI3K/AKT信号通路抑制剂及ERK/MEK信号通路抑制剂管道形成之间比较
LY294002及PD98059抑制剂均能显著抑制肿瘤内皮细胞管道形成。表3显示在相同抑制剂浓度作用下,其间管道形成的长度不同,差异有统计学意义(P<0.05),由此可以说明LY294002对肿瘤血管内皮细胞管道形成的抑制作用较PD98059强。见表3。

图1 PI3K/AKT信号通路抑制剂(LY294002)对结直肠癌血管内皮细胞管道形成的影响(200×)
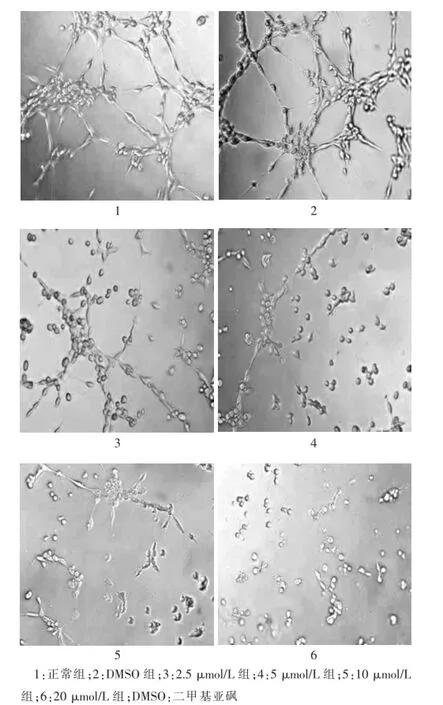
图2 ERK/MEK信号通路抑制剂(PD98059)对结直肠癌血管内皮细胞管道形成的影响(200×)
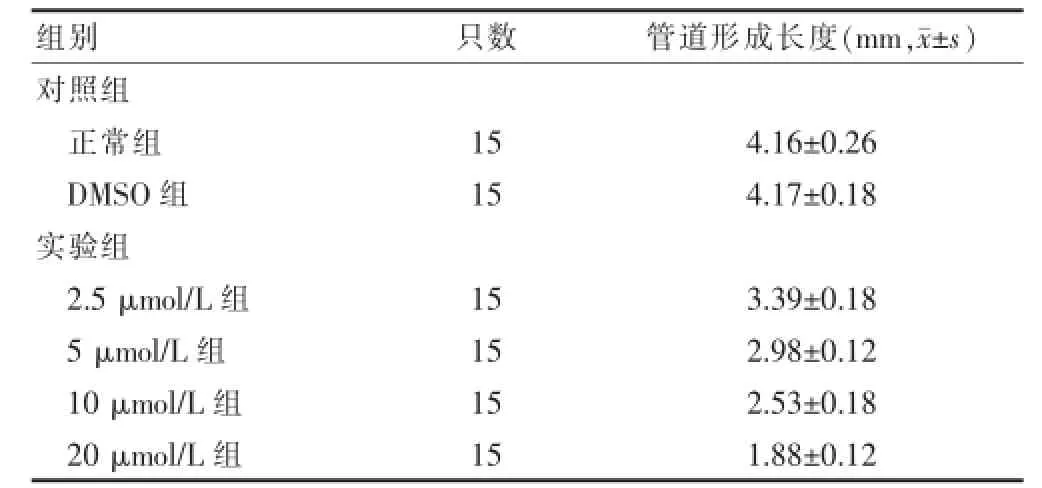
表2 PD98059对结直肠癌血管内皮细胞管道形成的影响
表3 不同浓度LY294002及PD98059作用下结直肠血管内皮细胞管道长度(mm±s)
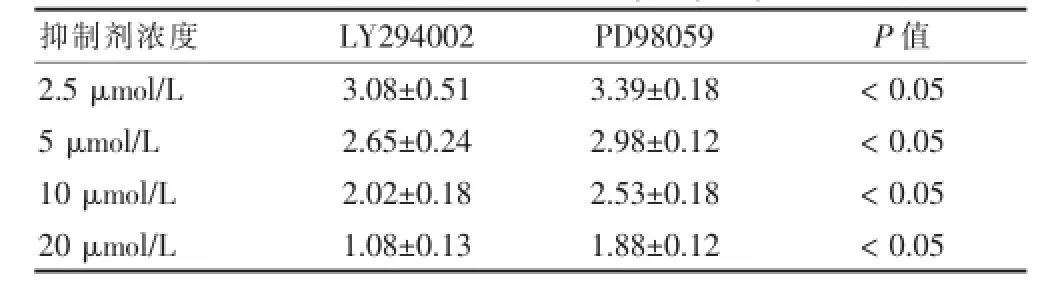
表3 不同浓度LY294002及PD98059作用下结直肠血管内皮细胞管道长度(mm±s)
抑制剂浓度LY294002 PD98059 P值2.5μmol/L 5μmol/L 10μmol/L 20μmol/L 3.08±0.51 2.65±0.24 2.02±0.18 1.08±0.13 3.39±0.18 2.98±0.12 2.53±0.18 1.88±0.12<0.05<0.05<0.05<0.05
3 讨论
结直肠癌是我国目前常见的恶性肿瘤之一,它的生长可分为两个时期即无血管期和血管期,无血管期的肿瘤细胞主要依靠扩散作用进行物质交换,肿瘤生长缓慢,肿瘤的营养供给及代谢物排泄仅能靠简单的物理弥散,但随着肿瘤细胞的不断增殖,扩散作用不能满足肿瘤细胞进一步增长的需要,肿瘤将启动血管生成这一复杂过程,新生血管为肿瘤提供丰富的血液灌注和充足的营养物质,在良好的生长环境下,肿瘤组织迅速生长,它是肿瘤细胞代谢产物排泄的有效途径,它也是肿瘤细胞向远处转移的重要通道,肿瘤细胞通过血管才能到达转移地点[8]。体内的血管新生是由于恶性肿瘤自身分泌许多促进血管新生因子[9]而转向促血管新生,内皮细胞的增生、移动、管道形成是血管生成所必需的步骤,肿瘤血管生成是导致肿瘤从“良性休眠”的无血管期状态过渡到“恶性疯长”的血管期状态的关键[10]。有学者研究Notch信号通路途径在血管发育的过程中起着重要作用,可以直接影响血管重构、血管稳定性、血管平滑肌细胞的分化、动静脉发生选择等[11-12]。
本实验选用的信号通路抑制剂是PI3K/AKT及ERK/MEK信号通路抑制剂。其中PI3K/AKT信号通路控制着众多在肿瘤发生发展中至关重要的细胞生物学过程,包括细胞凋亡、转录、翻译、代谢、血管生成以及细胞周期的调控[13],PI3K是AKT/mTOR通路的上游分子,其异常激活可以引起一系列的反应,包括细胞的生长、增殖和转移、上皮细胞向间叶细胞的转变以及血管的生成,PI3K/AKT信号通路的激活能活化AKT,AKT又称蛋白激酶B,是一类调节细胞凋亡与存活的胞浆信号转导蛋白,生理状态下,AKT以低活性(失活状态)存在于细胞浆,当各种外因刺激时,AKT在三磷酸酰肌醇蛋白激酶作用下发生磷酸化而激活[14-15],在胃肠道肿瘤、胰腺癌等组织中AKT均高表达及活化,AKT信号通路的激活在肿瘤的发生、发展过程中起重要的纽带作用,体内许多肿瘤发生均与该通路异常激活密切相关,而活化的AKT通过磷酸化作用激活或抑制多种底物来调节细胞功能,包括细胞代谢、蛋白质合成、细胞凋亡、细胞周期进程,进而调节细胞的增殖、分化、凋亡以及迁移等[16-17]。内皮细胞一氧化氮合成酶(endothelial nitric oxide synthase,eNOS)是调节血管生成和血管张力的重要因子。内皮细胞体外培养表明:转染IGF-1和VEGF可以通过PI3K通路诱导eNOS的合成,其活性磷酸化序列为RIRTQS(1177)F;AKT可以和eNOS共定位于细胞膜、并使Ser1177磷酸化;而PI3K抑制剂可以降低AKT的活性和Ser1177的磷酸化水平[18],另外一项研究表明:PI3K抑制剂可以阻断雌二醇介导的eNOS释放,而雌二醇可以刺激AKT的活性和eNOS的磷酸化水平[19]。研究发现人类的多种肿瘤如胃癌、大肠癌、乳腺癌、肝癌、肾癌等均与PI3K/AKT信号通路密切相关,且PI3K/AKT信号通路中多种上下游分子的改变均可影响肿瘤的发生和发展,信号通路可从凋亡、炎性反应、免疫等多方面影响肿瘤的发生和发展。其靶向抑制剂不仅能减少VEGF的分泌,还可抑制血管形成,该通路具有重要的临床意义[20],其中LY294002[21]是PI3K-AKT信号通路抑制剂最经典的抑制剂,具有靶向抑制PDK催化亚基pl10的作用,从而抑制肿瘤生长及肿瘤血管形成[22]。
ERK/MEK信号通路中有丝分裂原激活蛋白激酶(MAPK)是细胞内重要的信号传导通路,需被细胞因子激活后才起作用,多种肿瘤或增殖性疾病与其有关[23],具有调控机体细胞的增殖、分化、转化及凋亡等多种功能,细胞外信号调节激酶(ERK)通路是其中重要的传导通路,MEK是其中的重要一环,PD98059是一种特异性的MEK抑制剂,通过与MEKl/2的非活化形式结合阻止其磷酸化,进而抑制ERKl/2的磷酸化而阻断细胞信号转导,它几乎可以抑制所有ERK亚族的活性,从而抑制肿瘤细胞的增殖[24]。PD98059是选择性的细胞内MAPK传导通路的特异抑制剂,能够抑制ERK的上游激酶MAPK激酶(MEK),理论上能够阻断增殖信号的传递,从而抑制肿瘤细胞的生长。
本实验所采用的BD公司Matrigel胶,它是从富含胞外基质蛋白的EHS小鼠肿瘤中提取出基底膜基质,其主要成分有层粘连蛋白、Ⅳ型胶原、巢蛋白、硫酸肝素糖蛋白,还包含生长因子和基质金属蛋白酶等。在室温条件下,Matrigel聚合形成具有生物学活性的三维基质,模拟体内细胞基底膜的结构、组成、物理特性和功能。通过实验结果看,对照组中TD-EC在Matrigel基质胶上形成管道结构,逐渐相连呈网状,两者之间差异无统计学意义(P>0.05),DMSO是两种抑制剂LY294002及PD98059的初始溶剂。因此,检测DMSO组与正常组之间TD-EC管道形成能力有无差别,实验发现两者之间管道形成无任何差别,说明小剂量DMSO作为LY294002、PD98059的溶剂不影响肿瘤血管内皮细胞的管道形成能力,随着抑制剂浓度的增高,管道形成长度逐渐减少,经过统计学分析其间差异有统计学意义(P<0.05)。两种抑制剂之间相互比较发现,LY294002对肿瘤血管内皮细胞管道形成的抑制作用较PD98059强。
为了进一步早期抑制肿瘤发生,有必要对结直肠癌疾病进行深入研究,以明确结直肠癌危险因素和切实其病因从而采取有效的防治措施,减少结直肠癌的发病率。本研究通过两种不同的信号通路抑制剂LY294002及PD98059检测对肿瘤血管内皮细胞管道形成的影响,使其有可能成为抑制肿瘤生长的潜在治疗靶点。P13K/AKT信号通路及MEK/ERK信号通路在肿瘤血管的发生发展过程中发挥重要作用,尤其是其抑制剂在肿瘤靶向治疗方面的研究已取得可喜的进展,但因信号通路内的关系错综复杂,目前抗肿瘤的研究多局限于单一靶向治疗,但其具体机制及与其他信号途径之间的相互影响、相互联系尚不完全清楚,如多种信号通路联合使用能否更加有效抑制管道形成,其相关实验需进一步证实。本实验中PI3K/Akt及ERK/MEK信号通路抑制剂能够显著抑制肿瘤内皮细胞小管形成,从而抑制肿瘤血管新生,为今后在肿瘤的临床监测、基因靶向治疗、预后评估、药物疗效及新药研发等提供科学的实验依据。
[1]张洪英,陈军宝,卢宏柱.PI3K/Akt信号通路在肿瘤血管形成中的作用研究进展[J].山东医药,2012,52(47):98-100.
[2]朱园园,毕明宏.DLL4/NoTCH通路与肿瘤血管生成关系研究进展[J].临床肺科杂志,2012,17(1):125-126.
[3]江克华,董自强,宋兴福,等.PI3K/PTEN信号通路与肿瘤血管形成关系的研究进展[J].实用医学杂志,2011,27(22):4169-4170.
[4]曹亮,曹亚.MAPK信号通路与肿瘤侵袭和转移研究进展[J].肿瘤防治研究,2002,29(5):419-421.
[5]Folkman J.Isolation ofa tumor factor responsible to angiogenesis[J].JExp Med,1971,133(2):275-288.
[6]蒋力,何勇,蒋耀光,等.肿瘤源性血管内皮细胞的培养及其细胞生物学特性鉴定[J].重庆医学,2009,38(24):3102-3104.
[7]宋春娇,吕冰洁,张小玲,等.血清饥饿法用于细胞周期同步化的方法学研究[J].中国地方病学杂志,2003,22(4):362-364.
[8]王杰军,许青.血管形成:恶性肿瘤生长发展的命脉[J].世界科学,2001,(2):26-27.
[9]张中林,毛晓雯,张吉发,等.人促血管生成素2单链抗体对裸鼠人肝癌血管生成及肿瘤生长的作用[J].中华实验外科杂志,2013,30(8):1642-1645.
[10]赵改平,许世雄,陈二云,等.实体肿瘤血管生成和肿瘤生长的耦合研究[J].力学,2008,29(4):622-626.
[11]王莉,刘向东,赵星成,等.Notch信号途径在血管形成和内皮细胞中的作用[J].细胞与分子免疫学杂志,2012,28(8):39-41.
[12]纵单单,陈平,陈燕.Notch信号通路在血管生成中的作用研究进展[J].国际呼吸杂志,2012,32(4):299-304.
[13]丘雅维,杨惠玲.PI3K通路及其抑制剂抗肿瘤的研究进展[J].中山大学学报:医学科学版,2009,30(3):244-246.
[14]Polak R,Buitenhuis M.The PI3K/PKB signaling module as key regulator of hematopoiesis:implications for therapeutic strategies in leukemia[J].Blood,2012,119(4):911-923
[15]Almhanna K,Strosberg J,MalafaM.Targeting AKT protein kinase in gastric cancer[J].Anticancer Res,2011,31(12):4387-4392.
[16]颜晓燕,成志勇,李琳,等.PTEN抑制人脐静脉内皮细胞ECV304的增殖和VEGF的表达[J].中国肿瘤生物治疗杂志,2011,18(5):508-513.
[17]Zhu L,LooWT,LouisWC.PTEN and VEGF:possible predictors for sentinel lymph nodemicro-metastsis in breast cancer[J].Biomed Pharmarcother,2007,61:558-561.
[18]Michell BJ,Griffiths JE,Mitchelhill KI,et al.The Akt kinasesignalsdirectly toendothelialnitric oxidesynthase[J]. Curr Biol,1999,9(15):845-848.
[19]Hurt H,Musicki B,Palese M,et al.Akt-dependent phosphorylation of endothelial nitric-oxide synthasemediates penile erection[J].Proc NatlAcad Sci,2002,99(6):4061-4066.
[20]Karat J,Maity A.PI3K/Akt/mTOR pat hway i n angiogenesis[J].FrontMol Neur osci,2011,4(51):1-7.
[21]Liu YY,Zhang X,RingelMD,etal.Modulation ofsodiumiodide symporter expression and function by LY294002,Akti-1/2 and Rapamycin in thyroid cells[J].Endoce RelatCancer,2012,19(3):291-304.
[22]雅维,杨惠玲.P13K通路及其抑制剂抗肿瘤的研究进展[J].中山大学学报:医学科学版,2009,30(3):223-226.
[23]Zhu X,Castellani RJ,Takeda A,et al.Differential activation of euronal ERK,JNK/SAPK and p38 in Alzheimer diease:the two hit hypothesis[J].Ech Ageing Dev,2001,123:39-46.
[24]Zellmer S,Schmidt-Heck W,Godoy P,et al.Transcription factors ETF,E2F,and SP-1 are involved incytokine-independentproliferationofmurine hepatocytes[J].Hepatology,2010,52(6):2127-2136.
The role of PI3K/AKT and ERK/MEK signaling pathway inhibitors on colorectal cancer vascular endothelial cells in tube formationing
HAO Zhinan ZHENG Yongbin XIAO Gaochun LIShengbo
Department of Gastrointestinal Surgery,Renmin Hospital ofWuhan University,Hubei Province,Wuhan 430060,China
Objective To study of the effect of PI3K/AKT and ERK/MEK signaling pathway inhibitors on colorectal cancer vascular endothelial cells in tube formationing.M ethods The experiment were divided into control group and experiment group,the control group was divided into the normal group and the 0.1%DMSO group,and experiment group was divided into PI3K/AKT signaling pathway inhibitors groups LY294002 and ERK/MEK signaling pathway inhibitors group PD98059(each group had 4 concentration gradients).Those pipe formation in different inhibitor concentration degree(2.5,5,10,20μmol/L)were compared,and its inhibitory effects on thismicro-vascular forming ability by counting the total length the pictures come from upper,lower,left,right of the tubes formed after six hours were detected.In each hole,each group had three samples,all data were epressed by mean standard deviation,and SPSS16.0 software to conduct statistical analysis was used,it had statistical significance when P<0.05.Results The length of tubule formation between normalgroup and DMSO group had no difference[(4.16±0.26)mm vs(4.17±0.18)mm], and the experiment group tubule formation had decreased significantly compared to control group(P<0.05).The length of the pipe forming were(3.08±0.51),(2.65±0.24),(2.02±0.18),(1.08±0.13)mm,when LY294002 concentration were 2.5,5,10,20μmol/L,and PD98059 were(3.39±0.18), (2.98±0.12),(2.53±0.18),(1.88±0.12)mm,with the increase of concentration,pipe forming length gradually reduced,there were statistical significances(P<0.05). Comparedwith PD98059,the pipe forming of LY294002decreased under the same concentration(P<0.05).Conclusion PI3K/AKT and ERK/MEK signal pathway inhibitors can inhibit tube formation from colorectal cancer vascular endothelial cells,with the increasing inhibitor concentration, tube formation ability decreased further.PI3K/AKT signaling pathway inhibitors is obvious in inhibit piping formation ability than the MEK/ERK signaling pathway inhibitor.
PI3K/AKT inhibitors(LY294002);ERK/MEK inhibitors(PD98059);Tumor vascular endothelial cells; Tube formation
R587.1
A
1673-7210(2014)08(b)-0030-06
2014-04-01本文编辑:卫轲)
国家自然科学基金(编号81372553)。
郝志楠(1982.11-),男,湖北十堰人,武汉大学人民医院2012级胃肠外科专业在读硕士研究生。
郑勇斌(1970.10-),男,湖北监利人,博士,副主任医师;研究方向:胃肠道肿瘤。

