转谷氨酰胺酶改善大豆11S球蛋白聚合的研究
刘 颖,徐锦丽,瑙阿敏,郑智超,窦博新
(哈尔滨商业大学食品工程学院,黑龙江哈尔滨150076)
转谷氨酰胺酶改善大豆11S球蛋白聚合的研究
刘 颖,徐锦丽,瑙阿敏,郑智超,窦博新
(哈尔滨商业大学食品工程学院,黑龙江哈尔滨150076)
研究了转谷氨酰胺酶(Transglutaminase,TGase)改善大豆11S蛋白聚合的条件。采用碱性蛋白酶酶解大豆蛋白11S,再利用转谷氨酰胺酶对酶解后的大豆蛋白11S进行聚合,得知改性后大豆蛋白11S聚合物的分子量15ku左右。加酶量在30U/g时,TGase对催化大豆蛋白11S聚合效果最佳,加酶量过高或过低均不利于反应。离子强度I=0.2时有利于聚合物的形成。pH在8.0~9.0之间有利于聚合物的形成。反应温度在45℃左右有利于TGase酶发挥活性使得聚合物更易形成。改性前乳化性及其稳定性分别是30.27%和37.78%,改性后乳化性及其稳定性分别是61.15%和79.28%。
大豆蛋白11S,转谷氨酰胺酶,酶改性,乳化性及乳化稳定性
大豆蛋白质是人类最丰富和最经济的植物蛋白质资源[1]。大豆蛋白中球蛋白占总蛋白的50%~90%,其主要成分为大豆球蛋白(glycinin,主要是11S)和β-伴球蛋白(β-conglycinin,主要是7S),两者合在一起约占大豆球蛋白的70%,是大豆中的储藏蛋白。11S大豆蛋白等电点是pH4.64。pH4.64时,溶解度随离子强度和温度而变化。在工业生产和实验研究中[2],豆浆中形成了许多11S蛋白的多聚体,都可以破坏二硫键的作用,可以提高蛋白质的浓度和溶解度。
转 谷 氨 酰 胺 酶(Transglutaminase,TGase;EC2.3.2.13;全称为蛋白质-谷氨酰胺-γ-谷氨酰胺基转移酶)是一种能催化多肽或蛋白质的谷氨酰胺残基的γ-羧酰胺基团(酰基的供体)与许多伯胺化合物(酰基的受体,包括蛋白质赖氨酸残基的ε-氨基)之间的酰基转移反应的酶[3]。转谷氨酰胺酶广泛存在于动物、植物和微生物中[4-6]。微生物转谷氨酰胺酶(MTGase)属于胞外酶,等电点为pH8.9,最适pH是5~ 8,最适温度50℃,其活性不依赖Ca2+。食品中蛋白质如酪蛋白、大豆球蛋白、肌蛋白都对Ca2+敏感,在Ca2+存在下易沉淀,对酶的反应性降低[7-9]不同来源的TGase理化特性具有一定的差异。哺乳动物来源的TGase催化活性高,但其来源少,分离纯化工艺复杂,热稳定性差,使之不可能在食品工业中广泛应用[10]。国外已有学者研究了TGase催化蛋白交联作用机制研究中,Nonaka等[11]最早报道了TGase能催化大豆球蛋白聚合,之后相继有学者研究了TGase催化大豆蛋白的交联反应。Chanyongvorakul等[12]研究了大豆11S球蛋白经TGase催化的交联反应,结果显示TGase仅能催化11S球蛋白的酸性亚基通过形成分子间的交联而产生聚合。本文主要研究TGase催化酶解后的大豆11S球蛋白交联的不同反应条件,并且讨论了改性前后大豆11S球蛋白乳化性及其稳定性的变化情况。
1 材料与方法
1.1 材料与仪器
脱脂大豆蛋白 哈尔滨高科技(集团)股份有限公司;转谷氨酰胺酶 合肥博美生物科技有限责任公司;Alcalase碱性蛋白酶(活力≥200000U/g) 北京奥博星生物技术有限责任公司;N-苄氧羰基-L-谷氨酰甘氨酸(N-α-CBZ-Gln-Gly)、还原型谷胱甘肽、L-谷氨酸γ-单羟肟酸(L-Glutamic acid γmonohydroxamic acid)、十二烷基磺酸钠(SDS)、N,N,N’,N’-四甲基乙二胺(TEMED)、盐酸羟胺(hydroxylamine) Sigma公司;丙烯酰胺(超纯)、N,N’-亚甲基双丙烯酰胺(超纯)、巯基乙醇 Amresco公司;甘油 天津市致远化学试剂有限公司;过硫酸铵 西陇化工股份有限公司。
Spectrum722E型紫外可见分光光度计 上海光谱仪器有限公司;80-2型高速离心机 上海浦东物理光学仪器厂;SY-2-4型恒温水浴锅 天津市欧诺仪器仪表有限公司;BG-verMINI型迷你垂直电泳仪北京百晶生物技术有限公司。
1.2 实验方法
1.2.1 转谷氨酰胺酶的酶活测定 转谷氨酰胺酶活性采用Folk等报道[13]的分光Hydroxamate分析法测量。最终反应物包含0.1mol/L Tris-HCl缓冲液,pH6.0,30mmol/L N-α-CBZ-Gln-Gly,0.1mol/L hydroxylamine。于37℃与0、0.2、0.4、0.6、0.8、1.0mmol/mL酶溶液反应10min后添加氯化铁/三氯醋酸试剂(0.7%,w/v)终止酶反应。离心去除沉淀,所形成的红色于525nm测定吸光度,重复三次平行实验。用L-Glutamic acid γmonohydroxamic acid作标准曲线。单位转谷氨酰胺酶活力(U)定义为每min产生1μmol/L羟肟酸(hydroxamic acid)所需的酶量。
1.2.2 大豆蛋白11S制备 按照Nagano等[14]的方法从原料大豆蛋白粉中提取大豆蛋白11S。
1.2.3 碱性蛋白酶酶解11S 配制1.0%蛋白溶液加入40U/g的Alcalase碱性蛋白酶于37℃条件下恒温酶解反应1h。
1.2.4 不同条件对大豆蛋白11S聚合的影响
1.2.4.1 加酶量对大豆蛋白11S聚合的影响 酶反应体系为溶于0.05mol/L缓冲液(pH7.5)的1.0%大豆蛋白溶液。分别添加10、20、30、40、50U/g TGase酶,反应混合物于37℃,100r/min下恒温酶解反应2h,三次平行实验。反应后直接加入电泳样品缓冲液,终止反应。进行SDS-PAGE,然后进行光密度扫描,以确定聚合后聚合产物含量的改变。
1.2.4.2 离子强度对大豆蛋白11S聚合的影响 酶反应体系为溶于不同离子强度(0.05、0.08、0.1、0.2、0.5mol/kg)的缓冲液的1.0%大豆蛋白溶液。添加20U/g TGase,反应混合物于37℃,100r/min下反应2h,三次平行实验。反应后直接加入电泳样品缓冲液中止酶反应。经SDS-PAGE后,进行光密度扫描,确定聚合物含量的改变。
1.2.4.3 pH对大豆蛋白11S聚合的影响 酶反应体系为溶于不同pH(7.1、7.5、8.0、8.5、9.0)的缓冲液的1.0%大豆蛋白溶液。添加20U/g TGase酶蛋白,反应混合物于37℃,100r/min下反应2h,三次平行实验。反应后直接加入电泳样品缓冲液中止酶反应。经SDSPAGE后,进行光密度扫描,确定聚合物含量的改变。1.2.4.4 反应温度对大豆蛋白11S聚合的影响 酶反应体系为溶于0.05mol/L缓冲液(pH7.5)的1.0%大豆蛋白溶液。添加20U/g TGase酶,反应混合物于不同温度(30、37、40、45、50℃)下100r/min分别反应2h,三次平行实验。反应后直接加入电泳样品缓冲液中止酶反应。SDS-PAGE后,进行光密度扫描,确定聚合物含量的改变。
1.2.5 改性后大豆蛋白11S乳化性及乳化稳定性研究 用0.2mol/L pH7的磷酸盐缓冲溶液配制1.0%的蛋白溶液100mL,以1∶1(v∶v)的比例加入100mL色拉油中,磁力搅拌器充分搅拌,形成均一的乳化液。倒入离心管中记下液面高度,在1500r/min的速度下离心10min,取出测量上层乳化层的高度,三次平行实验,按下式计算乳化能力。
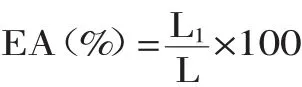
式中,EA—乳化性;L1—离心管乳化层高度;L—总高度。
将上述样液继续于1500r/min的速度下离心20min,测量残留的乳化层高度,三次平行实验,按下式计算乳化稳定性:
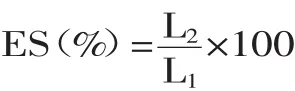
式中,ES—乳化稳定性;L2—残留高度;L1—离心管乳化层高度。
2 结果与讨论
2.1 转谷氨酰胺酶酶活标准曲线及酶活力
标准曲线的线性回归方程是:y=0.933x+0.014,R2=0.9992。
式中:x为L-谷氨酸γ-单羟肟酸的浓度(mmol/mL),y为525nm处的吸光值。
酶活计算公式:
转谷氨酰胺酶酶活(U/mL)=(A+0.0049)×n/(0.1029×10×V)
式中:A:吸光值;n:酶的稀释倍数;10:反应时间(min);V:参加反应体积。

图1 转谷氨酰胺酶标准曲线Fig.1 Plot of TGase activity
经测定,结果酶活为100U/mL。
2.2 大豆蛋白11S电泳图
大豆蛋白11S组成比较单一,分子量为302000~375000,且有12个亚基,6个酸性亚基和6个碱性亚基构成的两个环状六角形结构,酸性和碱性亚基交互对应形成较稳定的结构形式。图2为按照Nagano方法从脱脂豆粉中制备大豆蛋白11S的SDS-PAGE电泳图,图谱中主要蛋白条带所对应的亚基相对分子质量与文献报道相吻合。
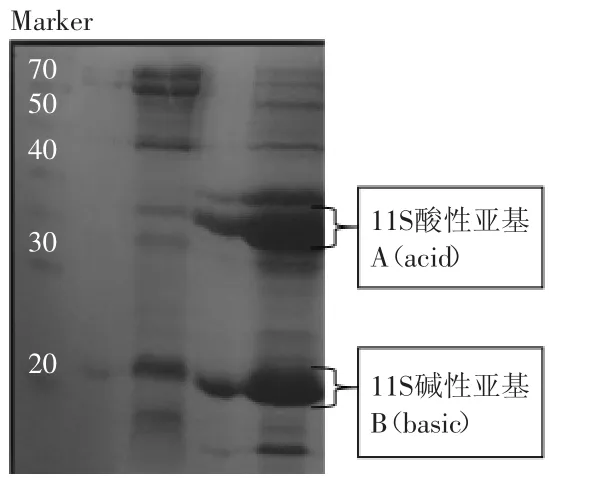
图2 大豆球蛋白11S电泳图Fig.2 SDS-PAGE profiles of glycinin
2.3 加酶量对TGase催化大豆蛋白11S聚合的影响
酶的添加量对于酶促反应是很重要的。如果添加量少,那么可作用于催化的活性中心就少,再者在一定反应环境下,如酸性、碱性或者偏热环境,会有酶失活的机会,即使反应时间长,也不会达到应有的催化效果。因此,一定要掌握最适合的加酶量。图3为聚合物的SDS-PAGE电泳图,从图3中可以看到,聚合物分子量在15ku左右,随后随着加酶量的增加聚合物分子量变化不大。图4为聚合物的相对光密度随加酶量的变化,从图4中可以看到随着给酶量的增加,催化反应速度也在加快,当增加到30U/g蛋白的时候,催化反应基本完全。当继续加酶时,光密度骤减。分析原因,可能是酶的量增加,使蛋白和酶碰撞的机会减少,而增加了酶和酶碰撞的机会,这样会使暴漏的活性中心减少,那么底物蛋白就失去了被催化的机会,反应速度减慢。

图3 不同加酶量下的大豆蛋白11S的SDS-PAGE图谱Fig.3 SDS-PAGE profiles of glycinin,after adding TGase
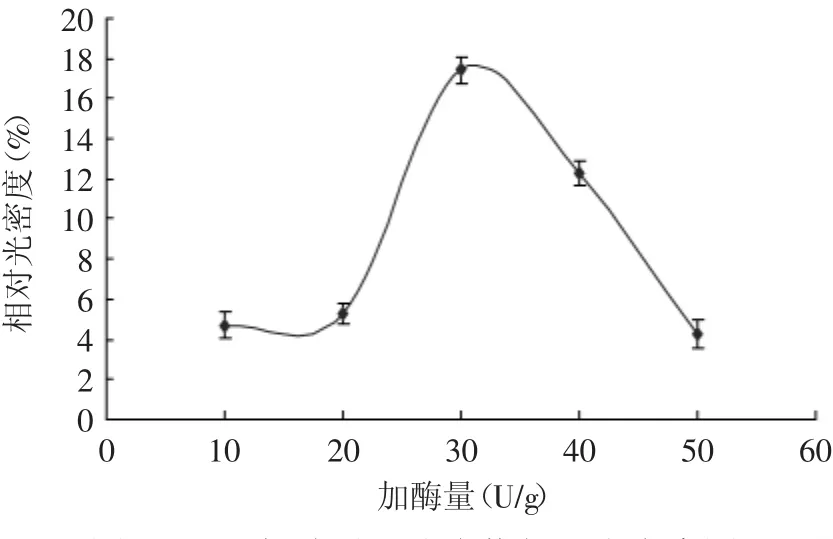
图4 不同加酶量下聚合物相对光密度图Fig.4 Relative density of glycinin,after adding various amount of TGase
2.4 离子强度对TGase催化大豆蛋白11S聚合的影响
考虑设计离子子强度这一个考察因素主要从两方面分析;一方面是盐的浓度,也就是离子浓度的不同会影响大豆蛋白的溶解度。而底物蛋白的溶解性能是影响酶的催化活性的一个重要因素[15]。一定条件下大豆蛋白的溶解性会随离子强度增加而增加,即使在较高离子强度下,大豆蛋白也能较完全的溶解。另一方面,不同的盐浓度、盐的种类也会影响酶的催化效果。从图5中可以看到,离子强度的增加对聚合物分子量的改变不大,聚合物的分子量在15ku左右。但从图6中可以看到随着离子强度的增加聚合物的相对光密度先增加后减小,在离子强度=0.2时相对光密度达到最大,随后随着离子强度的增加相对光密度减小。这可能是因为如果溶解度没有降低的话,就有可能是高离子浓度抑制了酶的催化性,或者在浓度不同的环境下,底物蛋白的存在形式有所改变,导致可催化位点被掩盖,导致聚合物的相对光密度降低。

图5 离子强度对TGase催化大豆蛋白11S聚合的SDS-PAGE图Fig.5 SDS-PAGE profiles of glycinin,after adding TGase
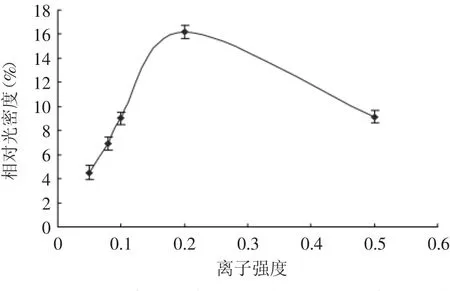
图6 不同离子强度下聚合物相对光密度图Fig.6 Relative density of glycinin,after adding TGase at different ionic strength
2.5 pH对TGase催化大豆蛋白11S聚合的影响
一方面大豆蛋白的溶解度受pH影响很大,另一方面TGase的最适pH范围为5.0~8.0,pH过高活过低都会影响它的活性,因此本实验的pH条件选为7.1、7.5、8.0、8.5、9.0。图7为不同pH条件下TGase催化大豆蛋白11S聚合的SDS-PAGE图,从图7中可以看到在催化2h后,明显在15ku左右出现了聚合物,但随着pH的增加聚合物分子量没有明显的变化。从图8分析来看,相对光密度随pH的增大先减小后增大,pH在8.0~9.0聚合物含量增加但增加幅度不大,所以可以认为这一范围是催化的最佳反应条件。在pH为7.5的时候相对光密度最小,这说明在pH7.5时聚合物的含量最少。出现这种情况可能因为pH7.5是该改性物质的等电点,在等电点处蛋白质的溶解度最小。

图7 pH对TGase催化大豆蛋白11S聚合的SDS-PAGE图Fig.7 SDS-PAGE profiles of glycinin,afteadding TGase

图8 不同pH催化的聚合物相对光密度图Fig.8 Relative density of glycinin,after adding TGase at different pH
2.6 反应温度TGase催化大豆蛋白11S聚合的影响
对于酶催化蛋白的反应,温度的影响应该是重要因素之一。温度过高无论是底物蛋白还是酶蛋白都会发生变性沉聚,而温度低又发挥不出酶的催化效果。本实验所使用的TGaes的最适温度在40~50℃,因此本实验的温度条件选取为30、37、40、45、50℃。图9为不同温度下催化2h的SDS-PAGE图谱,从图9中可以得到聚合物的分子量大约在15ku左右。随着温度升高聚合物分子量没有明显的变化,说明这一温度范围不会明显改变酶活。从图10中可以观察到随温度的上升聚合物量增大,但温度达到45℃时继续升高温度聚合物的量改变不大,所以45℃是其反应的最佳温度。这是说明TGase酶在这一范围内随温度的增高酶活变大,达到最适温度后继续增加温度对反应的影响不大。

图9 反应温度对TGase催化大豆蛋白11S的SDS-PAGE图谱Fig.9 SDS-PAGE profiles of glycinin,after adding TGase

图10 反应温度催化的聚合物相对光密度图Fig.10 Relative density of glycinin,after adding TGase at different reaction temperature
2.7 改性前后大豆蛋白11S乳化性测定
大豆蛋白的乳化性作用是通过在水-油界面形成一层蛋白质膜包裹油滴,从而使油滴均匀分布在水相中。影响乳化稳定性的因素有:油滴大小、水-油界面蛋白膜的粘弹性和蛋白质颗粒空间结构。由图11可知改性后大豆蛋白11S的乳化性及乳化稳定性均有所提高,改性前乳化性及其稳定性分别是30.27%和37.78%,改性后乳化性及其稳定性分别是61.15%和79.28%。这是因为酶解改变了大豆蛋白11S结构,使其更易在水-油界面形成蛋白质膜,使其乳化性及乳化稳定性增加。

图11 改性前后大豆蛋白11S乳化性及乳化稳定性变化图Fig.11 Comparison of emulsification and its stability on modified and native soybean 11S globulin
3 结论本实验研究了TGase催化酶解后的大豆蛋白11S聚合的条件。采用碱性蛋白酶酶解大豆蛋白11S,再利用转谷氨酰胺酶对酶解后的大豆蛋白11S进行聚合,得知改性后大豆蛋白11S聚合物的分子量在15ku左右。加酶量30U/g、离子强度I=0.2、pH8~9.0、反应温度45℃均有利于TGase对催化大豆蛋白11S交联。改性前乳化性及其稳定性分别是30.27%和37.78%,改性后乳化性及其稳定性分别是61.15%和79.28%。利用TGase催化酶解后的大豆蛋白11S交联可以有效改善蛋白质的结构及分子量,这种改性所得聚合物在结构和大小方面使其更易在水-油界面形成蛋白质膜,因此改性后的蛋白质的乳化性及稳定性都有了显著的提高。
[1]Qi G,Venkateshan K,Mo X,et al.Physicochemical properties of soy protein:Effects of subunit composition[J].Agric Food Chem,2011,59(18):58-64.
[2]Saio K.Differences in functional properties of 7S and 11S soybean proteins[J].Journal of Texture Studies,1978,9:1335-1347.
[3]Lorand L,Graham RM.Transglutaminases:cross-linking enzymes with pleiotropic functions[J].Nat Rev Mol Cell Biol,2003,4:140-156.
[4]Serafini-Fracassini D,Del Duca S,Beninati S.Plant transglutaminases[J].Phytochemistry,1995,40(2):355-365.
[5]Ha CR,Iuchi I.Transglutaminase[M]//Whitaker J R,Voragen AGJ,Wong DWS.Handbook of Food Enzymology.NewYork:Marcel Dekker,2003:637-655.
[6]Yokoyama K,Nio N,Kikuchi Y.Properties and applications of microbial transglutaminase[J].Applied Microbiology Biotechnology,2004,64(4):447-454.
[7]Jiang S T,Lee J J.Purification,characterization and utilization of pig plasma factorⅩⅢ a[J].Journal of Agricultural and Food Chemistry,1992,40(7):1101-1107.
[8]贺雷雨,李新华,王璋.谷氨酰胺转胺酶及其在食品加工中的应用[J].中国食物与营养,2004(4):32-34.
[9]梁华民,田少君,周怡,等.转谷氨酰胺酶对大豆分离蛋白交联聚合作用研究[J].粮食与油脂,2004(2):3-6.
[10]Kanaji T,Ozaki H,Takao T,et al.Primary structure of microbial transglutaminase from Streptovertillium sp.Strains-8112[J].J Biol Chem,1993,268(16):11565-11572.
[11]Nonaka M.Polymerization of several proteins by Caindependent transglutaminase derived from microorganisms[J].J Agric Biol Chem,1989,53:2619-2623.
[12]Chanyongvorakul Y,Matsumura Y M,Nonaka M,et al.Physical properties of soy bean and broad bean 11S globulin gels formed by transglutaminase reaction[J].J Food Sci,1995,60(3):483-493.
[13]Folk JE.Structural requirements of specific substrate for guinea pig liver Transglutaminase[J].Biol Chem,1965,240:2951-2960.
[14]Nagano T,Hirotsuka M,Mori H.Dynamic viscoelastic study on the gelation of 7S globulin from soybean[J].J Biol Chem,1965,240:2951-2960.
[15]唐传核,杨晓泉,彭志英,等.微生物转谷氨酰胺酶催化大豆11S球蛋白聚合研究[J].食品科学,2002,23(3):42-46.
Study on condition of polymerization of 11S globulin by TGase
LIU Ying,XU Jin-li,NAO A-min,ZHENG Zhi-chao,DOU Bo-xin
(College of Food Engineering,Harbin University of Commerce,Harbin 150076,China)
The conditions of polymerization of 11S globulins by Transglutaminase(TGase)was studied.Firstly,the 11S globulins was hydrolyzed by Alcalase and then polymerized by TGase,the result showed that soybean 11S globulins polymer molecular weight about 15ku.The appropriate enzyme amount for polymerization of 11S was 30U/g,over or below was not good for the reaction.Ionic strength was 0.2,that was beneficial to the formation of polymer.The pH between 8.0~9.0 was better for polymerization.The appropriate temperature was 45℃,that was good for TGase playing a role in polymerzation.Emulsification of native was 30.27%and stability was 37.78%,after modification the emulsification was 61.15%and stability was 79.28%.
soybean 11S globulins;transglutaminase;modification;emulsification and stability
TS201.2
A
1002-0306(2014)08-0180-05
10.13386/j.issn1002-0306.2014.08.032
2013-07-22
刘颖(1968-),女,博士,教授,研究方向:食品生物技术。
国家高科技研究发展计划(863计划)(2006AA10Z329)。

