丙酮酸钠在深低温停循环顺行选择性脑灌注中的脑保护作用
王 甜,吴树彬,邹丽华,刘晋萍,吉冰洋,唐 跃,吴爱丽
·基础研究·
丙酮酸钠在深低温停循环顺行选择性脑灌注中的脑保护作用
王 甜,吴树彬,邹丽华,刘晋萍,吉冰洋,唐 跃,吴爱丽
目的 探索在深低温停循环(DHCA)期间,顺行选择性脑灌注(ASCP)含丙酮酸钠(Pyr)的血液能否有效缓解氧化应激从而发挥脑保护作用。方法 随机选取45只新西兰兔,18只作为供血兔,27只用于建立模型并随机分为:假手术(Sham)组(n=9)、ASCP组(n=9)和Pyr组(n=9)。Sham组麻醉后开胸,建立体外循环但不转机;Pyr组在DHCA中ASCP含Pyr溶液(154 mmol/L)与血液的混合液;ASCP组则为氯化钠溶液(154 mmol/L)与血液混合液。在麻醉后(T1)、降温至28℃(T2)、开放升主动脉后10 min(T3)、停机后10 min(T4)及停机后120 min(T5)五个时点采集血流动力学指标、检测动脉血气和采集颈静脉球部血液。停机后安乐死动物并进行脑组织取材。检测样本中丙二醛(MDA)含量、超氧化物歧化酶(SOD)活性及S100B蛋白含量。结果 ASCP组MDA含量高于Sham组和Pyr组(P<0.05)。ASCP组SOD活性低于Sham组和Pyr组(P<0.05),与Pyr组在T3、T4和T5三个时点血浆S100B蛋白较组内T1时点高(P<0.05),ASCP组T3、T4和T5时点血浆S100B蛋白浓度显著高于同时点的Sham组和Pyr组(P<0.05)。结论 DHCA期间ASCP含外源性Pyr的血液可通过缓解氧化应激发挥较为完善的脑保护作用。
深低温停循环;顺行选择性脑灌注;动物模型;丙酮酸钠
中枢神经功能障碍是实施深低温停循环(deep hypothermic circulatory arrest,DHCA)手术后的严重并发症之一,而顺行性选择性脑灌注(antegrade se⁃lective cerebral perfusion,ASCP)技术近年来被视为主动脉弓类疾患术中实施DHCA较为安全的脑保护措施[1]。但本课题组前期研究发现ASCP技术依然存在脑缺血并通过氧化应激等机制损伤中枢神经系统[2]。丙酮酸钠(Pyruvate,Pyr)是最常见的丙酮酸盐,可作为机体内源性非酶促抗氧化屏障的重要成员在众多临床研究中发挥其脏器保护作用。因此,本研究拟探索在DHCA期间ASCP含Pyr的血液观察其能否缓解氧化应激程度,从而发挥脑保护作用。
1 材料与方法
1.1 实验动物 由阜外心血管病医院动物实验中心统一提供购买。15~20周龄新西兰兔45只,2.5~3.5 kg,雌雄不限;其中27只动物为实验组,另外18只作为供血动物。术前6 h禁食,2 h禁水。
1.2 实验耗材
1.2.1 主要仪器 小动物呼吸机(巴西Intermed公司,Class 1-Type B),双头滚压泵(德国Stockert公司),阜外婴儿D型管道(天津塑料研究所),膜肺(Terumo Capiox RW05 Baby-RX),变温水箱(德国Jostra公司,型号:20-600),紫外/可见光分光光度计(Beckman Coulter,美国)等。
1.2.2 主要试剂 Pyr(25 mg,Sigma,Germany),兔S100B ELISA试剂盒(RapidBio Lab,USA),兔MDA ELISA试剂盒(Abnova,USA),兔SOD ELISA试剂盒(Abcam,England)等。
1.3 建立改良下半身停循环联合选择性脑灌注兔模型[3]随机选取实验用新西兰兔并称重后,经耳缘静脉注射盐酸氯胺酮注射液35 mg/kg和地西泮1.5 mg/kg诱导麻醉后经口气管插管维持呼吸,给予0.5 mg维库溴铵、盐酸氯胺酮注射液10 mg/(kg·h)和地西泮1.5 mg/(kg·h)维持麻醉并进行心电、肛温、平均动脉压监测。全身肝素化(500 U/kg)后,胸部正中切口暴露心脏和升主动脉,沿主动脉游离无名动脉及左、右锁骨下动脉,右锁骨下动脉置入16 G动脉套管针供全身灌注和选择性脑灌注,中心静脉管置入左锁骨下动脉,在导丝引导下送至主动脉根部,供灌注停搏液,右心耳处14 F静脉插管供引流静脉血。当全血激活凝固时间(activated clotting time,ACT)≥480 s时开始体外循环(cardiopulmonary bypass,CPB),全流量设为120~150 ml/(kg·min),平均动脉压维持在50~60 mm Hg。于转机10 min后降温,降至28℃后灌注St.Thomas液20 ml/kg,每隔30 min时灌注停搏液半量。继续降温至20℃时将流量降至8~10 ml/(kg·min)并开始下半身停循环和ASCP。停循环1 h后恢复全身灌注并复温。复温至32℃时开放升主动脉使心脏自动复跳,继续复温至35℃时停机,并给予鱼精蛋白注射液拮抗肝素。于停机后10 min用盐酸氯胺酮注射液35 mg/kg和地西泮1.5 mg/kg安乐死动物。整个CPB过程采用α-稳态血气管理。
1.4 实验流程 将实验组随机分为假手术(Sham)组,ASCP组和Pyr组,每组9只动物,其中ASCP组和Pyr组需要献血兔供血。在DHCA开始后,Pyr组将Pyr溶液(154 mmol/L)与血液混合后行ASCP;而ASCP组则为154 mmol/L氯化钠溶液与血液的混合液。Sham组麻醉后开胸后建立CPB但不转机,在与其他两组相对应的各时点的平均值记录各项监测数据,采样行生化指标分析并取材。ASCP组和Pyr组在麻醉后(T1)、降温至28℃(T2)、开放升主动脉后10 min(T3)、停机后10 min(T4)及停机后120 min(T5)五个时点采动脉血、颈静脉球部血液和记录血流动力学指标。安乐死动物时取大脑新皮质组织。
1.5 主要监测指标
1.5.1 生理指标 T1~T5各时刻血压、心率、温度、心电图、动脉血气
1.5.2 生化指标分析 采用酶联免疫法(ELISA法)检测各时刻血浆样品中丙二醛(Malondialdehyde,MDA)、S100B蛋白含量,采用WST-1法检测脑皮质裂解液中的超氧化物岐化酶(Superoxide dismutase,SOD)活性。
1.6 统计方法 数据采用SPSS 22.0进行统计处理,计量资料以均数±标准差(±s)表示,组间比较采用单因素方差分析或非参数检验,不同时点数据采用重复测量方差分析,P<0.05为差异有统计学意义。
2 结 果
2.1 新西兰兔体重及CPB一般资料 不同组别动物体重及CPB不同时段的时长没有统计学差异(P>0.05)。见表1。
2.2 血流动力学及血气指标 ASCP组和Pyr组在T2和T3时刻的平均动脉压(MAP)值、心率(HR)值、血红蛋白(Hb)值、红细胞比容(Hct)值显著低于组内T1时刻(P<0.05),也明显低于同时刻Sham组(P<0.05)。ASCP组和Pyr组在T2和T3时刻的乳酸(Lac)值显著高于组内T1时刻(P<0.05),也明显高于同时刻Sham组(P<0.05)。pH值、动脉血氧饱和度(SaO2)在不同组别组内各时点与组间均无统计学意义(P>0.05)。见表2。
表1 动物体重及CPB各时段时长(n=9,±s)
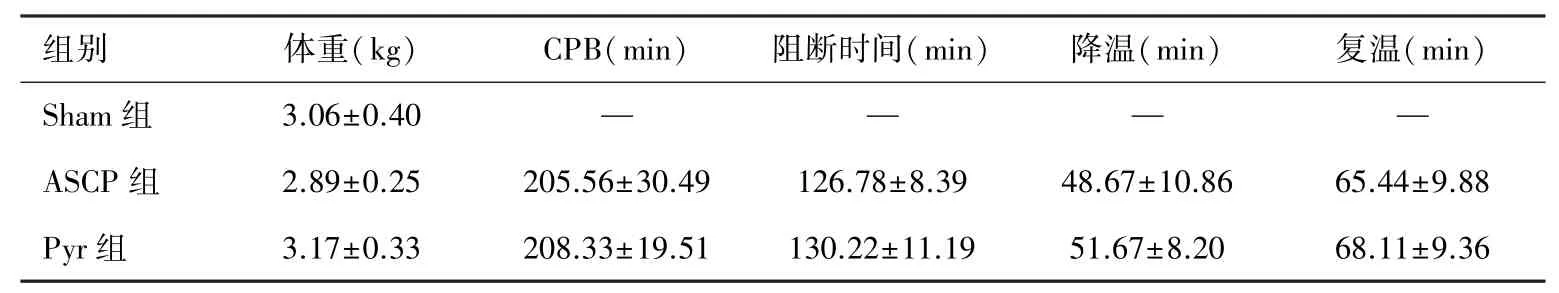
表1 动物体重及CPB各时段时长(n=9,±s)
组别 体重(kg) CPB(min) 阻断时间(min) 降温(min) 复温(min)Sham组 3.06±0.40 — — — —ASCP组 2.89±0.25 205.56±30.49 126.78±8.39 48.67±10.86 65.44±9.88 Pyr组 3.17±0.33 208.33±19.51 130.22±11.19 51.67±8.20 68.11±9.36
表2 血流动力学及血气指标(n=9,±s)
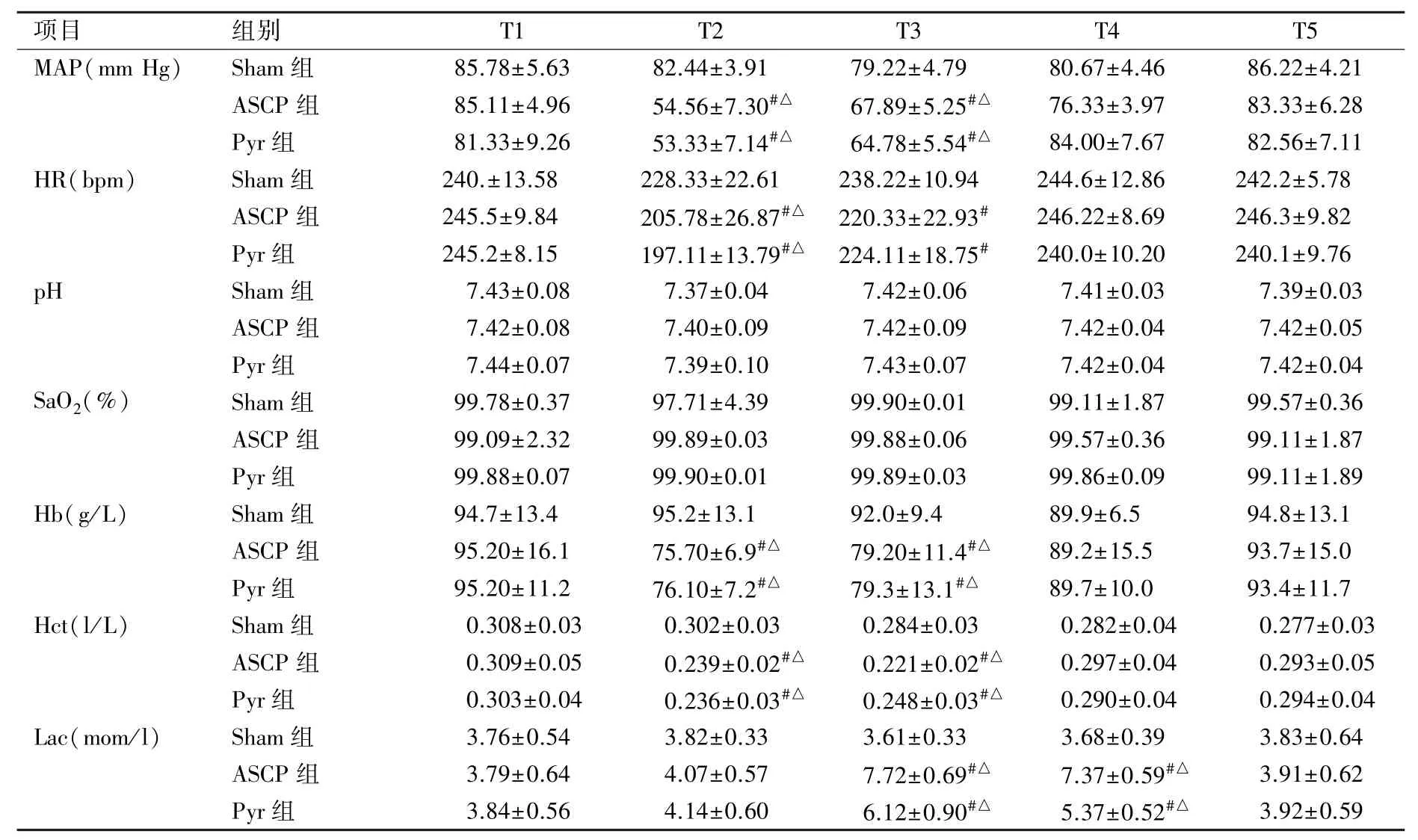
表2 血流动力学及血气指标(n=9,±s)
注:#表示组内各时点与T1相比P<0.05;△表示与Sham组相比P<0.05。
项目 组别 T1 T2 T3 T4 T5 MAP(mm Hg) Sham组 85.78±5.63 82.44±3.91 79.22±4.79 80.67±4.46 86.22±4.21 ASCP组 85.11±4.96 54.56±7.30#△67.89±5.25#△76.33±3.97 83.33±6.28 Pyr组 81.33±9.26 53.33±7.14#△64.78±5.54#△84.00±7.67 82.56±7.11 HR(bpm) Sham组 240.±13.58 228.33±22.61 238.22±10.94 244.6±12.86 242.2±5.78 ASCP组 245.5±9.84 205.78±26.87#△220.33±22.93#246.22±8.69 246.3±9.82 Pyr组 245.2±8.15 197.11±13.79#△224.11±18.75#240.0±10.20 240.1±9.76 pH Sham组 7.43±0.08 7.37±0.04 7.42±0.06 7.41±0.03 7.39±0.03 ASCP组 7.42±0.08 7.40±0.09 7.42±0.09 7.42±0.04 7.42±0.05 Pyr组 7.44±0.07 7.39±0.10 7.43±0.07 7.42±0.04 7.42±0.04 SaO2(%) Sham组 99.78±0.37 97.71±4.39 99.90±0.01 99.11±1.87 99.57±0.36 ASCP组 99.09±2.32 99.89±0.03 99.88±0.06 99.57±0.36 99.11±1.87 Pyr组 99.88±0.07 99.90±0.01 99.89±0.03 99.86±0.09 99.11±1.89 Hb(g/L) Sham组 94.7±13.4 95.2±13.1 92.0±9.4 89.9±6.5 94.8±13.1 ASCP组 95.20±16.1 75.70±6.9#△79.20±11.4#△89.2±15.5 93.7±15.0 Pyr组 95.20±11.2 76.10±7.2#△79.3±13.1#△89.7±10.0 93.4±11.7 Hct(l/L) Sham组 0.308±0.03 0.302±0.03 0.284±0.03 0.282±0.04 0.277±0.03 ASCP组 0.309±0.05 0.239±0.02#△0.221±0.02#△0.297±0.04 0.293±0.05 Pyr组 0.303±0.04 0.236±0.03#△0.248±0.03#△0.290±0.04 0.294±0.04 Lac(mom/l) Sham组 3.76±0.54 3.82±0.33 3.61±0.33 3.68±0.39 3.83±0.64 ASCP组 3.79±0.64 4.07±0.57 7.72±0.69#△7.37±0.59#△3.91±0.62 Pyr组 3.84±0.56 4.14±0.60 6.12±0.90#△5.37±0.52#△3.92±0.59
2.3 各组动物大脑皮质MDA含量、SOD活性ASCP组MDA含量显著高于Sham组和Pyr组(P<0.05)。ASCP组SOD活性含量低于Sham组和Pyr组(P<0.05)。见图1、图2。
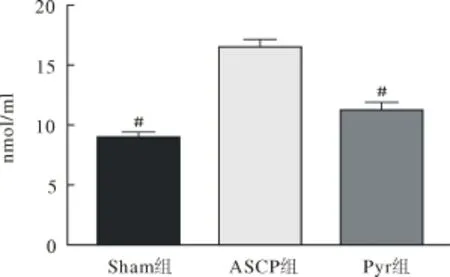
图1 脑组织MDA含量图
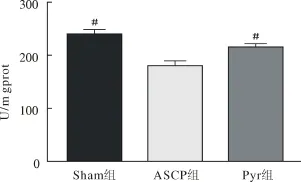
图2 脑组织SOD活性
2.4 血浆中S100B蛋白含量的变化 ASCP组与Pyr组在T3、T4和T5时血浆S100B蛋白较T1时点高(P<0.05)。在T3、T4和T5时的S100B蛋白浓度数据显示,ASCP组和Pyr组显著高于Sham组(P<0.05),ASCP组显著高于Pyr组(P<0.05)。见图3。

图3 血浆S100B蛋白含量变化
3 讨 论
本实验采用了改良下半身停循环联合ASCP兔模型[3],收集供血兔的血液作为预充,较好的维持了转流中的Hb浓度,转流过程中采取了α稳态血气管理,MAP、HR及pH值等血流动力学及血气指标的变化均符合DHCA的病理生理过程(见表2)。新西兰兔Lac基础值在4~6 mmol/L之间,停循环期间无氧代谢增加导致Lac的生成增加,低温下酶活性的降低导致其清除率降低,从而Lac持续上升,停机后微循环改善,Lac逐步清除并降为正常值,符合DHCA术中的Lac变化。本实验建立的兔模型将心肌灌注和选择性脑灌注技术结合,用于研究DHCA中的ASCP技术是否具有可行性和优越性。
ASCP被认为是DHCA期间最有效的脑保护措施之一,可以大大减少术后神经功能障碍的发生。但是,低温ASCP本身可以引起脑缺血:一方面,冷灌注会使脑血流自主调节机制紊乱,引起脑血管收缩[4],另一方面,低流量引起的星形胶质细胞水肿和脑血管痉挛等现象也可以进一步减少脑血流[5]。脑缺血可引起的氧化应激[2]可诱导机体产生氧自由基、单线态氧和H2O2等活性氧(Reactive oxygen species,ROS)。由于大脑抗氧化屏障相对较弱、脂类含量尤其是不饱和脂肪酸和儿茶酚胺含量较高[6],ROS易于通过氧化大脑中的脂质、蛋白质和核酸改变细胞功能,导致神经元损伤和神经功能障碍[7-8]。而人体的内源性抗氧化损伤机制可通过酶促和非酶促反应屏障清除ROS发挥细胞保护作用[9]。
DHCA期间,低温使过氧化氢酶和谷胱甘肽过氧化物酶(glutathion peroxidase)活性急剧降低,酶促反应屏障受到抑制,同时ROS大量产生,导致氧化还原失衡。MDA反应机体内脂质过氧化的程度,间接反应了机体细胞受自由基攻击的严重程度,即细胞损伤的程度。而本研究数据显示,Pyr的抗氧化效应能够有效降低氧化应激程度,减少MDA的产生(见图1)。血液中S100B蛋白增高是中枢神经系统损伤特异和灵敏的生化标志,神经系统损伤后释放入血,本研究中Pyr可以有效降低S100B蛋白浓度(见图3),反映其脑保护效应。
Pyr是三羧酸(Tricarboxylic acid,TCA)循环的底物,可以补充DHCA期间的能量物质,具有一定的抗氧化特性[10],它能以多种方式缓解氧化应激[11-12],是机体内源性抗氧化屏障的重要成员之一。首先,因具有α-酮基,Pyr可不经酶催化直接进行氧化脱羧与ROS反应,发挥非酶促反应屏障的效应。其次,Pyr能提高胞内谷胱甘肽(glutathione,GSH)水平和多种组织的 GSH/GSSG(氧化型谷胱甘肽)比率[12-13],增强酶促反应屏障中的谷胱甘肽过氧化物酶[14]和SOD的活性(见图2)。此外,Pyr可以降低NADH(烟酸胺腺嘌呤二核苷酸还原型辅酶)氧化还原酶系统中NADH含量[11],增加大脑NAD+(烟酸胺腺嘌呤二核苷酸)/NADH的比率,改善氧化还原状态[13,15],减少超氧自由基的产生。同时有学者发现,Pyr能抵抗内源和外源性H2O2的氧化应激毒性,保护离体大鼠纹状体神经元免受损伤[2],并可抑制H2O2介导的人内皮细胞[16]和成神经细胞瘤细胞凋亡[17]。
研究表明,当血浆Pyr浓度为5 mmol/L时,可以有效缓解海马区缺血性损伤[18]。本研究给予剂量可使Pyr的血浆浓度达到15 mmol/L,因此可经易化扩散和简单扩散通过血脑屏障[19],快速发挥其脑保护效应。然而,α-丁酮酸与Pyr一样,可直接与ROS反应,也可经单羧酸转运体或单纯扩散穿过血脑屏障[20],但对神经元存活没有影响。二者的显著区别在于Pyr是糖酵解过程的终产物,可以直接进入TCA循环代谢,产生ATP。在体外研究中,用Pyr孵育糖氧剥夺的神经元可提高神经元糖原的含量[21]。Pyr促进糖原合成的机制可能在于它可以直接进入TCA循环,增加柠檬酸盐含量水平[22]。这些研究提示,Pyr除抗氧化应激作用外,还可通过能量代谢机制发挥脑保护效应。
本研究局限有以下几方面:首先,MDA和SOD不能代表全部氧化还原状态,更多的氧化应激指标应纳入进一步研究中。其次,大脑不同区域对缺血缺氧损伤耐受力不同[10-13],本研究选取了大脑新皮质作为研究对象,不能反映大脑总体损伤。最后,抗
氧化效应不是Pyr脑保护作用的单一机制,建议未来的研究探索Pyr在能量代谢等更多方面的作用机制。
综上所述,本研究结果表明,相较于单纯血液ASCP,DHCA期间ASCP含Pyr的血液可以有效缓解氧化应激,从而减轻神经元损伤,发挥特异性脑保护作用。
[1] Sakurada T,Kazui T,Tanaka H,et al.Comparative experimental study of cerebral protection during aortic arch reconstruction[J].Ann Thorac Surg,1996,61(5):1348-1354.
[2] Love S.Oxidative stress in brain ischemia[J].Brain Pathol,1999,9(1):119-131.
[3] 吴树彬,邹丽华,刘晋萍等。改良下半身停循环联合选择性脑灌注兔模型的建立[J].中国体外循环杂志,2014,12(1):46-49.
[4] Watanabe T,Oshikiri N,Inui K,et al.Optimal blood flow for cooled brain at 20 degrees C[J].Ann Thorac Surg,1999,68(3):864-869.
[5] Swanson RA,Ying W,Kauppinen TM.Astrocyte influences on is⁃chemic neuronal death[J].Curr Mol Med,2004,4(2):193-205.
[6] Sirtori LR,Dutra-Filho CS,Fitarelli D,et al.Oxidative stress in patients with phenylketonuria[J].Biochim Biophys Acta,2005,1740(1):68-73.
[7] Floyd RA,Carney JM.Free radical damage to protein and DNA:mechanisms involved and relevant observations on brain undergoing oxidative stress[J].Ann Neurol,1992,32 Suppl:S22-27.
[8] Lewen A,Matz P,Chan PH.Free radical pathways in CNS injury[J].J Neurotrauma,2000,17(10):871-890.
[9] Desagher S,Glowinski J,Prémont J.Pyruvate protects neurons a⁃gainst hydrogen peroxide-induced toxicity[J].J Neurosci,1997,17(23):9060-9067.
[10] Andrae U,Singh J,Ziegler-Skylakakis K.Pyruvate and related alpha-ketoacids protect mammalian cells in culture against hydro⁃gen peroxide-induced cytotoxicity[J].Toxicol Lett,1985,28(2-3):93-98.
[11] Bassenge E,Sommer O,Schwemmer M,et al.Antioxidant pyru⁃ vate inhibits cardiac formation of reactive oxygen species through changes in redox state[J].Am J Physiol Heart Circ Physiol,2000,279(5):H2431-2438.
[12] Mallet RT.Pyruvate:metabolic protector of cardiac performance[J].Proc Soc Exp Biol Med,2000,223(2):136-148.
[13] Mongan PD,Capacchione J,West S,et al.Pyruvate improves redox status and decreases indicators of hepatic apoptosis during hemorrhagic shock in swine[J].Am J Physiol Heart Circ Physiol,2002,283(4):H1634-1644.
[14] Simonian NA,Coyle JT.Oxidative stress in neurodegenerative dis⁃eases[J].Annu Rev Pharmacol Toxicol,1996,36:83-106.
[15] Mongan PD,Capacchione J,Fontana JL,et al.Pyruvate im⁃proves cerebral metabolism during hemorrhagic shock[J].Am J Physiol Heart Circ Physiol,2001,281(2):H854-864.
[16] Lee YJ,Kang IJ,Bünger R,et al.Mechanisms of pyruvate inhi⁃bition of oxidant-induced apoptosis in human endothelial cells[J].Microvasc Res,2003,66(2):91-101.
[17] Jagtap JC,Chandele A,Chopde BA,et al.Sodium pyruvate pro⁃tects against H(2)O(2)mediated apoptosis in human neuroblas⁃toma cell line-SK-N-MC[J].J Chem Neuroanat,2003,26(2):109-118.
[18] Lee YJ,Kang IJ,Bünger R,et al.Mechanisms of pyruvate inhi⁃bition of oxidant-induced apoptosis in human endothelial cells[J].Microvasc Res,2003,66(2):91-101.
[19] Conn AR,Steele RD.Transport of alpha-keto analogues of amino acids across blood-brain barrier in rats[J].Am J Physiol,1982,243(4):E272-277.
[20] Oldendorf WH.Carrier-mediated blood-brain barrier transport of short-chain monocarboxylic organic acids[J].Am J Physiol,1973,224(6):1450-1453.
[21] Cruz NF,Dienel GA.High glycogen levels in brains of rats with minimal environmental stimuli:implications for metabolic contri⁃butions of working astrocytes[J].J Cereb Blood Flow Metab,2002,22(12):1476-1489.
[22] Shetty PK,Sadgrove MP,Galeffi F,et al.Pyruvate incubation enhances glycogen stores and sustains neuronal function during subsequent glucose deprivation[J].Neurobiol Dis,2012,45(1):177-187.
Brain protective effect of antegrade selective cerebral perfusion with sodium pyruvate in deep hypothermic circulatory arrest
Wang Tian,Wu Shu-bin,Zou Li-hua,Liu Jin-ping,Ji Bing-yang,Tang Yue,Wu Ai-li
Department of Cardiopulmonary Bypass,Fuwai Hospital,Peking Union Medical College and Chinese Academy of Medical Sciences,Beijing 100037,China
Objective To explore whether a combination of sodium pyruvate(Pyr)and blood for antegrade selective cerebral perfusion(ASCP)during deep hypothermic circulatory arrest(DHCA)could attenuate oxidative stress and exert a better protective effect on the brain.Methods Fourty-five rabbits were selected randomly.Eighteen were used for blood donation,other rabbits used for model establishment and which were divided into:Sham group(n=9),ASCP group(n=9)and Pyr group(n=9).The Sham group underwent anesthesia and thoracotomy,set up cardiopulmonary bypass(CPB)but no on pump.During DHCA,ASCP was per⁃formed with a combination of 154 mmol/L isotonic solution of sodium pyruvate and blood for Pyr group but a combination of 154 mmol/L Nacl solution and blood for ASCP group.Blood gas and hemodynamic parameters were measured in five time points during CPB.The rabbits ended with euthanasia after CPB,and their brain tissue were preserved.All samples were used to measure malondialdehyde(MDA)content,superoxide dismutase(SOD)activity and S100B content.Results he MDA content of ASCP group was higher than Sham group and Pyr group(P<0.05).The SOD activity of ASCP group was lower than Sham group and Pyr group(P<0.05).The S100B concentrations of ASCP group and Pyr group at T3,T4 and T5 points were higher than T1 point in the same groups(P<0.05).The S100B concentrations of ASCP group at T3,T4 and T5 points were higher than Sham group and Pyr group at the same points(P<0.05).Conclusion The combination of blood and sodium pyruvate for ASCP during DHCA could exert a better protective effect on the brain by attenuating oxidative stress.
Deep hypothermic circulatory arrest;Antegrade selective cerebral perfusion;Animal model;Sodium pyruvate
国家自然科学基金(81100178)
100037北京,北京协和医学院,中国医学科学院,阜外心血管病医院体外循环科(王 甜、吴树彬、邹丽华、刘晋萍、吉冰洋),动物实验中心(唐 跃、吴爱丽)
刘晋萍,Email:jinpingfw@ Hotmail.com
2014⁃11⁃13)
2014⁃11⁃14)
10.13498/j.cnki.chin.j.ecc.2014.04.14

