水稻白叶枯病菌hrf2基因表达的His-HarpinXooc蛋白的纯化及分析
湛 江,张书萍,谭彩霞,伍辉军,高学文*
(1.金陵科技学院学报编辑部,江苏 南京 211169; 2.南京农业大学植物保护学院,江苏 南京 210095)
Harpin是一类由革兰氏阴性植物病原细菌产生的富含甘氨酸、对热稳定、对蛋白酶K敏感,能在非寄主植物上引起过敏反应的蛋白,同时能够诱导植物产生许多有益性状,包括病虫抗性、增加产量和提高品质等[1-5]。HarpinXooc是由水稻白叶枯病菌(Xanthomonasoryzaepv.oryzicola)hrf2基因编码产生的蛋白质,亲水,对热稳定,等电点约为4.5,含138个氨基酸,分子量约为15.3×103Da[6-7]。
HarpinXooc蛋白的纯化对于其结构和生物活性的研究至关重要。目前,融合标签技术已大量用于重组蛋白质纯化,常用的蛋白纯化标签是GST、His和表位标签。其中,His标签具有对金属离子有高度的选择性和亲和力、与金属离子的结合不受变性剂(尿素、肌)的影响、温和多样的洗脱条件等优点,但同时也受到很多因素制约,如融合标签系统的纯化条件、融合蛋白质自身的性质、缓冲液及融合标签的可去除性等[8]。据此,本研究对His-HarpinXooc的纯化条件和标签去除等进行了优化和摸索。同时,为了更加深入地了解和运用His-HarpinXooc蛋白,本研究分析了该融合蛋白的产量、等电点和生物活性等。
1 材料与方法
1.1 试验材料
载体pET30a(+)-hrf2:携带水稻白叶枯菌编码Harpin的hrf2基因,具卡那霉素(Km)抗性(50 μg/mL),由南京农业大学农作物生物灾害综合治理实验室(下简称“实验室”)构建;工程菌BL21/pET30a(+)-hrf2:用作表达HarpinXooc蛋白,具卡那霉素抗性(50 μg/mL),实验室保存;工程菌BL21/pET30a(+):用作空白对照,具卡那霉素抗性(50 μg/mL),实验室保存。
1.2 药品和试剂
1) Enterokinase(EK)蛋白酶:购自南京金斯瑞科技有限公司,2 U/μL;
2) 蛋白纯化所用的试剂盒(HisTrap HP Kit):购自Amersham Biosciences (USA)公司;
3) 2 M 咪唑:取咪唑13.62 g,加纯水90 mL完全溶解,浓HCl调pH=7.4,加纯水定容到100 mL。
1.3 项目测定与方法
1.3.1 His-HarpinXooc蛋白的表达和SDS-PAGE分析 将BL21/pET30a(+)-hrf2在含有Km(50 μg/mL)的LB固体培养基平板上活化,转接培养至OD600值达0.5左右,加入终浓度为1 mM的IPTG诱导培养4 h,收集菌体,灭菌水漂洗1次,使用20 mM或80 mM的咪唑悬浮菌体,加入终浓度为0.1 mM的蛋白酶抑制剂PMSF。超声波破碎后收集上清,作为蛋白粗提液。取样品液20 μL,与1/4体积的5×SDS加样缓冲液混合,100 ℃沸水浴7 min,冷却后电泳。
1.3.2 HarpinXooc蛋白的纯化 纯化之前,按照HisTrap HP Kit说明书制备蛋白样品,然后用0.45 μm滤膜过滤,去除一些细胞碎片或其它杂质,以免阻塞镍柱,纯化时使用注射器上样。
1.3.3 BSA内标法测定蛋白浓度 将BSA分别稀释成100、250和500 μg/mL蛋白标准样品,与蛋白样本同时进行SDS-PAGE电泳,经凝胶成像系统BioImage软件分析His-HarpinXooc蛋白的浓度。
1.3.4 Bradford法测定蛋白浓度 将BSA分别稀释成100、200、400、600、800 μg/mL蛋白标准样品,在595 nm 下测定的吸光度值A595,数值与蛋白质浓度成正比。通过标准曲线测定蛋白浓度。
1.3.5 蛋白的透析 将His-HarpinXooc蛋白注入处理过的透析袋后,将透析袋置于装有透析缓冲液的烧杯中,置于4 ℃透析24 h,每隔4~6 h更换一次透析液。
1.3.6 蛋白的酶切和浓缩 纯His-HarpinXooc蛋白溶于酶切缓冲液中,约按照50 μg蛋白/U的比例加入Enterokinase,酶切条件为22 ℃ 16 h。将蛋白溶液置于MILLIPORE浓缩柱内,5 000 rpm离心15 min,最终将蛋白溶液浓缩约10倍。
1.3.7 蛋白等电点的测定 在试管中配制不同pH的乙酸-乙酸钠或磷酸缓冲液,加入经透析脱盐的His-HarpinXooc蛋白溶液(终浓度约为100 μg/mL),轻微振荡,测量pH值后静置10 min,观察现象。
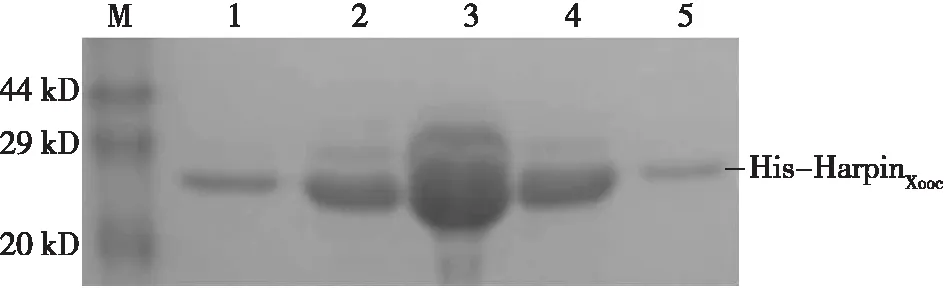
图1 浓度递增的咪唑溶液洗脱His-HarpinXoocFig.1 Purification of His-HarpinXooc using imidazole of different concentration注:M代表蛋白marker;1代表第1~5 mL流出液 (150 mM 咪唑);2代表第6~10 mL 流出液(200 mM咪唑);3代表第11~15 mL流出液(250 mM咪唑);4代表第16~20 mL流出液 (300 mM咪唑);5代表第21~25 mL 流出液(500 mM咪唑)
1.3.8 烟草过敏反应 分别用灭菌水和空白对照、蛋白溶液注射烟草Xanthi叶片,光照培养箱中培养24 h后(16 h光照,8 h黑暗,25 ℃),观察叶片是否出现过敏反应。
2 结果与分析
2.1 使用HisTrap纯化HarpinXooc蛋白的条件优化
在已结合His-HarpinXooc粗提液的镍柱中依次注入20、40、60、80和100 mM咪唑各5 mL洗脱非特异性蛋白,按照以下不同的洗脱方案对His-HarpinXooc蛋白进行纯化,通过SDS-PAGE电泳图观测蛋白纯度,优化纯化条件。
2.1.1 洗脱液中咪唑浓度对蛋白纯化的影响 如图1所示,采用150 mM咪唑洗脱后得到的HarpinXooc融合蛋白纯度高,电泳条带无杂带,而当咪唑浓度逐渐升高至250 mM时,会将一些结合力较强的杂蛋白洗脱出来,继续使用更高浓度咪唑(300~500 mM)进行洗脱时,杂带逐渐被去尽,流出液又恢复为高纯度的His-HarpinXooc蛋白。因而,针对与镍柱结合的蛋白粗提液,在20~100 mM咪唑洗脱之后,采用150 mM咪唑溶液多次洗脱,更能获得高纯度的His-HarpinXooc蛋白(图2)。

图2 150 mM咪唑溶液洗脱His-HarpinXoocFig.2 Purification of His-HarpinXooc using 150 mM imidazole注:A代表使用20 mM咪唑溶液悬浮菌体;B代表使用80 mM咪唑溶液悬浮菌体;M代表蛋白marker;1代表第1~5 mL 流出液;2代表第6~10 mL流出液;3代表第11~15 mL流出液;4代表第16~20 mL流出液;5代表第21~25 mL流出液。
2.1.2 蛋白粗提液中咪唑浓度对蛋白纯化的影响 较低浓度的咪唑可置换非特异性结合的蛋白,因而,在蛋白粗提液中含有一定浓度的咪唑时,有利于粗提液在过镍柱时,阻止非特异性蛋白与镍柱结合。本试验分别采用20 mM和80 mM的咪唑作为细胞破碎悬浮液,即在蛋白粗提液中咪唑的浓度分别为20 mM和80 mM。结果显示,在采用同样的洗脱溶液的情况下,采用20 mM咪唑作为细胞破碎悬浮液(图2A)与采用80 mM咪唑(图2B)时纯化的结果大致相同,纯化所得条带都无杂带。
2.1.3 洗脱缓冲液对蛋白纯化的影响 为了弄清溶解咪唑的缓冲液对蛋白结合作用力的影响,我们分别观测PBS-咪唑缓冲液和Tris-咪唑缓冲液对蛋白纯化的影响。结果显示,PBS-咪唑缓冲液(图3A)和Tris-咪唑缓冲液(图3B)对蛋白纯化影响的区别不大。同时,在咪唑浓度为150 mM时洗脱得到的HarpinXooc融合蛋白纯度高,当咪唑浓度逐渐升高至500 mM时,也会将一些结合力较强的杂蛋白洗脱出来,与2.1.1结果一致。

图3 不同的缓冲液洗脱His-HarpinXoocFig.3 Purification of His-HarpinXooc using different elution buffer注:A代表PBS-咪唑;B代表Tris-咪唑第一次;C代表Tris-咪唑第二次;M代表蛋白marker;1代表第1~5 mL流出液(150 mM);2代表第6 mL 流出液(500 mM);3代表第7 mL流出液(500 mM);4代表第8 mL流出液(500 mM);5代表第9 mL流出液(500 mM)
2.1.4 纯化次数对蛋白纯化的影响 为了获得纯度更高的蛋白,我们将第一次纯化所得的His-HarpinXooc蛋白溶液按一定比例稀释后再次注入到镍柱中,然后使用同样浓度的咪唑进行洗脱,观察经两次纯化后的蛋白纯度。图3B是HarpinXooc融合蛋白经过一次纯化后的电泳图,图3C是蛋白在经过两次纯化后的电泳图。结果显示,HarpinXooc融合蛋白经过两次纯化后杂带略微变少,但变化不明显。

图4 利用BSA内标法测定His-HarpinXooc蛋白浓度Fig.4 Analyzing the concentration of His-HarpinXooc with BSA internal standard method注:M代表蛋白marker;1代表His-HarpinXooc蛋白粗提液;2代表BSA(500 μg/mL);3代表BSA(250 μg/mL);4代表BSA(100 μg/mL);5表示纯His-HarpinXooc蛋白
2.2 His-HarpinXooc融合蛋白的产量、等电点及生物活性分析
2.2.1 His-HarpinXooc融合蛋白的产量 我们按照最佳纯化方案进行纯化,并将所得纯蛋白和蛋白粗提液进行SDS-PAGE电泳。结果表明,以牛血清蛋白(BSA)为标准,蛋白粗提液中His-HarpinXooc蛋白的量与纯化后His-HarpinXooc蛋白的量差别不是很大,经凝胶成像系统BioImage软件测定,蛋白样品中His-HarpinXooc蛋白的浓度约为1.0 mg/mL (图4)。经过换算,每升BL21/pET30a(+)-hrf2发酵液经IPTG诱导和镍柱纯化,可提纯His-HarpinXooc蛋白约20 mg。同时,我们用Bradford法对纯化的His-HarpinXooc蛋白的浓度进行了测定,结果与BioImage软件测定的结果一致。
表1His-HarpinXooc蛋白的等电点测定
Table1ThepIdeterminingofHis-HarpinXooc

pH值His-HarpinXooc溶液的现象 3.7- 3.9+4.1++4.3+++4.5+++4.7++++4.9++5.2++5.4+5.6+5.9+6.1+6.3-
注:“++++、+++、++、+”分别表示浑浊程度,
“-”表示澄清。
2.2.2 His-HarpinXooc蛋白等电点测定 本试验通过聚沉法测定His-HarpinXooc蛋白的等电点。在等电点时蛋白质溶解度最小,溶液的混浊度最大,通过配制不同pH的缓冲液,观察蛋白质在这些缓冲液中的溶解情况可判断蛋白质的等电点,最混浊的一管溶液的pH值即可推测为该蛋白的等电点。表1显示,通过测定,当pH<3.7或>6.3时,His-HarpinXooc蛋白溶液澄清,表示His-HarpinXooc蛋白完全可溶。在pH为4.7时His-HarpinXooc蛋白的溶液最浑浊,溶解度最小,据此可判断,His-HarpinXooc蛋白的等电点约为4.7,且His-HarpinXooc蛋白在pH大于4.7时带负电。
2.2.3 His-HarpinXooc蛋白的生物活性 为了检测His-HarpinXooc蛋白的生物活性,本试验使用不同溶液注射烟草 (N.tabacum, Xanthi) 叶片后,产生反应不同 (图5)。水、BL21细胞超声破碎上清液及BL21/pET30细胞超声破碎上清液均不能引起过敏反应,而热处理(100 ℃水浴10 min)前、后的BL21/pET30-hrf2细胞破碎上清液均能够在烟草叶片上引起典型的过敏反应,即热处理前、后的His-HarpinXooc均能引起过敏反应。考虑到Harpin蛋白的两大基本特性,热稳定性和在非寄主植物上诱导产生过敏反应,我们认为,HarpinXooc蛋白与His标签融合并不影响其热稳定性和在非寄主植物上诱导产生过敏反应的能力。
2.2.4 His-HarpinXooc蛋白的酶切分析 BL21/pET30-hrf2诱导表达后的细胞破碎上清液,经过HisTrap HP Kit层析柱并用咪唑洗脱,纯化得到约25 kD大小的His-HarpinXooc蛋白。经过Enterokinase (EK) 酶的酶切,切下His标签,这样就分别得到了His和HarpinXooc蛋白,再经过镍柱,得到去除标签的纯HarpinXooc蛋白。如图6所示,酶切后的HarpinXooc蛋白的大小近17 kD,符合HarpinXooc蛋白的理论大小。纯HarpinXooc蛋白可用于研究蛋白结构等。为了更好地保持蛋白的活性,我们通过MILLIPORE浓缩柱将纯HarpinXooc蛋白浓缩约10倍,使蛋白浓度升高,有利于蛋白的保存。
3 结论与讨论
本试验使用构建的BL21/pET30a(+)-hrf2菌株,通过IPTG诱导表达HarpinXooc,经过HisTrap HP Kit层析柱并用咪唑洗脱,纯化得到His-HarpinXooc蛋白,并分析所得蛋白的产量、等电点和生物活性。结果表明,His-HarpinXooc蛋白的热稳定性高,能够诱导烟草的过敏反应,与纯HarpinXooc和带GST标签的HarpinXooc融合蛋白类似。在用最佳纯化方案进行纯化时,每升发酵液收获纯His-HarpinXooc蛋白20 mg,经SDS-PAGE电泳显示无杂带。李明等曾用GST基因融合表达系统对HarpinXooc进行纯化,产量约为6 mg/L[9],本试验表达纯化所得的HarpinXooc产量较高,为20 mg/L。His-HarpinXooc蛋白的等电点为4.7,与不带有His标签的HarpinXooc蛋白的等电点4.5[6]接近。

图5 His-HarpinXooc诱导过敏反应的能力Fig.5 Hypersensitive response induced with His-HarpinXooc 注:1代表水;2代表BL21细胞破碎上清液;3代表BL21/pET30细胞破碎上清液;4代表BL21/pET30-hrf2细胞破碎上清液(热处理前);5代表BL21/pET30-hrf2细胞破碎上清液(热处理后)

图6 Enterokinase酶切His-HarpinXooc的分析Fig.6 The analysis of His-HarpinXooc digested with Enterokinase注:M代表蛋白marker;1代表酶切前的His-HarpinXooc蛋白;2代表酶切后的His-HarpinXooc蛋白;3代表经酶切后过镍柱所得的纯HarpinXooc蛋白;4代表将纯HarpinXooc蛋白浓缩10倍
对His标签的HarpinXooc融合蛋白的纯化条件进行了研究,结果表明,在使用咪唑洗脱的过程中,咪唑浓度对蛋白纯化影响较大,而悬浮液中咪唑浓度、缓冲液类型和纯化次数对蛋白纯化影响较小。研究认为,综合考虑HarpinXooc蛋白的纯度、产量以及纯化时节约成本、简化步骤,His-HarpinXooc蛋白的最佳纯化方案为:使用20 mM咪唑悬浮菌体,依次使用5 mL的20 mM、40 mM、60 mM、80 mM、100 mMPBS-咪唑缓冲液进行洗脱(主要目的是洗脱掉杂蛋白),然后用150 mM咪唑进行洗脱(主要目的是洗脱出His-HarpinXooc蛋白)并收集洗脱液,至洗脱液中蛋白含量明显减少。研究表明,利用HisTrap HP Kit对His-HarpinXooc进行纯化,方法简便,纯度高,产量和生物活性均不受影响,等电点与不带His标签的HarpinXooc接近。
本试验旨在对His-HarpinXooc融合蛋白的产量、等电点和生物活性进行一些初步的研究,以在后续的试验中,为制备载HarpinXooc蛋白的纳米粒提供基础[10-11],有利于更好地研究HarpinXooc蛋白的结构以及提供较好的材料。对于His-HarpinXooc蛋白结构上的一些具体性质,本试验未作探讨,有待进一步研究。
[1] Wei Z M, Laby R J, Zumoff C H, et al. Harpin, Elicitor of the Hypersensitive Response Produced by the Plant PathogenErwiniaamylovora[J].Science,1992,257:85-88
[2] Dong H, Delaney T P, Beer S V. Harpin Induces Disease Resistance in Arabidopsis through the Systemic Acquired Resistance Pathway Mediated by Salicylic Acid and the NIM1Gene[J]. Plant J.,1999,20:207-215
[3] Bauer D W, Wei Z M, Beer S V, et al.ErwiniachrysanthemiHarpinEch:an Elicitor of the Hypersensitive Response that Contributes to Soft-rot Pathogenesis[J].Mol. Plant Microbe Interact,1995,8(4):484-491
[4] Qiu D, Wei Z M, Bauer D W, et al. Treatment of Tomato Seed with Harpin Enhances Germination and Growth and Induces Resistance toRalstoniasolanacearum[J].Phytopatholgy,1997,87:1-10
[5] Zitter T A, Beer S V. Harpin for Insect Control [J].Phytopathology,1998,88:104-105
[6] 陆徐忠, 王金生.新型水稻黄单胞菌Harpin蛋白的纯化及其特性研究[J].高等学校化学学报,2006,27(5):875-879
[7] Li P, Lu X, Shao M, et al.Genetic Diversity of Harpins fromXanthomonasoryzaeand their Activity to Induce Hypersensitive Response and Disease Resistance in Tobacco[J].Science in China Ser. C Life Sciences,2004,47(5):461-469
[8] 李淑娟.六聚组氨酸融合蛋白纯化方法研究[D].陕西:西北大学,2007
[9] 李明.HarpinX蛋白的纯化、抗体制备及转hrfX基因棉花的研究[D].南京:南京农业大学,2005
[10] 湛江,杨扬,宁辉,等.载HarpinXooc蛋白纳米粒的制备及生物学效应测定[J].南京农业大学学报,2010(3):57-61
[11] Zhan J, Wu H J, Yang Y, et al.Preparation and Characterization of Chitosan-HarpinXoocNanoparticles[J].Asian Journal of Chemistry,2013(18):10368-10372
——以渤海S油田为例

