siRNA沉默HBx基因对HepG2.2.15细胞迁移能力的影响
范 芳,庄 海,李长福
(遵义医学院生化教研室,贵州遵义563099)
乙肝病毒(HBV)感染是肝癌的主要致病因素,HBx 在肝癌的发生发展、转移浸润过程中起着很重要的作用[1]。本研究应用RNAi 技术沉默HBx 基因表达,在体外观察HBx 基因对HepG2.2.15 细胞迁移能力及DNA 合成的影响。
1 材料与方法
1.1 细胞系和材料:肝癌细胞系HepG2.2.15(博慧斯生物技术公司);质粒空载体、pSIHBV/X(百奥迈科生物技术有限公司);Lipofectamine2000(Invitation 公司);Transwell 小室(Costar 公司);EdU 检测试剂盒(广州锐博公司)。
1.2 方法
1.2.1 实验分组及质粒转染:实验分为空白对照组、脂质体组(只加脂质体)、阴性对照组(转染阴性对照质粒)和pSIHBV/X 干扰组(转染质粒 pSIHBV/X)。转染前收集HepG2.2.15 细胞,按2 ×104个/孔接种于24 孔板中,当细胞增殖汇合达60% ~70%时,利用脂质体转染法将pSIHBV/X质粒转入细胞(操作步骤同说明书),转染后再培养24、48 和72 h。
1.2.2 Real-time PCR 检测HBx mRNA 的表达:细胞总RNA的提取按RNAiso Plus 试剂盒说明书进行,HBx 上游引物为:5'-ATCGGTACCATGGCTAGGTCG-3',下游引物为3'-GTGGA AGCGGATTAGTACTTAAGAGG-5';内参β-actin 上游引物为:5'-TGGCACCCAGCACAATGAA-3',下游引物为3'-CTAAGTC ATAGTCCGCCTAGAAGCA-5'。各组样品mRNA 表达量经Real-time PCR 仪器检测,PCR 产物作熔解曲线分析,根据Ct值通过公式2-(△△CT)进行相对定量分析,计算HBx mRNA 相对表达量。
1.2.3 Transwell 小室实验:将Transwell 小室放入每孔加500 μL杜尔贝科改良伊格尔(DMEM)培养基的24 孔板中孵育2 h,加入细胞悬液,37 ℃、5% CO2培养箱中继续培养。转染24、48 和72 h 后取出小室,放入0.1%结晶紫的染液中染色15 min,用33%的醋酸溶液漂洗,显微镜下观察并计数,每组细胞各取5 个视野,计数每个视野内穿膜的细胞数,计算平均值。
1.2.4 划痕愈合实验:转染前在24 孔板底部用标记笔划5条直线,转染12 h 后,用10 μL 无菌吸头在底部划痕,将两条直线间的细胞用细胞刮清理干净,PBS 清洗2 ~3 遍,37 ℃继续培养24、48 和72 h 后,于倒置显微镜下观察、拍照并记录两水平线间的细胞数。
1.2.5 细胞DNA 合成检测:细胞转染48 h,更换常规培养基并加入1 μL 5-乙炔基-2'脱氧尿嘧啶核苷(Edu)孵育24 h后,4% 多聚甲醛固定15 min,PBS 冲洗2 次,0.5% Triton X-100处理细胞,加500 μL 染色反应液,室温避光孵育30 min,加Hoechst 室温避光孵育30 min,PBS 冲洗3 次后封片,在共聚焦荧光显微镜下拍照。每组细胞取5 个视野,用Image Pro Plus 软件计数相同视野下EdU 标记细胞及总细胞数,计算DNA 合成率(DNA 合成率=EdU 标记细胞/总细胞数)。
2 结果
2.1 Real-time PCR 检测HBx mRNA 表达情况:转染pSIHBV/X 24、48 和72 h 后,实验组HBx mRNA 的表达较其他对照组下调(P<0.05),pSIHBV/X 组48 和72 h 与空白对照组相比HBx 的沉默效率分别为39.42%和58.97%(图1)。
2.2 Transwell 检测细胞迁移情况:转染24、48 和72 h 后实验组细胞的迁移能力较对照组显著下降(P<0.05)(图2)。
2.3 划痕实验:转染48 和72 h 后实验组细胞转移数比对照组明显减少(P<0.05)(图3)。

图1 pSIHBV/X 干扰后HepG2.2.15 细胞中HBx mRNA 的表达Fig 1 Expressions of HBx mRNA in HepG2.2.15 cells after interfered by pSIHBV/X
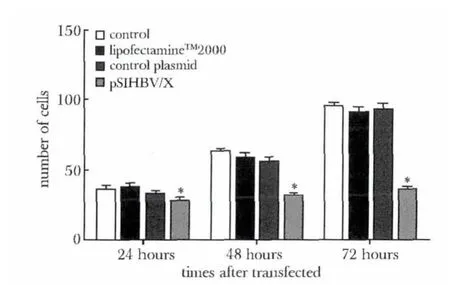
图2 pSIHBV/X 对HepG2.2.15 细胞迁移的抑制作用Fig 2 Inhibitory effect of pSIHBV/X on HepG2.2.15 cell migration

图3 转染pSIHBV/X 24、48 和72 h 后细胞转移率Fig 3 The number of invasion after transfection pSIHBV/X of 24,48 and 72 hours
2.4 EdU 法检测各组细胞DNA 合成情况:转染pSIHBV/X 48 h 后干扰组细胞DNA 合成率显著低于其他对照组(P<0.05)(图4)。
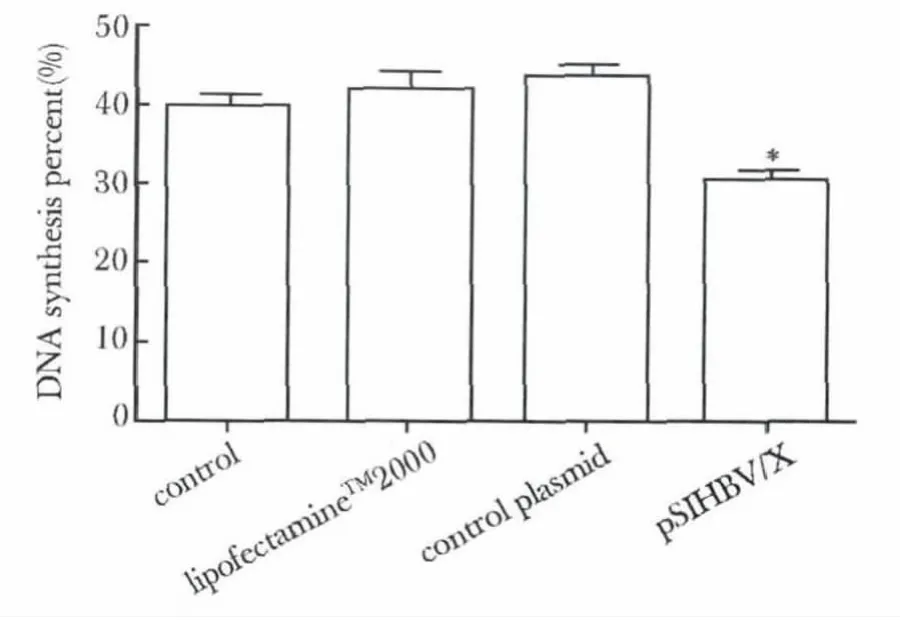
图4 转染48 h 后EdU 检测结果Fig 4 EdU results after transfection for 48 hours
3 讨论
本实验通过脂质体转染法将靶向HBx 基因的干扰质粒pSIHBV/X 转染入肝癌细胞系HepG2.2.15 内,结果显示,转染pSIHBV/X 干扰质粒后HepG2.2.15 细胞中HBx mRNA 表达水平与对照组相比明显下降,并能抑制HepG2.2.15 细胞的迁移运动能力,其机制可能与其上调VEGF 和MMP 的表达有关[2]。有研究表明HBx 可通过抑制蛋白降解途径而影响细胞周期[3]。本研究应用EdU 法检测转染pSIHBV/X 质粒后各组细胞DNA 合成情况,结果显示HBx 基因沉默后pSIHBV/X 组DNA 合成率下降,其具体机制还有待进一步深入研究。
[1]Gearhart TL,Bouchard MJ.The hepatitis B virus HBx protein modulates cell cycle regulatory proteins in cultured primary human hepatocytes[J].Virus Res,2011,155:363-367.
[2]Liu LP,Liang HF,Chen XP,et al.The role of NF-kappaB in Hepatitis b virus X protein-mediated upregulation of VEGF and MMPs[J].Cancer Invest,2010,28:443-451.
[3]Pandey V,Kumar V.HBx protein of hepatitis B virus promotes reinitiation of DNA replication by regulating expression and intracellular stability of replication licensing factor CDC6[J].J Biol Chem,2012,287:20545-20554.

