上颌矢状扩弓的四环素荧光积分光密度分析
左艳萍,苑迎娇,2,刘 昕,刘亚非,尉 静,赵利霞
(1.河北医科大学第一医院口腔正畸科,河北 石家庄 050031;2.皖南医学院附属弋矶山医院口腔医学中心,安徽 皖南 241001;3.河北医科大学研究生学院,河北 石家庄 050017)
1 材料与方法
1.1 动物分组:选择8周龄健康新西兰大白兔15只 (由河北省实验动物中心提供),体质量1.5~1.7kg。单笼喂养观察1周后,所有动物均进食颗粒状饲料,自由摄食饮水。将15只处于生长发育期的新西兰大白兔随机分为2组,实验组8只,对照组7只。实验组新西兰大白兔全天戴自制的上颌矢状扩弓矫治器,对照组不做任何处理,自然生长。

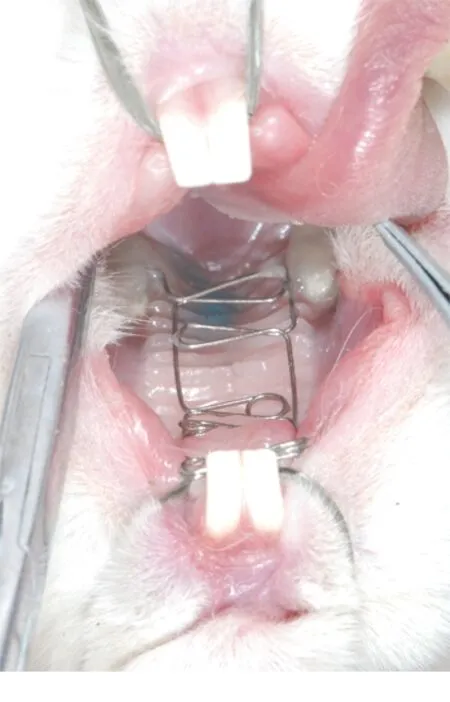
图1 矢状扩弓装置

2 结 果
实验组由于矢状方向扩弓后新骨的沉积,可以在类骨基质中看到沿牵张方向排列的高亮度散在的黄绿色荧光带出现;同时,在血运丰富及骨改建较好的区域,可以看到数条宽大荧光带平行走行(图2)。说明在扩弓过程中出现了较活跃的成骨活动。而对照组由于自然生长,荧光标记沉积带较实验组稀少,可以看到较细窄的黄绿色荧光带沉积,肉眼见强度及面积均不及实验组(图3)。经四环素荧光标记积分光密度值(×106)定量分析可见,矢状方向扩弓后,实验组荧光四环素标记的积分光密度值为0.61±0.16,对照组荧光四环素标记的积分光密度值为0.34±0.08,差异有统计学意义(P<0.01)。

图2 试验组的四环素荧光带
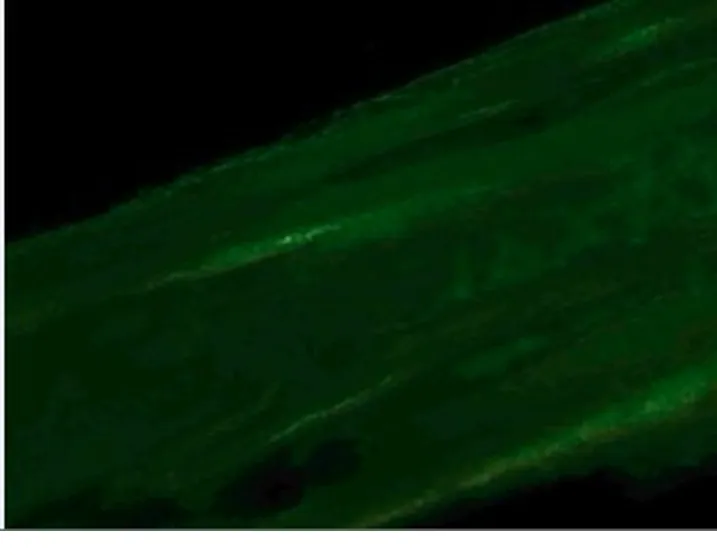
图3 对照组的四环素荧光带
3 讨 论
骨动力学参数标记物四环素是一种活性荧光物质,在波长为365~380nm的紫外光激发下,发出光波长为530~540nm的黄绿色荧光。可进入血液循环与新骨组织中的羟基磷灰石结合将荧光素标记于矿化活跃的部位[5]。在荧光显微镜下,不脱钙骨组织制片,可以看到骨组织中骨小梁表面出现明显的四环素标记带[6],以往研究[7]骨改建情况时用四环素标记大多是通过2次给药间2条四环素标记线的距离,反映新骨形成情况及形成速度。但2条标记线间的宽度受切片角度影响较大,本研究用四环素标记积分光密度观察,与Coelho等[8]研究新骨形成的方法一致,以反映新骨形成和骨改建的动力学过程,并通过其染色强度(黄绿色荧光)和面积反映新骨形成情况,使骨组织研究更客观。不脱钙骨磨片在光显微镜下,可见到骨组织中骨小梁表面出现明显的四环素荧光标记区域。加力2周后沿牵张方向平行排列的宽度不同荧光带,这可能是由于不同时期注射四环素并随骨改建过程逐渐沉积形成的,也可能是不同区域在同一时间的新骨沉积量不一致形成的。研究[9]发现在机械力作用下成骨细胞增殖能力明显增加,成骨细胞活跃可加快新骨的形成。本研究中四环素荧光标记显微镜观察显示,实验组上颌骨腭部有大量黄绿色荧光带沉积,荧光强度较强,面积较大,多平行于牵张方向,而对照组仅有少量黄绿色荧光带沉积且强度和面积不及实验组。说明扩弓区内有活跃的新骨形成,是在机械力的作用下由细胞增殖、分化形成的新骨;而对照组没有施加机械力,由于自然生长,有较弱的成骨现象。
本研究实验组较对照组的积分光密度值大(积分光密度可反映所测结构的光密度与面积的综合变化),表明实验组的新骨形成明显强于对照组。机械力刺激是一个在应力作用下促进新骨生长的过程,本研究机械力刺激后引起的上颌骨的改建可通过四环素标记带直观地反映出来,上颌骨矢状方向扩弓后,上颌骨腭部的应力增大区域出现大面积的荧光染色带,证实此部位的骨组织增生,从而促进上颌骨的生长改建。
[5] KAMITAKAHARA M,OHTSUKI C,MIYAZAKI T.Review paper behavior of ceramic biomaterials derived from tricalcium phosphate in physiological condition[J].J Biomater Appl,2008,23(3):197-212.
[6] COLILLA M,MANZANO M,VALLET-REGF M.Recent advances in ceramic implants as drug delivery systems for biomedical applications[J].Int J Nanomedicine,2008,3(4):403-414.
[7] 蔡晓清,裴庆国,吕臻,等.BMSC/β-TCP修复犬下颌骨缺损的实验研究[J].口腔颌面外科杂志,2010,20(4):249-253.
[8] COELHO PG,FREIRE JN,GRANATO R,et al.Bone mineral apposition rates at early implantation times around differently prepared titanium surfaces: a study in beagle dogs[J].Int J Oral Maxillofac Implants,2011,26(1):63-69.
[9] LI P,LONG J,TANG W,et al.Stress distraction osteogenesis by finite element analysis[J].J Craniofac Surg,2013,24(3):1031-1037.
——该叫矢状脊还是矢状隆起?

