NALP3/ASC/caspase-1在局灶节段性肾小球硬化肾组织中的表达变化*
张媛媛,侯卫平,曹雪娇,袁发焕
(第三军医大学新桥医院肾内科/全军肾脏病中心/重庆市肾脏病研究所/国家中医药管理局重点专科,重庆 400037)
肾病综合征(nephrotic syndrome,NS)是由多种不同病理类型的肾小球疾病所引起,临床上表现为大量蛋白尿、低蛋白血症、高脂血症和水肿,是肾脏疾病最常见的综合征之一,长期持续发展将致肾功能障碍。局灶节段性肾小球硬化(focal segmental glomerulosclerosis,FSGS)为肾病综合征的一种常见病理类型,同时伴有相应的肾小管间质急、慢性炎性病变为其显著的病理特征,大约30%~50% FSGS患者在5~20年内发展为终末期肾病[1]。通过阿霉素诱导的FSGS动物模型实验发现,肾组织中炎症因子白细胞介素(IL)-1β、IL-18在的表达显著升高,并与肾组织病理损害程度和肾功能血生化指标密切相关[2-3]。在NS患者尿液中发现IL-1β、IL-18均有升高[4-5]。然而在FSGS患者肾组织中IL-1β、IL-18的表达情况以及是通过何种通路激活目前尚不清楚。目前研究资料提示,上游NLR NALP3炎性复合体是激活IL-1β、IL-18的重要通路[6]。NALP3炎性复合体是NLRs炎性体家族成员之一,主要表达于抗原递呈细胞发挥启动炎性体装配的作用。NALP3炎性复合体由核心蛋白NALP3、衔接蛋白ASC、效应蛋白caspase-1以及Cardinal组成的多蛋白复合体。当危险信号作用于靶细胞,NALP3可以通过激活ASC和caspase-1,剪切IL-1家族成员前体成为具有活性的促炎症细胞因子IL-1β、IL-18,从而放大病变微环境炎症瀑布效应[7-8]。因此推测,NALP3信号通路在FSGS患者肾小管间质损害中发挥重要作用。本研究通过临床收集FSGS患者肾组织标本,观察肾组织NALP3炎性复合体和细胞炎性因子IL-1β、IL-18的表达变化情况,结合肾小管间质病理损害程度、F4/80的表达变化和临床生化检测结果,探讨NALP3炎性复合体在FSGS中表达及作用,从而进一步揭示FSGS的发病机制。
1 资料与方法
1.1一般资料 依据NS诊断标准,选取2011年3月至2013年3月本院肾内科收治的临床诊断为NS的患者42例,经肾穿刺活检术及病理学检查明确诊断为FSGS 26例(FSGS组),其中男16例,女10例,平均年龄(39±8)岁;对照组 16例,其中男10例,女6例,平均年龄(41±10)岁。对照组肾组织标本均取自肾错构瘤患者肾切除远离错构瘤部位的肾组织,经光镜检查均证实为正常的肾组织。收集患者治疗前各生化指标:24 h尿蛋白定量、血肌酐、血尿素、血浆总蛋白、血浆清蛋白。计算肾小球滤过率(eGFR),eGFR[mL/(min·1.73 m2)]=186×SCr-1.154×年龄-0.203×0.742(女)×1.233(中国)[9]。
1.2肾小管间质病理分级情况 参照肾小管间质损伤(tubulointerstitial damage,TID)评分的方法,对FSGS肾小管间质的病变进行半定量评分,根据光镜下肾小管变性、坏死,肾小管萎缩,间质炎症细胞浸润及间质纤维化4个指标作为评分依据,按照病变范围及严重程度分为4个等级:0分,无肾小管和肾间质病变;1分,轻度病变(小于总面积的25%);2分,中度病变(占总面积的25%~50%);3分,重度病变(大于总面积的50%)[10]。每张切片在低倍视野下(×100倍)随机选取10个视野,取其平均值。上述结果分析均采用盲法进行,由2名与本研究无关病理专业人员进行评定。
1.3主要试剂 兔抗人NALP3抗体购于美国Millipore公司,ASC抗体购于美国LifeSpan Biosciences公司,caspase-1、IL-1β、IL-18、F4/80抗体均购美国Abcam公司。抗小鼠或兔即用型非生物素免疫组化EliVisionTMsuper 检测试剂盒购自福州迈新生物技术开发公司,封闭用正常山羊血清工作液、显色试剂盒均购自北京中衫金桥生物技术公司。
1.4肾组织切片NALP3、ASC、caspase-1、IL-1β、IL-18、F4/80的表达检测 肾组织经常规石蜡包埋,切2 μm厚切片,经常规脱蜡、水洗后,行微波抗原修复,3%H2O2室温15 min消除内源性过氧化物酶后,分别滴加:兔抗人NALP3多克隆抗体(1∶1 000)、兔抗人caspase-1多克隆抗体(1∶50)、兔抗人ASC多克隆抗体(1∶200)、兔抗人IL-1β多克隆抗体(1∶200)、兔抗人IL-18多克隆抗体(1∶200),大鼠抗人F4/80单克隆抗体(1∶50),4 ℃冰箱内过夜,0.01 mol/L的磷酸盐缓冲液(PBS)冲洗后加入二抗工作液,在光镜下控制DAB溶液染色,苏木素复染,水洗脱水、透明后中性树胶封片,阴性对照以PBS代替一抗,其他操作同前。
采用LEICA光学显微镜(400×)观察采集图像。每个切片随机测定5个视野,应用Image Pro Plus图像分析软件测量每一视野中阳性染色区域的积分光密度值(IOD)与测量区域的面积(area),计算平均光密度(mean density)=(IOD SUM)/area对免疫组化染色进行半定量分析。

2 结 果
2.1两组患者肾组织NALP3/ASC/caspase-1、IL-1β、IL-18的表达变化及相关性分析 免疫组化结果显示,对照组肾小管上皮细胞NALP3有少量表达,ASC、caspase-1、IL-1β、IL-18不表达,在FSGS组中,NALP3、ASC、caspase-1、IL-1β、IL-18在肾小管上皮细胞中表达明显增强,免疫组化染色呈棕黄色,主要表达于肾小管上皮细胞的细胞质,细胞核呈阴性,见图1~5。通过Pearson相关分析显示,NALP3/ASC/caspase-1与IL-1β、IL-18的表达均呈正相关,见表1。

A:对照组;B:FSGS组;箭头所指为表示阳性表达。
图1两组患者肾小管上皮细胞NALP3的表达变化(×400)

A:对照组;B:FSGS组;箭头所指为表示阳性表达。
图2两组患者肾小管上皮细胞ASC的表达变化(×400)

A:对照组;B:FSGS组;箭头所指为表示阳性表达。
图3两组患者肾小管上皮细胞caspase-1的表达变化(×400)

A:对照组;B:FSGS组;箭头所指为表示阳性表达。
图4两组患者肾小管上皮细胞IL-1β的表达变化(×400)

A:对照组;B:FSGS组;箭头所指为表示阳性表达。

图5 两组患者肾小管上皮细胞IL-18的表达变化(×400)

表2 肾小管间质损伤评分比较
a:P<0.01,与对照组比较。
2.2两组患者肾间质病理评分及巨噬细胞检测 与对照组相比,FSGS组患者肾小管间质损伤评分差异有统计学意义(P<0.01)。见表2。免疫组化结果显示,对照组肾间质F4/80有少量表达,在FSGS组中,F4/80表达明显增强,主要表达于肾小管间质活化巨噬细胞的细胞膜,免疫组化染色呈棕黄色。见图6。
2.3FSGS患者肾小管上皮细胞NALP3/ASC/caspase-1、IL-1β、IL-18与肾小管间质损伤程度及F4/80的相关性分析 患者肾小管上皮细胞NALP3/ASC/caspase-1、IL-1β、IL-18的表达与肾小管间质损伤程度及F4/80的表达呈正相关,见表3。
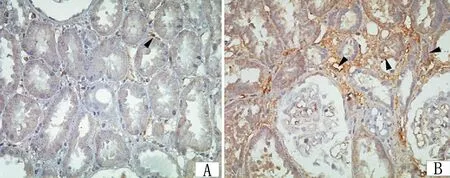
A:对照组;B:FSGS组;箭头所指为表示阳性表达。
图6两组患者肾小管间质F4/80的表达变化(×400)
2.4两组患者肾小管上皮细胞NALP3、caspase-1、IL-1β、IL-18与临床生化指标的相关性 与对照组相比,FSGS患者尿蛋白、血肌酐、尿素、eGFR、血清总蛋白、清蛋白差异均有统计学意义(P<0.01),见表4。相关性分析结果显示,FSGS患者肾小管上皮细胞NALP3、caspase-1、IL-1β、IL-18的表达水平与尿素、血浆总蛋白、清蛋白的水平无显著相关,与尿蛋白、血肌酐呈正相关(P<0.05),与eGFR呈负相关(P<0.05),见表5。

表3 NALP3/ASC/caspase-1、IL-1β、IL-18与肾小管间质评分及F4/80的相关性
表4 两组患者各临床生化指标比较
a:P<0.01,与对照组比较。
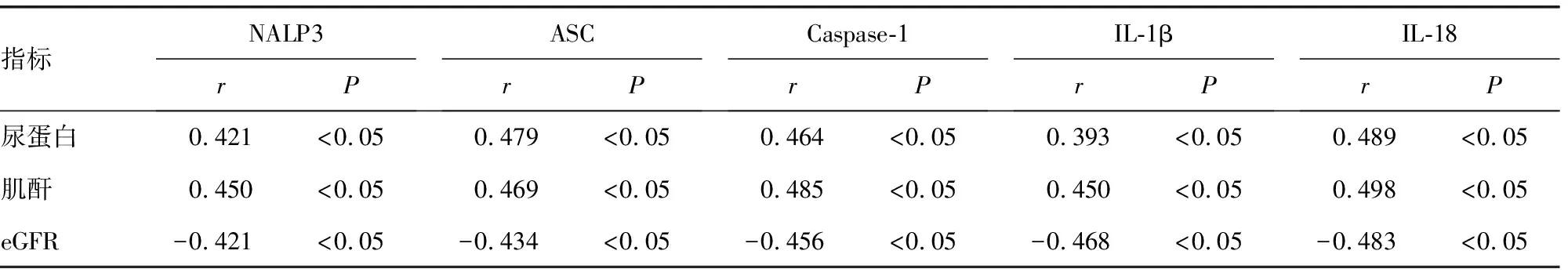
表5 NALP3、caspase-1、IL-1β、IL-18与肾小管间质损伤及临床生化指标的相关性
3 讨 论
FSGS是NS的一种常见的病理类型,光镜下病理特征为病变呈局灶、节段分布,表现为受累节段的硬化(系膜基质增多、毛细血管闭塞、球囊粘连等),同时伴有显著的肾小管间质急、慢性炎性病变,而且肾小球病损程度往往与肾小管间质病变程度呈正相关[11-12]。
IL-1β主要由单核-巨噬细胞分泌,能进一步触发炎性反应,在局部和全身炎性反应中起到了核心作用。通过FSGS动物模型发现,模型小鼠比正常对照小鼠肾组织中IL-1β表达明显升高[2]。IL-18主要由活化的巨噬细胞生成,能刺激Th1细胞分泌粒细胞-巨噬细胞集落刺激因子、IFN-γ以及IL-2,并能够促进Th1细胞的增殖。动物实验发现,通过蛋白结合的方式减少IL-18的表达,能减轻FSGS模型小鼠蛋白尿、肾组织损伤程度、肾间质巨噬细胞和T细胞的数量以及炎性因子表达,说明IL-18在FSGS的发病机制中扮演了重要的角色[3]。此外,既往研究证明肾病综合征患者尿中IL-18水平明显升高,并与尿蛋白存在明显相关性[5]。
NALP3炎性复合体是IL-1β、IL-18活化的重要信号通路。NLRs炎性体是机体多种非特异性天然免疫危险信号刺激抗原递呈细胞表达的一类蛋白复合体,其对机体获得性免疫反应具有重要调控作用[13]。NALP3炎性体是NLRs炎性体家族成员之一,由NALP3,衔接蛋白ASC和Cardinal,以及caspase-1组成蛋白复合体,主要表达于巨噬细胞、DCs等APC发挥启动炎性体装配的作用[7]。NALP3炎性体能感受胞质内多种微生物产物和代谢性应激,一旦危险信号作用于靶细胞,NALP3立即发生寡聚化,募集ASC和Cardinal,激活caspase-1,剪切IL-1家族成员前体成为具有活性的IL-1β、IL-18促炎症细胞因子,进而放大病变微环境炎症瀑布效应[8]。Wang等[14]认为阿霉素诱导的肾病综合征小鼠通过ATP受体P2X7可诱导NALP3炎性体活化导致炎性细胞因子释放从而损伤肾组织。Vilaysane等[15]对CKD患者研究发现FSGS患者肾组织中NALP3 mRNA表达显著增高,且与肾功能恶化程度显著相关;通过输尿管梗阻实验发现,与对照组相比NALP3基因敲出小鼠肾组织炎症浸润和纤维化程度明显减轻,其原因可能是caspase-1活性下降以及IL-1β和IL-18成熟受阻。但在FSGS型肾病综合征患者肾组织标本中NALP3炎性复合体和IL-1β、IL-18表达情况如何及二者关系均未见相关研究报道。对此本研究首次检测并分析它们在FSGS患者肾组织中的表达及意义。
本实验结果发现,NALP3/ASC/caspase-1主要表达于肾小管上皮细胞,在正常对照组中NALP3有表达但表达较弱,ASC、caspase-1均无表达,而在FSGS患者肾组织中NALP3、ASC、caspase-1表达明显升高。同时发现IL-1β、IL-18均有同样的表达趋势,进一步分析显示NALP3/ASC/caspase-1与IL-1β、IL-18表达变化显著相关。提示在FSGS患者肾组织中NALP3炎性复合体可能是IL-1β、IL-18的重要激活通路。
同时发现在NALP3/ASC/caspase-1及IL-1β、IL-18表达高的部位,其周围炎症细胞明显增加,通过相关性分析NALP3/ASC/caspase-1和IL-1β、IL-18的高表达与患者肾小管间质损伤程度以及F4/80的阳性细胞数表达、尿蛋白及肾功能损害呈正相关,与eGFR呈负相关。提示NALP3炎性复合体过表达是FSGS患者肾小管间质炎性细胞浸润的重要原因。
综上所述,NALP3炎性复合体通过激活IL-1β、IL-18等下游炎症因子,参与FSGS的发病机制,其表达程度越高、肾组织病变程度越重,是否能作为FSGS预后的预警指标,还需进一步的临床验证。
参考文献:
[1] Thomas DB,Franceschini N,Hogan SL,et al.Clinical and pathologic characteristics of focal segmental glomerulosclerosis pathologic variants[J].Kidney Int,2006,69(5):920-926.
[2] Pereira RL,Reis VO,Semedo P,et al.Invariant natural killer T cell agonist modulates experimental focal and segmental glomerulosclerosis[J].PLoS One,2012,7(3):e32454.
[3] Wyburn KR,Chadban SJ,Kwan T,et al.Interleukin-18 binding protein therapy is protective in adriamycin nephropathy[J].Am J Physiol Renal Physiol,2013,304(1):F68-76.
[4] Huang Z,Wen Q,Zhou SF,et al.Differential chemokine expression in tubular cells in response to urinary proteins from patients with nephrotic syndrome[J].Cytokine,2008,42(2):222-233.
[5] Matsumoto K,Kanmatsuse K.Elevated interleukin-18 levels in the urine of nephrotic patients[J].Nephron,2001,88(4):334-339.
[6] van de Veerdonk FL,Netea MG,Dinarello CA,et al.Inflammasome activation and IL-1β and IL-18 processing during infection[J].Trends Immunol,2011,32(3):110-116.
[7] Anders HJ,Muruve DA.The inflammasomes in kidney disease[J].J Am Soc Nephrol,2011,22(6):1007-1018.
[8] Franchi L,Eigenbrod T,Munoz-Planillo R,et al.The inflammasome:a caspase-1-activation platform that regulates immune responses and disease pathogenesis[J].Nat Immunol,2009,10(3):241-247.
[9] Ma YC,Zuo L,Chen JH,et al.Modified glomerular filtration rate estimating equation for Chinese patients with chronic kidney disease[J].J Am Soc Nephrol,2006,17(10):2937-2944.
[10] Cattran DC,Coppo R,Cook HT,et al.The Oxford classification of IgA nephropathy:rationale,clinicopathological correlations,and classification[J].Kidney Int,2009,76(5):534-545.
[11] Izu A,Sugimoto K,Fujita S,et al.Nonfunction of the ECT2 gene May cause renal tubulointerstitial injury leading to focal segmental glomerulosclerosis[J].Clin Exp Nephrol,2012,16(6):875-882.
[12] Gbadegesin R,Lavin P,Foreman J,et al.Pathogenesis and therapy of focal segmental glomerulosclerosis:an update[J].Pediatr Nephrol,2011,26(7):1001-1015.
[13] Martinon F,Mayor A,Tschopp J.The inflammasomes:guardians of the body[J].Annu Rev Immunol,2009,27:229-265.
[14] Wang YM,McRae JL,Robson SC,et al.Regulatory T cells participate in CD39-mediated protection from renal injury[J].Eur J Immunol,2012,42(9):2441-2451.
[15] Vilaysane A,Chun J,Seamone ME,et al.The NLRP3 inflammasome promotes renal inflammation and contributes to CKD[J].J Am Soc Nephrol,2010,21(10):1732-1744.

