干细胞标志物SALL4在宫颈癌中的表达研究*
张 铭,张一鸣△,左 伟,钱 晖,许文荣
(1.南京医科大学附属常州市妇幼保健院,江苏常州 213003;2.江苏大学基础医学与医学技术学院,江苏镇江 212013)
干细胞是一类具有自我更新能力、无限增殖能力以及多向分化潜能的原始细胞,在肿瘤形成、生长、浸润、转移和复发中起着关键性的作用[1-2]。SALL4 是胚胎干细胞的特异标记物,在人类多种肿瘤中均有表达。本研究从基因和蛋白的角度检测了56例宫颈癌组织和35例正常宫颈组织中SALL4的表达,探讨该基因与宫颈癌的关系及其意义。
1 资料与方法
1.1一般资料 56例宫颈癌组织(鳞癌46例,腺癌10例)取自2010年3月至2012年12月常州市妇幼保健院妇科接受手术的宫颈癌患者,年龄21~68岁,平均年龄46.5岁, 35例正常宫颈组织标本取自同期该院宫颈科和妇科患者,作为对照组,年龄22~66岁,平均年龄46.3岁,所有病例均经病理检查确诊,且术前未接受任何治疗(本研究遵循的程序符合该院人体试验委员会所制定的伦理学标准,得到该委员会批准,并与患者签署临床研究知情同意书)。
1.2主要试剂 逆转录试剂盒购自Fermentas公司, SALL4抗体购自Abcam公司,二抗购自上海碧云天公司, Trizol试剂购自Invitrogen公司。
1.3方法
1.3.1RT-PCR 取50~100 mg宫颈组织,用Trizol提取总RNA,按照逆转录试剂盒说明书合成cDNA。引物由上海生工公司合成,SALL4产物长度为142 bp,上游引物为5′-TCG ATG GCC AAC TTC CTT C-3′,下游引物为5′-GAG CGG ACT CAC ACT GGA GA-3′,β-actin产物长度为265 bp,上游引物为5′-CAC GAA ACT ACC TTC AAC TCC-3′,下游引物为5′-CAT ACT CCT GCT TGC TGA TC-3′。反应体系为25 μL,分别含cDNA 1 μL ,10×buffer 2.5 μL,dNTP 2.0 μL,正、反向引物各0.5 μL,TagDNA 聚合酶0.2 μL。PCR循环条件为:94 ℃ 5 min,94 ℃变性30 s,SALL4(62 ℃)/β-actin(56 ℃)退火30 s,72 ℃延伸30 s,共35个循环,72 ℃ 5 min,将RT-PCR扩增产物进行电泳分析。
1.3.2免疫组织化学 按抗体说明书进行抗原修复,SP法进行免疫组化染色,一抗为兔抗人SALL4抗体(1∶800),二抗为HRP标记的羊抗兔IgG(1∶3 000),DAB 酶底物显色,苏木精复染,常规脱水、透明、干燥、封片,显微镜下观察结果。阴性对照用PBS代替一抗,其余步骤相同。

2 结 果
2.1SALL4 mRNA在宫颈癌组织和正常宫颈组织中的表达 RT-PCR结果显示SALL4条带位于142 bp处,内参β-actin条带位于265 bp处,见图1,灰度扫描结果表明,宫颈癌组织SALL4 mRNA(2.56±0.22)表达高于正常宫颈组织(0.38±0.03),二者比较差异有统计学意义(t=58.1,P<0.01)。
2.2免疫组化结果 免疫组织化学染色结果显示,SALL4蛋白在宫颈癌组织和正常宫颈组织中的表达阳性率分别为80.4%(45/56)、11.4%(4/35),二者比较差异有统计学意义(χ2=41.177,P<0.01),在宫颈癌组织SALL4蛋白核浆均有表达,主要定位于细胞核,呈现棕黄色,弥漫性分布,见图2。

1、2:正常宫颈组织;3、4:宫颈癌组织;B:空白对照;M:DNA marker DL-2000。
图1 RT-PCR检测SALL4 mRNA表达的琼脂糖电泳结果

A:正常宫颈组织;B:宫颈鳞癌组织;C:宫颈腺癌组织,箭头所指为SALL4阳性细胞。
图2免疫组化检测SALL4蛋白在宫颈癌和正常宫颈组织中的表达(×400)
2.3宫颈癌组织中SALL4的表达与临床病理参数的关系 免疫组化检测结果表明,SALL4 的阳性表达与肿瘤分化程度相关,中、高分化组低于低分化组(χ2=4.226,P=0.039),与年龄、FIGO分期、肿瘤大小、病理类型、淋巴结是否转移无关(χ2=0.004、3.403、1.223、0.827、0.011,P>0.05),见表1。
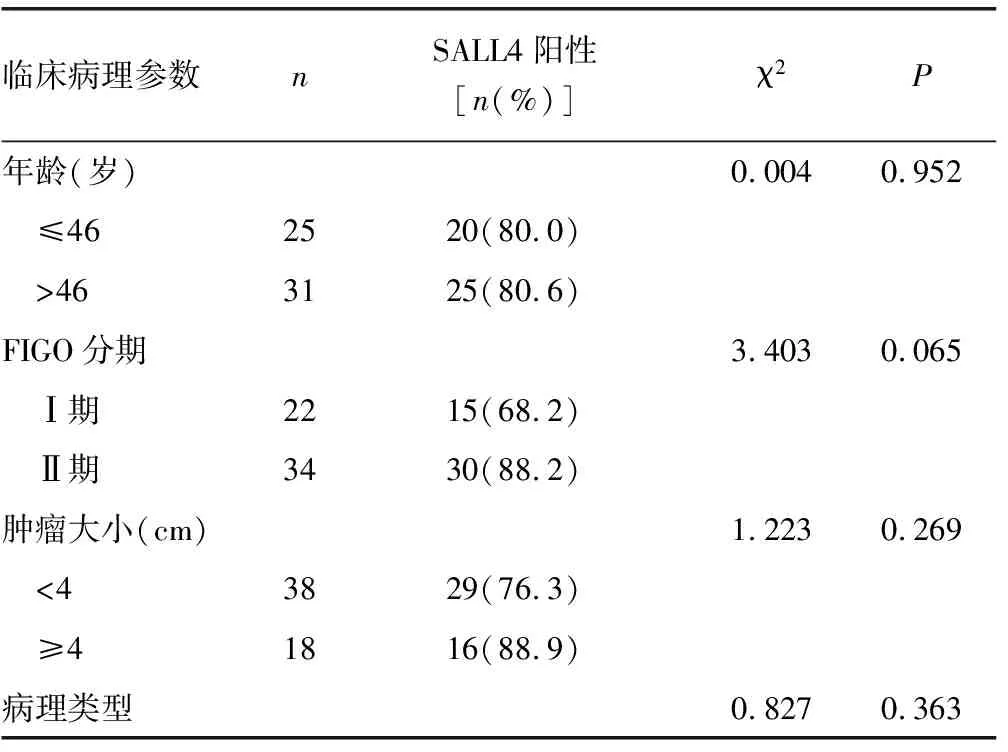
表1 宫颈癌组织中SALL4的表达与临床病理参数的关系

续表1 宫颈癌组织中SALL4的表达与临床病理参数的关系
3 讨 论
宫颈癌的发病机制尚未完全阐明,其在病因上是多因素、在病理上是多环节、在细胞生物方面是多信号途径、多基因参与的结果[3]。癌基因和抑癌基因是肿瘤发生机制研究中的重大发现,SALL4基因是2002年由AL-Baradie等研究DRRS综合征(duane radial ray syndrome,DRRS)家系遗传时发现的原癌基因,由4个外显子和16个内含子组成。SALL4基因编码的蛋白质属于C2H2型锌指转录子,定位于细胞核内[4-5]。近年来研究发现,SALL4基因是维持胚胎干细胞功能的重要调控基因,其通过Pousfl调节胚胎干细胞和早期胚胎的发育,在维持胚胎干细胞的多能性和自我更新中具有重要作用[6]。多项研究表明,SALL4的表达与遗传性疾病、白血病及一些肿瘤疾病的发生发展有密切关系[7-8]。
本研究通过RT-PCR检测56例宫颈癌和35正常宫颈组织中SALL4的表达,发现宫颈癌组织SALL4 mRNA表达高于正常宫颈组织(P<0.01),免疫组化结果在蛋白质水平上证实了这一点,宫颈癌组织中SALL4基因高表达,提示宫颈癌组织中可能含有表达SALL4的宫颈癌干细胞,肿瘤干细胞假说认为只有小部分肿瘤细胞可以产生肿瘤并维持肿瘤生长及异质性,是肿瘤发生、发展、转移和复发的根源[9-10],作为胚胎干细胞的标志物,SALL4在肿瘤组织中的高表达表明宫颈细胞的癌变过程可能与胚胎基因的激活密切相关,也有研究者认为这是干细胞致癌的一种证据[11],SALL4与宫颈癌的发生密切相关。本研究根据免疫组化结果进一步分析了宫颈癌组织中SALL4的表达与临床病理资料间的关系,发现SALL4的阳性表达与宫颈癌的分化状态相关,低分化阳性率高于中、高分化(P<0.05),但与宫颈癌患者的年龄、肿瘤大小、宫颈癌的病理类型、临床分期及有否淋巴结转移无关,说明SALL4不仅参与了宫颈癌的发生,还可能与宫颈癌的预后关系密切。
综上所述,胚胎干细胞的标志物SALL4在宫颈癌组织中表达增加,提示宫颈癌中可能存在肿瘤干细胞,宫颈癌的发生可能与肿瘤干细胞关系密切,进一步分析发现SALL4的阳性表达与宫颈癌的分化状态相关,表明SALL4可能在宫颈癌的发生发展过程中有重要作用。
参考文献:
[1] Melton C,Judson RL,Blelloch R.Opposing microRNA families regulate self-renewal in mouse embryonic stem cells[J].Nature,2010,463(7281):621-626.
[2] Iwasaki H,Suda T.Cancer stem cells and their niche[J].Cancer Sci,2009,100(7):1166-1172.
[3] Naucler P,Ryd W,Tornberg S,et al.Efficacy of HPV DNA testing with cytology triage and/or repeat HPV DNA testing in primary cervical cancer screening[J].J Natl Cancer Inst,2010,101(2):88-99.
[4] Al-Baradie R,Yamada K,St Hilaire C,et al.Duane radial ray syndrome(Okihiro syndrome) maps to 20q13 and results from mutations in SALL4,a new member of the SAL family[J].Am J Hum Genet,2002,71(5):1195-1199.
[5] Yang J,Gao C,Chai L,et al.A novel SALL4/OCT4 transcriptional feedback network for pluripotency of embryonic stem cells[J].PLoS One,2010,5(5):e10766.
[6] Kobayashi D,Kuribayshi K,Tanaka M,et al.SALL4 is essential for Cancer cell proliferation and is overexpressed at early clinical stages in breast cancer[J].Int J Oncol,2011,38(4):933-939.
[7] Liu A,Cheng L,Du J,et al.Diagnostic utility of novel stem cell markers SALL4,OCT4,NANOG,SOX2,UTFl and TCLl in primary mediastinal germ cell tumors[J].Am J Surg Pathol,2010,34(5):697-706.
[8] Yang J,Chai L,Gao C,et al.SALL4 is a key regulator of survival and apoptosis in human leukemic cells[J].Blood,2008,112(3):805-813.
[9] Vlashi E,Kim K,Lagadec C,et al.In vivo imaging,tracking,and targeting of Cancer stem cells[J].J Natl Cancer Inst,2009,101(5):350-359.
[10] Gupta PB,Chaffer CL,Weinberg RA.Cancer stem cells:mirage or reality?[J].Nat Med,2009,15(9):1010-1012.
[11] Gidekel S,Pizov G,Bergman Y,et al.Oct-3/4 is a dose-dependent oncogenic fate determinant[J].Cancer Cell,2003,4(5):361-370.

