脱细胞膀胱基质补片的生物相容性研究
范雪梅,徐惠成,王朝丽
(1.成都军区总医院妇产科,成都 610083;2.第三军医大学西南医院妇产科,重庆 400038;3.中国人民解放军324医院体检中心,重庆 400020)
近年来,随着材料科学和组织工程学的进步,脱细胞基质成分的组织工程补片大量涌现,并逐渐在盆底修复重建手术中采用,替代薄弱受损的盆底筋膜组织[1]。膀胱损伤后能迅速进行自我修复,用膀胱基质修复受损组织是合乎逻辑的选择[2]。目前,脱细胞膀胱基质(acellular bladder matrix,ABM)已成为泌尿外科研究和应用的热点,但还未见其用于盆底修复方面的报道。本研究在前期实验基础上采用表面活性剂联合酶消化法[3-5],对新鲜健康猪膀胱(屠宰场获取)进行脱细胞处理,制成 ABM补片,采用体内外相结合的实验方法对生物相容性进行评价,为其在盆底修复方面的应用进一步提供依据。
1 材料与方法
1.1实验动物 健康新西兰大白兔15只,体质量2.1~2.5 kg,雌性;由第三军医大学实验动物中心提供,实验动物使用合格证:SCXK(渝)2007-0002。
1.2仪器与试剂 苯甲基磺酰氟(北京鼎国生物技术有限公司),三羟甲基氨基甲烷(BBI),Triton X-100、DNA酶及RNA酶(上海生工有限公司),十二烷基硫酸钠(捷瑞生物工程有限公司),苯酚(北京化工厂),聚丙烯网片( 美国强生公司)。冻干机,扫描电镜,CO2培养箱,CK2型倒置相差显微镜,BIO-RAD 680 XR型酶标仪。
1.3方法
1.3.1材料浸提液制备 参照ISO10993-5(2009)[6],浸提介质为RPMI1640培养液,浸提比例为6 cm2/mL,培养液完全浸没样品,密封后在37 ℃无菌条件下浸泡24 h制成浸提液。完成后用RPMI1640培养液分别稀释,制备100.0%、50.0%、25.0%、12.5%的浸提液,放入冰箱4 ℃保存(实验组)。空白对照组: RPMI1640培养液。阴性对照组:聚苯乙烯(浸提方法同试验样品)。阳性对照组:含0.5%苯酚溶液(由RPMI1640培养液配置)。
1.3.2细胞毒性试验 冻存 L-929 细胞复苏后经过两次传代,取对数生长期的L929细胞,用0.25%胰蛋白酶消化2~3 min。倒去消化液,RPMI1640培养液将细胞稀释至1×105个/mL。将L929细胞悬液加至96孔细胞培养板,100 μL/孔,在37 ℃、5%CO2饱和湿度培养箱内培养24 h。培养结束后,弃去培养板内培养液,按实验分组分别进行换液(每组5孔),再把培养板放入培养箱内继续培养,于1、3、5 d各取出一块培养板,倒置相差显微镜下观察细胞形态、照相,每孔加入MTT染色剂50 μL(1 mg/mL),置培养箱内培养2 h。吸尽原液,每孔加入100 μL异丙醇,吹打震荡,充分混匀,用酶标仪以检测波长570 nm,参考波长630 nm,分别测定各孔OD值。并根据公式计算细胞相对增殖率(RGR)=供试品组(阴性、阳性组) OD值/空白对照组OD值×100%。按照评分标准(RGR≥100%为0级,75%~99%为1级,50%~74%为2级,25%~49%为3级,1%~24%为4级,0%为5级),对样品细胞毒性程度进行评价。
1.3.3溶血试验 参照ISO10993-4(2009)设计实验。采集新西兰兔血2 mL与1 mL肝素混合,并加1.5 mL生理盐水稀释备用。设实验组(ABM生理盐水100%浸提液);阴性对照组(生理盐水);阳性对照组(蒸馏水)各5 mL,每组5支试管。每支试管加入稀释的抗凝兔血0.1 mL,37 ℃孵育60 min。离心10 min(3 000 r/min),观察上层液体颜色及红细胞沉积情况。酶标仪492 nm处测OD值,计算溶血率,溶血率=[待测OD值 (Dt)-阴性对照组OD值(Dnc)]/[阳性对照OD组(Dpc)-Dnc]×100%。
1.3.4阴道埋植试验 新西兰大白兔10只,雌性,未孕未产。分为实验组和对照组,每组5只。采用3%戊巴比妥钠(45 mg/kg)腹腔注射麻醉,阴道消毒,剪开阴道直肠交界处皮肤,分离阴道后壁黏膜与直肠间隙,达顶点处,长约2.0~2.5 cm[7]。ABM裁剪成10 mm×20 mm大小植入实验组家兔阴道后壁黏膜下方,将目前临床上最常用于盆底修复的人工合成材料聚丙烯网片[8]剪成同样大小植入另一组家兔阴道作对照。术后每天观察手术切口及动物反应变化,于12周处死动物后采集样本(植入材料及表面附着组织),甲醛固定,石蜡包埋,伊红-苏木素染色制成病理切片,在光镜下观察炎症反应、新生血管形成和成纤维细胞增殖情况。

2 结 果
2.1细胞毒性试验 倒置相差显微镜观察培养1 d后(图1),实验组细胞贴壁生长,形态良好,为长梭形或不规则三角形与阴性对照组相似;阳性对照组细胞无明显生长,变圆、皱缩。随时间延长可见实验组和阴性对照组细胞数量逐渐增多,两组相比未见明显差异,而阳性对照组随着时间的延长,细胞数目减少,细胞死亡。染色后,实验组 MTT 结晶物密度与阴性对照组相似,呈现为透明的蓝紫色,阳性组染色后变色不明显。从表1可见,培养同样的时间实验组各浓度的 OD 值之间差异无统计学意义(P>0.05);随培养时间延长,各浓度组OD值都逐渐增高,不同浓度的实验组与阴性对照组之间差异无统计学意义(P>0.05);各实验组均与阳性对照组比较差异有统计学意义(P<0.01)。阳性对照组细胞毒性级别为4~5级,实验材料组细胞毒性级别与阴性对照组同为 0~1级,可以认为ABM无细胞毒性。
2.2溶血试验 生理盐水组和实验组静置后个管内均可见血细胞沉积,而蒸馏水组各管颜色均一,呈淡红色,无明显血细胞沉积。见表2。阴性对照组与实验组OD值差异无统计学意义(P>0.05), 与阳性对照组比较差异有统计学意义(P<0.05)。实验组溶血率为1.5%,低于5%,因此判定ABM符合生物材料的溶血试验要求。
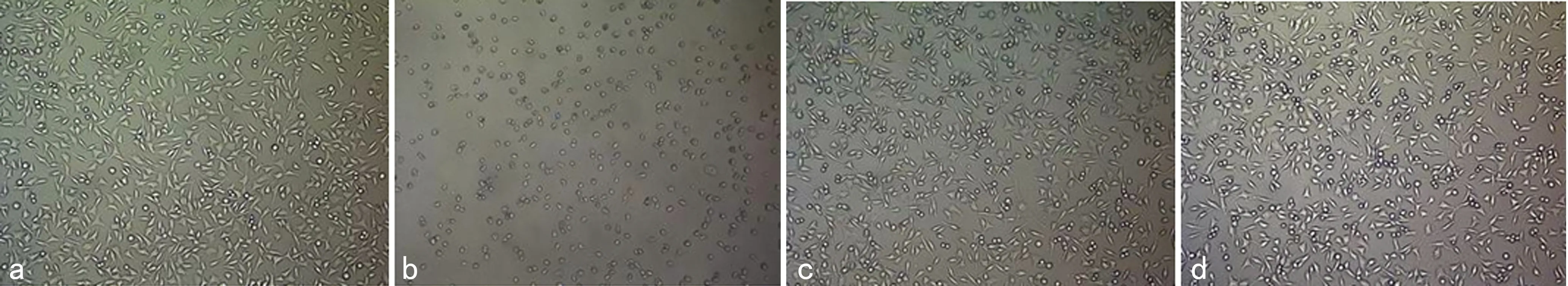
a:阴性对照组;b:阳性对照组;c:实验组100%浸提液;d:实验组12.5%浸提液。
图1 倒置相差显微镜观察培养1 d各组L929细胞的形态变化(×100)
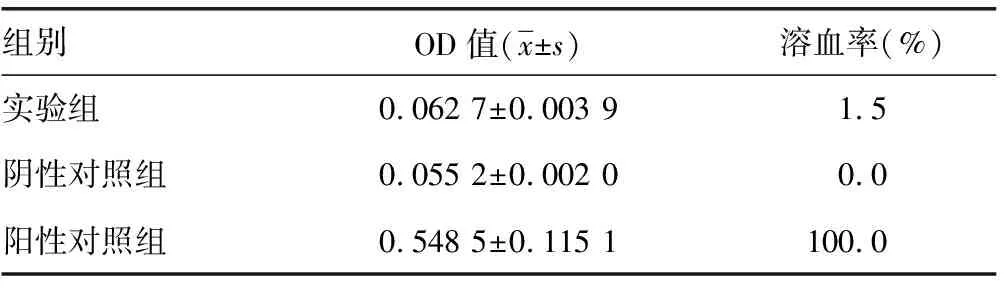
表2 各组吸光度值和溶血率测定(n=5)
2.3阴道埋植试验
2.3.1大体观察 ABM植入阴道后,伤口无红肿、渗液等炎性反应,植入部位未见红肿、侵蚀和纤维包块形成,术后12周未见ABM补片残存;聚丙烯组均出现网片皱缩,有2例(40%)出现材料穿透阴道即侵蚀反应。
2.3.2组织病理学观察 术后12周,ABM胶原变性断裂,成纤维细胞增多,周边围绕极少的嗜酸性粒细胞及淋巴细胞,补片已基本降解。聚丙烯在体内未发生降解,网孔周围有较多成纤维细胞环绕,胶原纤维较紊乱,炎症反应呈中、重度,伴有坏死。见图2。

A:ABM补片大部分降解断裂呈红色均质(黑色箭头),与周围宿主基质融合。B:聚丙烯网片(黑色箭头)网孔周围胶原较少,有坏死(红色箭头)。
图2阴道植入ABM和聚丙烯12周后的光镜下组织学改变(HE染色×100)
3 讨 论
理想的盆底修复重建替代材料应具备无菌、持久耐用、不致癌、价廉、无抗原反应并且能抵抗机体组织重塑[9-10],目前尚没有可以满足以上全部要求的替代材料。脱细胞基质材料由于不含细胞表面受体的特异识别位点,不易引发受体的免疫排斥反应,增加了组织相容性,减少了感染概率,提供了一个有利于正常的细胞生长,分化,血管生成的环境,能快速与宿主整合,这是组织工程移植物能长期存在体内发挥作用的关键。脱细胞移植物按照来源可分为同种异体和异种移植物。由于同种异体的移植材料来源有限,价格较高,且涉及伦理问题,目前已较少作为移植材料。异种移植材料较易获得,国外已经商品化的异种移植物包括牛阔筋膜、牛心包、马心包、猪小肠黏膜下组织、猪真皮、胎牛皮、猪膀胱、猪心脏瓣膜等[11-12],在泌尿外科、耳鼻喉头颈外科、普通外科、整形外科中已有应用,但在妇产科仅有脱细胞猪真皮和猪小肠黏膜下组织作为盆底修复补片的少量报道。
生物相容性是生物材料研究中始终贯穿的主题,主要采用体外法和体内植入试验对材料生物相容性进行评价[13]。通过相关的物理化学法对其性能进行评价,并在简化的体外模型表面上研究材料的细胞相容性即为体外法;将材料植入动物体内一段时间取出观察其炎症反应及组织长入情况,即为体内植入试验,组织学检查是其主要检查方法。本课题组在前期实验研究中将5种最常用的猪脱细胞基质材料,进行体外相关特性检测,结果发现ABM具有最长的降解周期、最强的抗菌性能、最高的吸水性、最好的生物力学性能,初步认为适合于盆底特殊环境[14]。因此,本实验参照ISO10993制定的相关方法和标准,对ABM的生物相容性进行全面评价。
在细胞毒性实验中,各实验组、空白组和阴性对照组的细胞随着培养时间的延长,细胞数量逐渐增加,说明12.5%、25.0%、50.0%和100.0%的ABM浸提液对L929细胞的增殖无影响。细胞毒性与被测材料的量尤其是表面积有关,实验设计了不同浓度的浸提液比较,其结果差异无统计学意义,进一步说明本实验材料对细胞没有毒性,符合生物材料的无毒性要求。
在溶血实验中,阴性对照组和实验组静置后各管内均见到有血细胞的沉积,两组OD值差异无统计学意义(P>0.05)。而阳性对照组呈淡红色,出现明显溶血,其OD值与阴性对照组和实验组比较差异有统计学意义(P<0.05)。材料浸提液溶血率合格,表明本实验材料无溶血作用。
ABM补片在植入家兔阴道12周后已基本降解;显示呈极轻、轻度炎症反应,ABM补片与宿主组织融合,纤维细胞增殖明显,表现出良好的组织相容性。而聚丙烯网片炎症反应呈中、重度,伴有坏死,出现了临床上常见的并发症即侵蚀。关于聚丙烯网片和生物材料用于腹部疝修补的研究已大量报道,但植入阴道的研究相对比较缺乏。同样的材料经腹部手术证明是有用的,而其用于阴道手术中可能无效[15]。本实验将材料植入阴道更好地反映其作为盆底补片的生物相容性。
本实验结果表明,ABM有良好的生物相容性,为其将来应用于盆底重建替代材料方面奠定了一定基础。在下一步工作中,针对盆底重建替代材料需要在体内持久修复的要求,将ABM进行改性处理,以提高抗酶解能力和维持力学性能的稳定,同时延长体内植入时间,观察材料植入体内后生物力学性能的变化,为该材料应用于盆底修复重建提供理论依据。
参考文献:
[1] 周逸丹,朱兰,郎景和.脱细胞组织工程补片在盆底修复手术中的应用[J].中国微创外科杂志,2011,11(7):652-654,658.
[2] Hodde J.Naturally occurring scaffolds for soft tissue repair and regeneration[J].Tissue Eng,2002,8(2):295-308.
[3] Badylak S,Meurling S,Chen M,et al.Resorbable bioscaffold for esophageal repair in a dog model[J].J Pediatr Surg,2000,35(7):1097-1103.
[4] Bolland F,Korossis S,Wilshaw SP,et al.Development and characterisation of a full-thickness acellular porcine bladder matrix for tissue engineering[J].Biomaterials,2007,28(6):1061-1070.
[5] Yang B,Zhang Y,Zhou L,et al.Development of a porcine bladder acellular matrix with well-preserved extracellular bioactive factors for tissue engineering[J].Tissue Eng Part C Methods,2010,16(5):1201-1211.
[6] Huffaker RK,Muir TW,Rao A,et al.Histologic response of porcine collagen-coated and uncoated polypropylene grafts in a rabbit vagina model[J].Am J Obstet Gynecol,2008,198(5):582.
[7] Birch C.The use of prosthetics in pelvic reconstructive surgery[J].Best Pract Res Clin Obstet Gynaecol,2005,19(6):979-991.
[8] Wu MP,Huang KH,Long CY,et al.The distribution of different surgical types for female stress urinary incontinence among patients′ age,surgeons′ specialties and hospital accreditations in Taiwan:a descriptive 10-year nationwide study[J].Int Urogynecol J Pelvic Floor Dysfunct,2008,19(12):1639-1646.
[9] Karlovsky ME,Kushner L,Badlani GH.Synthetic biomaterials for pelvic floor Reconstruction[J].Curr Urol Rep,2005,6(5):376-384.
[10] Badylak SF,Freytes DO,Gilbert TW.Extracellular matrix as a biological scaffold material:Structure and function[J].Acta Biomater,2009,5(1):1-13.
[11] CrapoPM,GilbertTW,BadylakSF.Anoverviewoftissueandwholeorgandecellularization
processes[J].Biomaterials,2011,32(12):3233-3243.
[12] 张真,卢晓风,李幼平,等.生物材料有效性和安全性评价的现状与趋势[J].生物医学工程学杂志,2002,19(1):117-121.
[13] Liu L,Li D,Wang Y,et al.Evaluation of the biocompatibility and mechanical properties of xenogeneic(porcine) extracellular matrix(ECM) scaffold for pelvic reconstruction[J].Int Urogynecol J,2011,22(2):221-227.
[14] Pierce LM,Rao A,Baumann SS,et al.Long-term histologic response to synthetic and biologic graft materials implanted in the vagina and abdomen of a rabbit model[J].Am J Obstet Gynecol,2009,200(5):546.

