环孢素A和他克莫司对1型糖尿病肾移植受者血糖的影响
钱 坤 ,欧阳新平 ,李建军 ,秦国庆 ,王 毅 ,罗志刚
(1.南华大学附属第二医院泌尿外科,湖南衡阳421001;2.南华大学医学院)
目前器官移植仍然处于免疫抑制剂时代,对排斥反应有效的抑制是肾移植成败的关键。免疫抑制剂的研发和临床应用是器官移植发展史上一个重要的里程碑,使肾移植成为目前治疗终末肾病的常用方法[1]。环孢素A(cyclosporin A,CsA)和他克莫司(tacrolimus,FK506)都是钙调神经蛋白酶抑制剂,是目前免疫抑制方案中的基础用药。CsA和FK506的副作用较多,如临床上较常见的肾移植术后糖尿病(post-transplantation diabetes mellitus,PTDM)。有研究报道,对于血糖异常的肾移植受者,术后使用CsA或FK506等免疫抑制剂,罹患PTDM的机率会增加[2]。1型糖尿病是导致终末肾病的主要病因之一,目前尚无CsA和FK506对1型糖尿病肾移植受者血糖影响的相关报导,也没有对于这类患者术后早期用药的系统研究。因此,本文通过研究CsA和FK506对1型糖尿病肾移植受者术后血糖的影响,为临床合理选择免疫抑制剂、实施个体化治疗提供参考,以避免或减轻免疫抑制剂引发的血糖进一步升高的副作用。
1 资料与方法
1.1 一般资料
选取本院2000~2012年肾移植受者40例,术前均需符合以下条件:①根据1型糖尿病诊断标准,可诊断为1型糖尿病;②用门冬胰岛素30R等胰岛素控制血糖至基本正常至少3个月;③无病毒性肝炎、酒精性肝炎等潜在的影响术后肝功能和血糖的危险因子;④无同种异体肾移植手术禁忌症;⑤均获得患者和家属同意并在知情同意书上签字。将入选的肾移植受者按随机列表分到平行的两个组别之一,即 CsA组和 FK506组。CsA组 20例,年龄40.4±5.4岁,其中男性12例,女性8例。FK506组20例,年龄43.2±6.1岁,其中男11例,女性9例。两组的年龄、性别构成、术前FBG和HbA1c水平、体质指数(BMI)等均具可比性(P>0.05)。本实验经本院医学伦理委员会批准。
1.2 治疗方法
各组受者在同种异体肾移植术后的降糖方案与术前相同,术后遵照糖尿病饮食方案。CsA组免疫抑制方案:CsA+MMF+Pred,FK506组免疫抑制方案:FK506+MMF+Pred。CsA的起始口服剂量为每天4 mg/kg,FK506的起始口服剂量为每天0.1 mg/kg,MMF起始口服剂量为每天20 mg/kg,Pred的口服剂量为低剂量,即5 mg/天。FK506和CsA的口服剂量根据血药浓度窗、非血糖相关副作用和肾功能进行调整,MMF根据血药浓度窗、肾功能及副作用进行调整。
1.3 观察指标
记录肾移植受者术前与肾移植术后第1、3、6个月的空腹血糖(FBG)和糖化血红蛋白(HbA1c)水平。全部对象空腹抽取静脉血2 mL,标本于采集后4 h内检测。采用葡萄糖氧化酶法检测FBG水平,采用亲和层析法检测HbA1c含量。
1.4 统计学处理
所有实验数据均以±s表示。两组间比较采用配对t检验(paired t-test),组内多样本的比较采用方差分析(ANOVA),计数资料采用χ2检验。以P<0.05为差异有统计学意义。
2 结 果
2.1 两组一般情况的比较
CsA组在治疗6个月内有3例受者退出,FK506组在治疗的6个月内有4例受者退出,退出原因有排斥反应(2例)、肺部感染(2例)、肝功能损害(1例)、糖尿病并发症(1例)和低血糖(1例)。故共有33例受者完成本研究,其中CsA组17例,FK506组16例。两组受者的年龄、性别构成、术前FBG和HbA1c、BMI无明显差异(P>0.05)(表1)。
2.2 CsA组血糖(FBG、HbA1c)与术后时间的关系
2.2.1 CsA组FBG水平与时间的关系 如图1所示,随着术后时间的延长,CsA组的FBG水平逐渐升高;术后第1个月和第3个月,CsA组的FBG水平与术前比较无显著差异(P>0.05);术后第6个月,CsA组的FBG水平与术前比较有显著升高(P<0.05)。
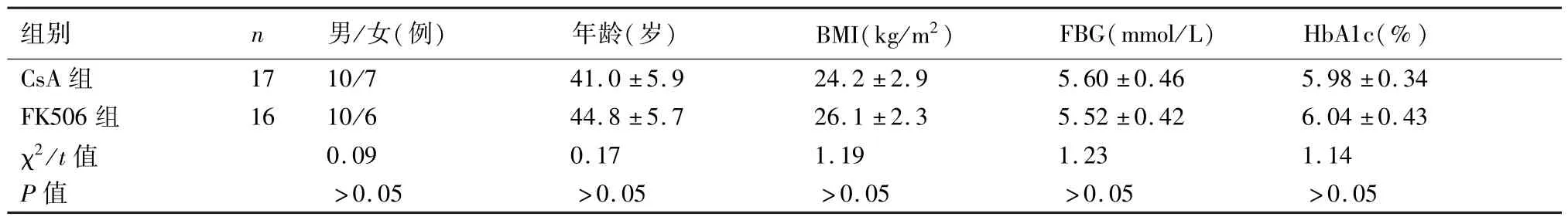
表1 CsA组和FK506组肾移植受者一般资料的比较
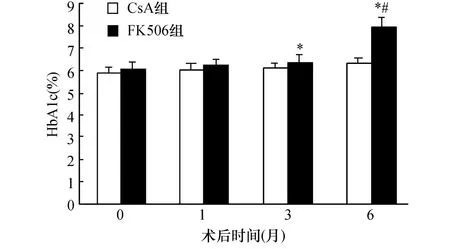
图1 术后各时间段FK506组和CsA组FBG水平的比较与同组0个月比较,*:P<0.05;与同时间点CsA组比较,#:P<0.05

图2 术后各时间段FK506组和CsA组HbA1c含量的比较 与同组0个月比较,*:P<0.05;与同时间点CsA组比较,#:P<0.05
2.2.2 CsA组HbA1c含量与术后时间的关系 如图2所示,随着术后时间的延长,CsA组的HbA1c含量逐渐升高,但与术前比较均无显著差异(P>0.05)。
2.3 FK506组血糖(FBG、HbA1c)与术后时间的关系
2.3.1 FK506组FBG水平与术后时间的关系 如图1所示,随着术后时间的延长,FK506组的FBG水平逐渐升高;术后第1个月,FK506组的FBG水平与术前比较无显著差异(P>0.05);术后第3个月和第6个月,FK506组的FBG水平与术前比较有显著升高(P<0.05)。
2.3.2 FK506组HbA1c含量与术后时间的关系如图2所示,随着术后时间的延长,FK506组的HbA1c含量逐渐升高;术后前3个月,FK506组的HbA1c水平与术前比较无显著差异(P>0.05);术后第6个月,FK506组的HbA1c水平与术前比较有显著升高(P<0.05)。
2.4 术后各时间段FK506组血糖(FBG、HbA1c)和CsA组的比较
2.4.1 术后不同时间段FK506组FBG水平和CsA组的比较 如图1所示,术前FK506组的FBG水平和CsA组比较无显著差异(P>0.05);术后第1个月,FK506组的FBG水平和CsA组比较无显著差别(P>0.05);术后第3个月和第6个月,FK506组的FBG水平比CsA组有显著升高(P<0.05)。
2.4.2 术后各时间段FK506组HbA1c含量和CsA组的比较 如图2所示,术前FK506组的HbA1c含量和CsA组比较无显著差异(P>0.05);术后第1个月和第3个月,FK506组的HbA1c含量和CsA组比较无显著差异(P>0.05);术后第6个月,FK506组的HbA1c含量比CsA组显著升高(P<0.05)。
3 讨 论
FK506和CsA是目前广泛使用的免疫抑制剂,均属于钙调神经蛋白酶抑制剂,它们进入细胞内首先与各自的结合蛋白结合形成复合体,这些复合体抑制钙调神经蛋白酶,下调IL-2、IFN-7等细胞因子的分泌和IL-2受体的表达,从而产生较强的免疫抑制作用[3]。其中FK506的药效强、使用剂量低、急性排斥反应发生率低、不良反应少,正在取代CsA成为器官移植后首选的免疫抑制剂[3],但其易导致PTDM发病率的增加[4-6]。FK506既可以通过抑制钙调神经蛋白酶下调胰岛β细胞的功能、数量,还可以诱发胰岛素抵抗[7-8],使大鼠血糖升高,这种升血糖的作用呈时间依赖性和浓度依赖性[9]。糖尿病分1型和2型糖尿病,1型糖尿病发病机制为胰岛β细胞破坏,导致胰岛素绝对缺乏;2型糖尿病发病机制为胰岛素抵抗,胰岛 β细胞功能缺陷。FK506引起PTDM的病理生理学机制更倾向于2型糖尿病,而calpain-10基因多态性可能是导致实体器官移植受者在使用FK506后发生PTDM易感性不同的原因之一[10]。同样是钙调神经蛋白酶抑制剂的CsA与FK506类似,通过下调胰岛β细胞的功能和数量,减少胰岛素分泌,使血糖升高[11]。
本研究以1型糖尿病肾移植受者为研究对象,将FBG和HbA1c作为血糖的观测指标,其中FBG为短期内血糖变化的观测指标,HbA1c为2~3个月的血糖变化的观测指标。术前用胰岛素将血糖控制至正常,各组血糖无显著差异,且术后降糖方案与术前相同。肾移植术后,CsA的起始口服剂量为每天4 mg/kg,FK506的起始口服剂量为每天0.1 mg/kg,MMF起始口服剂量为每天20 mg/kg;为减少激素升高血糖的累积效应,Pred的口服剂量为5 mg/天,是正常口服剂量的1/8~1/4。CsA、FK506和MMF的口服剂量根据血药浓度窗、肾功能等进行调整。本文观察到用CsA治疗的受者HbA1c在术后前6个月虽有升高,但与术前相比没有统计学差异,而HBG则在术后第6个月显著升高。FK506治疗的受者HBG从术后第3个月开始显著升高,这与滕雅芹等[8]报道的相似,但不清楚机制是否一样,而HbA1c则在术后第6个月显著升高。FK506治疗的受者FBG在术后第3和第6个月比CsA治疗的受者显著升高,而HbA1c在术后第6个月比CsA治疗的受者显著升高。以上观察结果进一步证明FK506升高血糖的副作用比CsA明显[12]。
综上所述,在肾移植术后早期,CsA和FK506可使1型糖尿病肾移植受者的血糖不同程度升高,其中FK506升高血糖的程度比CsA大。若将FK506用于1型糖尿病肾移植受者术后早期,如果出现血糖显著升高时,可考虑换用对血糖影响较小的免疫抑制剂如CsA,或者调整降糖方案,以期减少高血糖对肾移植受者靶器官的损伤,延长移植肾和受者的生存时间。
[1]Calmus Y,Pageaux G.Renal failure following liver transplantation[J].Presse Med,2009,38(9):1314-1318.
[2]Guerra G,Ilahe A,Ciancio G.Diabetes and kidney transplantation:past,present,and future[J].Curr Diab Rep,2012,12(5):597-603.
[3]Vicari-Christensen M,Repper S,Basile S,et al.Tacrolimus:review of pharmacokinetics,pharmacodynamics,and pharmacogenetics to facilitate practitioners'understanding and offer strategies for educating patients and promoting adherence[J].Prog Transplant,2009,19(3):277-284.
[4]Gosmanov AR,Dagogo-Jack S.Predicting,managing and preventing new-onset diabetes after transplantation[J].Minerva Endocrinol,2012,37(3):233-246.
[5]Israni AK,Snyder JJ,Skeans MA,et al.Clinical diagnosis of metabolic syndrome:predicting new-onset diabetes,coronary heart disease,and allograft failure late after kidney transplant[J].Transpl Int,2012,25(7):748-757.
[6]Xu X,Ling Q,He ZL,et al.Post-transplant diabetes mellitus in liver transplantation:Hangzhou experience[J].Hepatobiliary Pancreat Dis Int,2008,7(5):465-470.
[7]Li QY,Li F,Sun JH,et al.Mechanisms of diabetes mellitus induced with FK506 in SD rats models[J].Immunopharmacol Immunotoxicol,2009,31(4):675-681.
[8]滕雅芹,牛玉坚,徐春,等.他克莫司对大鼠血糖的影响及其作用机制[J].中国实验动报,2012,20(2):74-77.
[9]姚烨,邢同海,郭文城,等.钙调磷酸酶抑制剂引起移植术后糖尿病的分子机制[J].现代生物医学进展,2010,12(10):27-30.
[10]王波,田慧,巴建明,等.他克莫司引起继发性糖尿病的临床转归和药学监护[J].中国药物应用与监测2011,17(1):26-29.
[11]Choi JY,Kwon OJ.Post-transplant diabetes mellitus:is it associated with poor allograft outcomes in renal transplants[J].Transplant Proc,2013,45(8):2892-2898.
[12]安军,徐春,牛玉坚,等.他克莫司和环孢素A对大鼠升血糖作用的比较[J].武警医学,2012,21(9):82-84.

