老年犬认知障碍综合征的治疗
陈姗姗,陈江楠,孙艳争,夏兆飞
(中国农业大学动物医学院,北京 海淀100193)
犬的认知障碍综合征(cognitive dysfunction symptom,CDS)是指犬随着年龄增大,在一段时间(18~24月龄或更长)内,发生记忆、学习、感觉、意识等认知能力下降[1-2],主要表现为迷失方向,与主人互动减少和睡眠规律改变等,这会对犬及其主人的生活造成不利影响。本文简略介绍了犬的CDS研究进展,并重点论述治疗的有关内容。
1 流行病学
有关该病的发病率,各个调查的结果不太一致。目前,犬CDS公认的风险因素是年龄,Nielson等人[3]在美国的调查发现,28%的11~12岁犬至少有一项认知障碍的症状,68%的15~16岁犬至少有一项认知障碍的症状。有机构针对7岁以上犬的调查发现,75%的犬至少有一种认知障碍症状,但仅有12%的主人会向兽医师报告行为问题,可见人们对该病缺乏认识[4]。同时,由于诊断的困难,其发病率还可能更高。一项样本主要来自澳大利亚的调查估计CDS发病率为14.2%,但是兽医师的临床诊断率仅为1.9%[5]。
2 症状
CDS主要引起犬行为改变,表现在5个方面,包括社交行为改变,室内如厕习惯改变,迷失方向,睡醒周期改变,以及活动量的变化[4]。于是,就有了“DISHA”这一缩写,“D”代表“迷失方向(disorienta⁃tion)”;“I”代表“社交行为(social interaction)”;“S”代表“睡醒周期(sleep-weak cycle)”;“H”代表“室内如厕(house-soiling)”;“A”代表“活动量(activity)”[6]。它可用于鉴定宠物衰老后,与认知障碍有关的行为改变。但是,“DISHA”并不涵盖认知障碍的所有症状,其他症状还包括对外界刺激敏感性增强,过度鸣叫,分离焦虑,学习能力和任务完成能力下降等。
3 发病机制
由于犬CDS与阿尔海默茨氏综合征(Alzheim⁃er′s disease,AD)病人的神经病变十分相似,所以犬的CDS是研究人AD的良好模型。这些病变与认知能力的衰退联系密切,但是具体发病机制还有待进一步研究。
3.1 病理变化 CDS患犬头部形态学变化包括脑体积变小(大脑和基底神经节的萎缩),脑室体积增大,血管周隙增大。犬的脑前叶早在8岁就可能发生萎缩[4]。神经病理学方面最特征的变化包括神经元缺失,脑膜钙化增厚,弥散性斑块(plaque)形成,以及β-淀粉样蛋白沉积(β-amyloid,Aβ)[2,7]。其中,β-淀粉样蛋白沉积是最早出现的神经病变,是犬大脑衰老的标记。犬的大脑灰质从8岁开始就出现淀粉样沉积,最先开始于前额皮质,之后逐渐分布到顶叶和嗅内区,最后到枕叶[4]。这些区域的Aβ斑块可能是导致神经元和神经胶质细胞病变的原因,并导致犬认知能力逐渐下降,且其严重程度与认知障碍程度呈正比。传统观点认为[8],神经元细胞膜上的淀粉样蛋白前体蛋白(amyloid precursor protein,APP)主要通过两种途径降解,即α分泌酶途径和β分泌酶途径。前一途径不会生成淀粉样蛋白,后一途径经β、γ分泌酶依次切割生成β-淀粉样肽,并逐渐聚集,是斑块的主要成分。Aβ具有较强的神经毒性,导致神经元功能受损,突触退化,神经元减少,神经递质耗竭等。
3.2 氧化损伤 有许多研究发现,老年动物的认知障碍与大脑的氧化损伤之间有密切联系。细胞内90%以上的活性氧是在线粒体产能过程中生成的,而随着线粒体的衰老,其产能效率下降,同时生成更多的氧化产物,而清除氧化产物的机制又受到衰老、疾病等因素的破坏,使得氧化产物过度累积,从而对核酸、脂质、蛋白质产生有害作用。脑组织由于需氧量大,脂质含量高,修复能力有限,故特别容易受到氧化应激的损伤;此外,氧化损伤也会促进APP生成Aβ,导致神经细胞功能障碍和死亡。
4 诊断
对犬CDS的诊断主要包括病史、体格检查、实验室检验、问卷筛查。由于目前并没有特异性的诊断方法,所以对该病的诊断需要通过详尽的问诊和检查,排除其他所有可能引起现有行为问题的疾病后,对照认知障碍的有关症状,才可诊断为该病。正是由于这一过程的繁琐,人们也在不断探索犬CDS的诊断方法。
在许多调查中[1,4,9-11],学者们利用问卷对犬认知障碍进行筛查。但是,这种问卷评估完全依赖主人的意识,难免有所偏差。而在实验室中,可利用专业设备进行行为试验以评估犬的认知能力,如地标识别试验、异物识别试验、空间记忆试验等。也有学者改善曾用于评估大鼠的空间学习和记忆能力的试验应用于犬[12],这一试验不需专业设备,便于兽医师和主人自评。然而,这些行为试验所需时间较长,尤其是较为复杂的试验。
另外,应用核磁共振成像(MRI)技术可直接观察大脑的可疑病变[9];脑脊液(CSF)分析可作为中枢神经系统活动性的指标[9]。
5 治疗
首先应该治疗任何潜在疾病,例如肾衰等老年犬常见病。其次,虽然许多老年病是无法治愈的,但是我们可以通过各种手段减缓疾病的发展,或者控制临床症状的恶化。尤其对于犬CDS,应结合环境、行为、药物和营养,从多方面加以控制。
5.1 环境与行为调整 不良的环境或环境的突然变化,会引起行为问题甚至加重行为问题。例如日常规律突然改变,出现新的家庭成员(婴儿或宠物)、搬家等,都会对犬产生刺激。此外,主人的态度对宠物的影响非常大。当犬出现行为问题,比如室内随地便溺后,主人的打骂反而会让犬感到更紧张,加重其行为问题。因此,主人应该积极改善不良环境,为犬备好温暖舒适的生活空间,保持稳定的日常规律,细心耐心地照顾并引导,或者在专业训犬师的指导下进行行为调整。
有许多研究都表明,通过训练、玩耍、锻炼等方式丰富犬的日常生活,不断地给予大脑新的刺激,有助于维持犬的认知能力。而且,充足的活动也有助于重建正常的睡醒周期。有一项针对饮食和环境刺激对老年犬认知能力影响的研究发现,在2年的试验周期之后,对照组犬(既无营养控制也无环境刺激)认知能力显著降低,进行营养控制的犬或给予环境刺激的犬在行为试验中表现较好,而同时进行营养控制和环境刺激的犬表现最好[13]。另一项研究发现[14],进行营养控制,或者结合营养和环境刺激,都能减少大脑中可溶性Aβ的量,而仅仅给予环境刺激,对Aβ的分布并无显著影响。这些研究都表明,多方面的治疗手段对缓解老龄犬神经病变,改善认知能力有很重要的意义。
5.2 药物治疗 目前,北美仅批准了一种用于治疗犬CDS的药物,即“司来吉兰(seligiline)”。它是一种单胺氧化酶B(MAOB)抑制剂,能提高脑中2-苯乙胺的浓度,增强多巴胺和儿茶酚胺的功能,可能还有抗氧化的作用,80%以上的犬在服用一个月后症状好转,但症状严重患犬效果不明显,并且不能阻止疾病继续发展。同时应该注意,司来吉兰不能与麻醉药、抗抑郁药、单胺氧化酶抑制剂同用。

表1 已注册的3种用于治疗犬认知障碍综合征的药物用量[2]
欧洲一些国家批准了两种用于治疗犬CDS的药物,即“丙戊茶碱(propentofylline)”和“麦角溴烟酯(nicergoline)”。前者为黄嘌呤衍生物,能在提高大脑氧气供应的同时不增加葡萄糖的需求,同时能抑制血小板聚集和血栓形成,抑制炎症和小胶质细胞过度活化,减少氧自由基的生成。后者为麦角灵衍生物,可作为α1、α2受体激动药,提高脑部血流量,保护神经元,抑制血小板聚集,清除氧自由基,提高食欲等。
另外,当发现Aβ斑块与认知能力的损害密切相关之后,人们就猜想也许阻止Aβ的生成和清除Aβ斑块是彻底治疗Aβ的方法,于是就开始研发相关疫苗。例如,有研究对试验犬和家养犬进行免疫疗法,2个月后,受治疗犬的认知能力显著并稳定提升[9]。但也有为期2年的免疫治疗无明显效果[15]。犬CDS疫苗的研发尚未成熟。
5.3 营养控制 老年犬由于各器官功能衰退,对药物的吸收、转化、代谢能力均下降,所以,相比于传统的药物治疗,营养控制是更加安全的方法。主要应用抗氧化剂减轻氧化损伤,以及其他一些物质保护神经细胞,增强神经细胞功能。
5.3.1 抗氧化剂和线粒体辅因子 目前,抗氧化剂在各种老年犬粮和CDS处方粮中得到广泛应用。来源于食物的抗氧化物有维生素E、维生素C、微量元素、黄酮类、类胡萝卜素类等,它们能减少氧化产物的生成,提高机体清除氧化产物的能力,以降低氧化产物对脑组织的损伤。相比于单独使用一种抗氧化剂,各种抗氧化剂的混合物效果更好。有研究在食物中添加维生素E、蔬菜、水果后,能延缓由于衰老导致的认知能力下降[13]。又有研究添加抗氧化剂的日粮使颅顶部和内嗅皮质的Aβ减少,但前额部无变化[4]。这种食物可能会提高α-分泌酶的活性,促使APP正常降解而不产生Aβ,表明含抗氧化剂的食物能够预防并减少Aβ沉积,但不能使已存在的消失(前额部无变化),所以更应尽早进行饮食干预。
L-肉毒碱和α-硫辛酸是线粒体辅因子,它们能抑制线粒体衰老的生物标记,提高线粒体功能,减少氧化产物的生成。L-肉毒碱参与脂肪在线粒体内的代谢。α-硫辛酸参与氧化还原反应,能提高谷胱甘肽的浓度,且具有很强的抗氧化作用。有研究参考人的类似试验和剂量,给老年犬的食物中添加乙酰-L-肉毒碱和α-硫辛酸粉末2个月后,在地标识别试验中的表现显著改善[16]。另一项研究在食物中同时添加抗氧化剂和线粒体辅因子后,进行异物识别试验,青年犬试验组和对照组无显著差别,老年犬试验组显著优于对照组[17]。
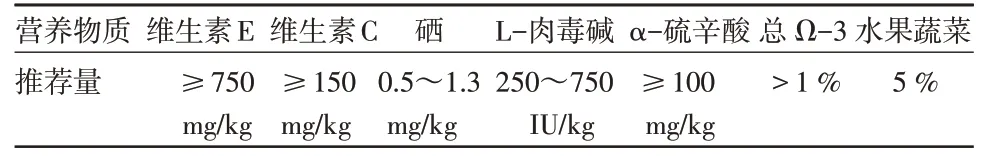
表2 对认知障碍患犬主要营养物质的推荐量 (干粮)[4]
5.3.2 中链脂肪酸(medium-chain triglycerides,MCT)
CDS患犬的脑组织中,葡萄糖代谢显著降低,原先仅有轻微临床症状的老年犬,在出现明显认知障碍症状之前,就发生大脑葡萄糖代谢下降[18]。酮体是脑组织可利用的另一种能量物质。但是在正常情况下,机体只会在缺乏可利用的糖原时才会动用储存的脂肪来供能,所以,为了产生更多的酮体供脑组织利用,就必须限制日粮中碳水化合物和蛋白质的含量,这么做是存在一定风险的。而MCT与长链脂肪酸(long-chain fatty acids,LCFA)的代谢途径不同,它直接由门静脉进入肝脏,并且直接氧化产能而不储存,所以不需要限制日粮中碳水化合物和蛋白质的含量。另外,它的代谢速率快,能迅速地生成酮体。但是,因为必需脂肪酸均为LCFA,所以不能用MCT完全替代LCFA。一项研究在对照组日粮的基础上调整试验组日粮,使其含有5.5%MCT,饲喂老年犬240 d,犬在3项认知试验中的表现均明显提升,期间血酮浓度升高且在安全范围内[19]。
5.3.3 磷脂酰丝氨酸(phosphatidylserine,PS) PS是脑组织浆膜的主要成分,占脑组织总磷脂的10%~20%。它对于神经细胞的保护作用主要表现在对胞膜的影响[7]。由于Aβ会沉积于胞膜上,PS则有助于维护细胞膜流动性,维持细胞膜的完整性,这是神经细胞能正常发挥功能的先决条件。同时它还具有促进神经递质合成以及信号转导等作用。PS最早是从犊牛脑组织中获得的,但是这种方式有潜在的致病风险,而且提取量较低,故现在均用豆类或葵花籽油生产合成PS。目前市场上已有多种相关商品,有的产品还同时含有抗氧化剂、线粒体辅因子和Ω-3脂肪酸。利用某种产品作为营养补充剂的试验中,老年犬的社交问题和室内如厕问题均有明显改善[20]。
5.3.4 支链氨基酸(branched-chain amino acids,BCAA)曾有研究表明,运动员在运动前或运动期间服用含BCAA的饮料,可提高其在复杂的认知测试中的表现。于是有学者将这种饮料(缬氨酸40%、亮氨酸35%、异亮氨酸25%)应用于老年犬后,使其在运动中的认知能力得到改善[21]。
6 总结
随着宠物生活质量的提高和医疗水平的发展,其寿命也在不断增长,越来越多的宠物犬进入老年期,面临认知障碍综合征的机率则越来越大。尽管目前对这一疾病的研究尚未透彻,诊断与治疗手段也有限,但我们应该利用现有条件从多方面积极控制疾病,秉持细心与耐心,照顾好宠物犬生命的最后阶段。
[1] Hoskins JD.Geriatrics&Gerontology of the Dog and Cat[M].2nd Edition USA:Saunders,2004.
[2] Landsberg B,Araujo JA.Behavior Problems in Geriatric Pets[J].Veterinary Clinicssmallanimal pratice,2005(35):675-698.
[3] Nielson JC,Hart B L,Cliff K D,et al.Prevalence of behavioral changesassociated with age-related cognitive impairment in dogs[J].JAm VetMed Assoc,2001,218(11):1787-1791.
[4] Hand M S,Thatcher C K,Remillard R L,et al.Small Animal Clinical Nutriton[M].5th Edition.The Markmorris Institute,2010.
[5] Salvin H E,Mcgreevy PD,Sachdev PS,etal.Under diagnosisof canine cognitive dysfunction:A cross-sectional survey of older companion dogs[J].The Veterinary Journal,2010(184):277-281.
[6] Manteca X.Nutrition and Behavior in Senior Dogs[J].Topics in Companion AnimalMedicine,2011(26):33-36.
[7] Osella M C,Re G,Badino P,et al.Phosphatidylserine(PS)as a potential nutraceutical for canine brain aging:A review[J].Jour⁃nal of Veterinary Behavior,2008(3):41-51.
[8] 张弦,许华曦,张云武.β-淀粉样蛋白前体蛋白胞内结构域(AICD)研究进展[J].生命科学,2008,20(2):159-164.
[9] Bosch M N,Pugliese M,Gimeno-Bayón J,etal.Dogswith Cog⁃nitive Dysfunction Syndrome:A Natural Model of Alzheimer′s Disease[J].Current Alzheimer Research,2012(9):298-314.
[10] Azkona G,Garcia-Belengue S,Chacon G,et al.Prevalence and risk factors of behavioural changes associated with age-related cognitive impairment in geriatric dogs[J].Journal of Small Ani⁃mal Practice,2009(50):87-91.
[11] Salvin H E,McGreevy PD,Sachdev PS,etal.The canine cognitive dysfunction rating scale(CCDR):A data-driven and ecologically relevantassessment tool[J].The Veterinary Journal,2011(188):331-336.
[12] Nagasawa M,Yatsuzuka A,Mogi K,et al.A new behavioral test for detecting decline of age-related cognitive ability in dogs[J].Journal of Veterinary Behavior,2012(7):220-224.
[13] Milgram NW,Head E A,Zicker SC,et al.Long term treatment with antioxidants and a program of behavioral enrichment reduc⁃es age-dependent impairment in discrimination and reversal learning in beagle dogs[J].Exp Gerontol,2004,39(5):753-765.
[14] Pop V,Head E,Hill M A,et al.Synergistic Effects of Long-Term Antioxidant Diet and Behavioral Enrichment on Amyloid Load and Non-Amyloidogenic Processing in Aged Canines[J].The Journalof Neuroscience,2010,30(29):9831-9839.
[15] Head E,Pop V,Vasilevko V,et al.A Two-Year Study with fi⁃brillar beta-Amyloid(A-beta)Immunization in Aged Canines:Effects on Cognitive Function and Brain A{beta}[J].JNeurosci,2008,28(14):3555-3566.
[16] Milgram NW,Araujo JA,Hagen TM,etal.Acetyl-L-carnitine and lipoic acid supplementation of aged beagle dogs improves,,learning in two landmark discrimination tests[J].The FASEB Journal,2007(21):3756-3762.
[17] Cotman CW,Head E,Muggenburg B A,et al.Brain aging in the canine:a dietenriched in antioxidants reduces cognitive dys⁃function[J].Neurobiology of Aging,2002(23):809-818.
[18] Blass JP,Gibson G E,Hoyer S.The role of themetabolic lesion in Alzheimer′s disease[J].JAlzheimers Dis,2002(4):225-232.
[19] Pan Y.Enhancing Brain Functions in Senior Dogs:A New Nutri⁃tional Approach[J].Topics in Companion AnimalMedicine,2011(26):10-16.
[20] Heath SE,Barabas S,Craze PG.Nutritional supplementation in cases of canine cognitive dysfunctiond a clinical trial[J].Ap⁃plAnim Behav Sci,2007(105):284-296.
[21]Fretwell L K,McCune S,Fone JV,et al.The Effect of Supple⁃mentation with Branched-Chain Amino Acids on Cognitive Function in Active Dogs[J].JNutr,2006(136):2069S-2071S.

