清瘟败毒散对肉鸡耐药金黄色葡萄球菌的抑菌作用
耿梅英,苑方重,杨 倩,钟秀会
(河北农业大学动物医学院,河北 保定071000)
金黄色葡萄球菌(SA)是一种广泛存在于自然界的病原菌,人及多种动物均能感染发病,其中对肉鸡危害较为严重[1-2]。肉鸡发病后,临床表现为急性败血症、坏死性皮炎、关节炎、雏鸡脐炎、全眼球炎和骨膜炎,其中30~40日龄肉鸡发病最多,每年给养殖业造成巨大经济损失[1]。SA还可以产生多种引起急性胃肠炎的肠毒素(Staphylococcal en⁃terotoxins,SEs),包括A-E,F,G-I,R-T等20多种类型,可以引起机体中毒[3-6];其中,SEA、SEB型可以结合MHCⅡ型抗原递呈细胞,并激活T细胞,是最典型的肠毒素,被称为超级抗原[6]。
相对于抗生素,中药方剂具有低药残留、无公害、不易耐药等优点,可作为肉鸡葡萄球菌病治疗的首要选择。很多研究表明,黄连、金银花、连翘等中药有良好的抗菌作用。本试验选用清瘟败毒散作为基本方剂进行加减,以黄连、金银花、连翘等抗菌中药为主药,配伍丹皮、黄芩、甘草等中药,辨证组方,用于治疗肉鸡葡萄球菌病的研究。
1 材料与方法
1.1 菌株与材料 金黄色葡萄球菌标准菌株ATCC25923(中国医学微生物菌种保藏管理中心);临床分离株S.aureus,分离自河北某地几家肉鸡养殖场,经却甫曼培养基纯化培养,及生化试验鉴定后保存应用(图1纯化培养的金黄色葡萄球菌)。Bradford蛋白定量试剂盒,购自北京研和翔试剂公司;SEA,SEB抗体,购自Sigma公司。0.22μm滤膜由北京卓信伟业科技有限公司供应。中药黄连、金银花、连翘等,购自保定万宝堂药房,组成试验方剂,合并后采用水煎浓缩方法,药物最终浓度为1 g/mL生药,试验用单味中药采用同样方法制备。
1.2 常用抗菌药物耐药性试验 将金黄色葡萄球菌标准株与分离株分别接种于普通平板培养基,选择链霉素、青霉素G、氨苄青霉素、阿莫西林、林可霉素、卡那霉素、恩诺沙星、四环素等8种常用抗菌药物的药敏纸片,进行药物敏感性试验,参考美国抗微生物药物敏感性判断标准CLSI[7-8],判断药物对试验菌株的抑菌效果。
1.3 中药敏感性试验及MIC 试验中使用清瘟败毒散提取液,及组成该方的主要药物黄连、金银花、连翘、甘草、丹皮分别制成单药提取液。将细菌接种于普通营养琼脂培养基,采用挖洞注药法做药物平板抑菌试验。在已接种细菌的培养基上均匀打孔,将药注满孔,在4℃条件下放置2 h,然后于37℃培养24 h,使用卡尺测药物对该细菌抑菌环直径的大小,以确定药物对细菌的作用效果。
利用普通试管,做营养肉汤培养基,将清瘟败毒散提取液及单味中药提取液,均采用等比稀释的方法,做成浓度系列。浓度范围是1 g/mL~2-10g/mL生药,加入营养肉汤中,同时接种细菌,以不加药物的作空白对比,在37℃下培养24 h,观察含有药物的肉汤中细菌的生长情况,确定药物对细菌的最小抑菌浓度(MIC),判断标准参照CLSI标准M27-A3[8]。
1.4 清瘟败毒散对S.aureus肠毒素生成的影响
根据MIC试验结果,在接种试验菌株的LB培养基中MIC浓度的清瘟败毒散方剂提取液,并进行倍比稀释,以不添加药液的培养基做对照,37℃下培养24 h,收集各培养基菌液上清,取20μL,采用Western blot方法测定菌液中S.aureus肠毒素SEA、SEB。
2 结果
2.1 细菌耐药试验 参照标准,抑菌环直径大于20mm为超敏;抑菌圈直径在15mm~20mm,表现为高敏;抑菌圈直径在10mm~14mm,表现为中敏;抑菌圈直径小于10mm,表现为低敏;无明显的抑菌圈,表现为耐药。各分离株SA及标准株耐药状况如表1所示。临床分离的菌株林可霉素敏感性较高,对链霉素与四环素的耐受性普遍较强,其中大部分菌株出现耐药,药敏试验没有出现抑菌环;同时,各分离菌株对卡那霉素与氨苄青霉素敏感性较低,并且有菌株表现耐药;其他药物反应多表现中等程度的敏感。试验结果同时显示,临床分离的SA对常用抗菌药物敏感性差异较大。其中,编号SA9-7菌株对多种药物明显耐药。试验中,我们选择SA9-7做中药抑菌试验。
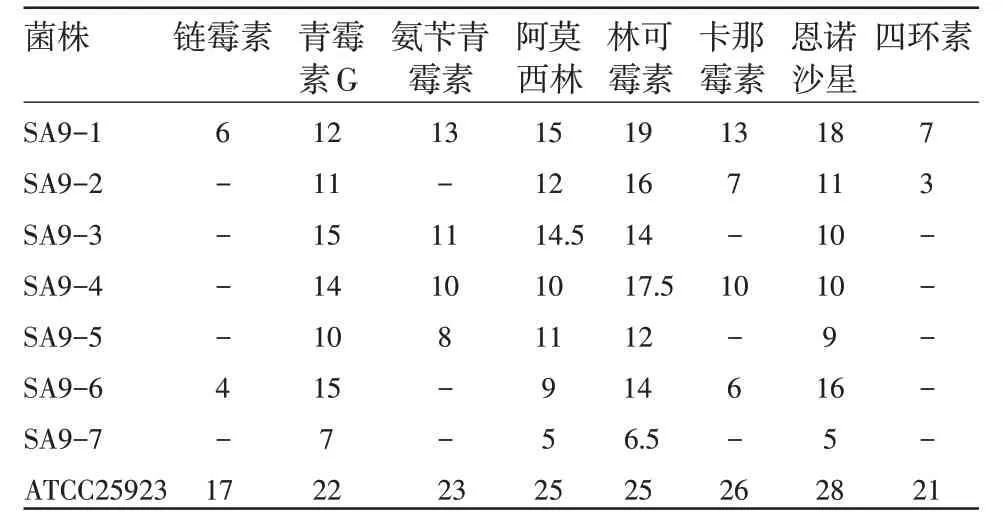
表1 金黄色葡萄球菌耐药性分析(抑菌环直径=mm)
2.2 中药敏感性试验及MIC 中药方剂清瘟败毒散及组成方剂的部分单味中药对临床分离菌株SA9-7及标准株ATCC25923的抑菌效果见表2。

表2 中药对SA9-7及ATCC25923抑菌(抑菌环直径=mm)
试验结果显示,清瘟败毒散提取液对临床分离的金黄色葡萄球菌SA9-7株具有良好的抑制作用。尽管该菌对常用抗菌药物有较强的耐药性,但对纯中药方剂清瘟败毒散的敏感性较高。同时,在组成中药方剂的单味中药中,黄连、金银花、连翘对SA9-7的抑制作用也比较明显;而丹皮、甘草在单独使用时对该菌没有明显效果。同时,试验方剂的抑菌作用显著好于单味中药。方剂及单味中药对SA9-7的抑制效果见图1。
对于药物最小抑菌浓度(MIC)的判断,按照CLSI标准M27-A3。结果显示,试验方剂清瘟败毒散提取液对SA9-7的MIC为0.016 g/mL,黄连单味药物对该菌的MIC为0.063 g/mL,其他金银花、连翘、丹皮和甘草依次为:0.063 g/mL、0.250 g/mL和0.125 g/mL。此外,试验中药方剂对ATCC25923的MIC为0.008 g/mL。
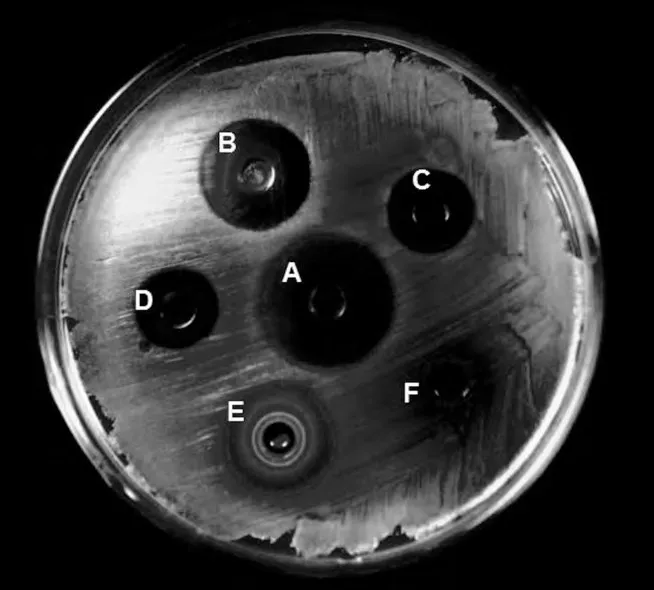
图1 方剂及单味中药对SA9-7的抑制效果
2.3 清瘟败毒散对S.aureus肠毒素生成的影响
从临床分离的金黄色葡萄球菌,约1/3可以产生肠毒素。肠毒素是一种可溶性蛋白质,耐热,经100℃煮沸30min不被破坏,也不受胰蛋白酶的影响[9],是造成畜产品包括鸡肉等污染的主要因素,也是金黄色葡萄球菌的主要毒力评价因子之一[3],其中SEA、SEB型通常被认为是S.aureus肠毒素的标志性类型。试验中,应用特异性抗体检测不同中药浓度下,临床分离株SA9-7肠毒素SEA、SEB的生成。结果如图2显示,在有S.aureus生长的情况下,中药清瘟败毒散提取液可以显著抑制SEA与SEB的生成,并且其作用强度与药物的浓度密切相关。
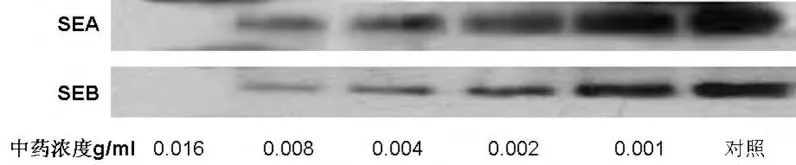
图2清瘟败毒散对S.aureus肠毒素的抑制作用
3 讨论
本试验表明,自肉鸡养殖场临床分离的S.au⁃reus菌株,对多种常用抗菌药物的敏感性不高,有不少的菌株对四环素、青霉素、氨苄青霉素、卡那霉素等药物表现出明显的耐药性。在当前情况下,很多养殖场肉鸡感染S.aureus后,普遍存在治疗困难,大剂量合并使用抗菌药物,是通常采用的主要方法之一,同时又是造成S.aureus耐药的原因之一。试验中,临床分离的菌株SA9-7,对本试验选择的8种药物均不敏感,并对其中4种药物表现为耐药,而这种广谱耐药菌株的出现,对该病的治疗构成了严重挑战。
相对于抗生素,中药方剂具有低药残留、无公害、不易耐药等优点,可作为肉鸡葡萄球菌病治疗的首要选择。很多研究表明,黄连、金银花、连翘等中药有良好的抗菌作用。本试验选用的中药方剂清瘟败毒散,根据中兽医理论,以黄连、金银花、连翘等抗菌中药为主药,配伍丹皮、黄芩、甘草等中药组成,并通过水浸水煎,制成中药提取液。试验结果显示,清瘟败毒散提取液对临床分离的金黄色葡萄球菌SA9-7株具有良好的抑制作用,对SA9-7的MIC为0.016 g/mL;同时,药物可以显著抑制S.aureus肠毒素SEA、SEB的生成。本试验探讨了中药治疗肉鸡葡萄球菌病的可能性,为防治禽葡萄球菌病提供了技术支持。
[1] 张艳英,关学敏,孙继国,等.肉仔鸡葡萄球菌病的诊治[J].中国家禽,2007,29(21):48-49.
[2]马驰,林居纯,陈雅莉,等.禽源金黄色葡萄球菌耐药性监测[J].中国兽医杂志,2010,46(9):10-12.
[3]Argudín MÁ,Mendoza M C,Rodicio M R.Food poisoning and Staphylococcus aureus enterotoxins[J].Toxins,2010,2(7):1751-1773.
[4]Cao R,ZeakiN,Wallin-CarlquistN,etal.Elevated enterotoxin A expression and formation in Staphylococcus aureus and its associa⁃tion with prophage induction[J].Applied and environmentalmicro⁃biology,2012,78(14):4942-4948.
[5]Pepe O,Blaiotta G,Bucci F,et al.Staphylococcus aureus and staphylococcal enterotoxin A in breaded chicken products:detec⁃tion and behavior during the cooking process[J].Applied and envi⁃ronmentalmicrobiology,2006,72(11):7057-7062.
[6]Pinchuk IV,Beswick E J,Reyes V E.Staphylococcal enterotoxins[J].Toxins,2010,2(8):2177-2197.
[7]PfallerMA,Boyken L,HollisR J,etal.Wild-typeMICdistributions and epidemiological cutoffvalues for the echinocandinsand Candida spp[J].Journal of clinicalmicrobiology,2010,48(1):52-56.
[8]Ranque S,Lachaud L,Gari-ToussaintM,et al.Interlaboratory Re⁃producibility of Etest Amphotericin B and Caspofungin Yeast Sus⁃ceptibility Testing and Comparison with the CLSIMethod[J].Jour⁃nal of clinicalmicrobiology,2012,50(7):2305-2309.
[9] Pereira V,Lopes C,Castro A,etal.Characterization for enterotox⁃in production,virulence factors,and antibiotic susceptibility of<i>Staphylococcus aureus isolates from various foods in Portugal[J].Food Microbiology,2009,26(3):278-282.

