广东1株H 3N 2亚型犬流感病毒的分离与鉴定
赵明喜,赖芳芳,贾 坤,李华涛,李守军
(华南农业大学兽医学院,广东 广州510642)
A型流感病毒属于正黏病毒科的成员,是具有高度传染性的流感病原体之一,多种动物包括鸟类、哺乳动物和人类都对其易感[1]。A型流感病毒感染在家畜中研究广泛,但在伴侣动物如犬猫中研究较少,伴侣动物与人类和家畜接触紧密,因此,研究A型流感病毒感染伴侣动物具有更重要的兽医学和公共卫生学意义[2]。犬猫本不是流感病毒的易感动物,但目前研究表明,犬猫在自然和试验条件下对一些亚型的流感病毒易感,H3N8亚型犬流感病毒(CIV)和H3N2亚型CIV在美国和韩国已引起严重的经济损失[3-5]。
2006年,中国广东首次分离到禽源H3N2亚型CIV,该病毒引起犬发生咳嗽、喷嚏、脓鼻涕、低热等症状[6]。2009年-2010年,浙江、江苏、北京、辽宁等地也先后分离到H3N2亚型CIV[7-8],CIV已在沿海地区广泛存在,应引起研究人员的高度重视。本文从1只疑似病犬中分离到1株H3N2亚型CIV,并对其进行研究,以期为华南地区CI的检测和防控提供依据。
1 材料与方法
1.1 材料
1.1.1 病例来源 2011年12月,从外院转诊到华南农业大学动物医院病犬,4月龄,前夜呕吐,呕吐物为绿色液体,次日腹泻物呈泥状,腹泻次数多,精神沉郁,食欲废绝,体温40℃,可视黏膜苍白。
1.1.2 主要试剂 病毒RNA提取试剂盒和胶回收试剂盒(均购自OMEGA公司);病毒DNA提取试剂盒(购自天根生化科技(北京)有限公司);M-MLV反转录酶、RNA酶抑制剂、dNTPs和Taq DNA聚合酶(均购自TaKaRa公司)。
1.2 病原分离和鉴定
1.2.1 引物设计与合成 应用DNAStar(Version 5.07)及Primer Premier(Version 5.0)基因分析软件,对GenBank收录的多个犬瘟热病毒(CDV)、犬细小病毒(CPV)、H3N2亚型CIV的基因序列分别进行比较,CDV和CPV各设计1对鉴定引物,CIV设计11对扩增8个基因片段的引物,其中PA、PB1和PB2分两段设计。引物由上海英潍捷基公司合成。
1.2.2 病毒核酸的提取 采集病犬鼻咽、肛门拭子和呕吐物,加入适量生理盐水稀释,12 000 r/min离心10min,取上清。根据病毒DNA提取试剂盒说明书提取肛门拭子和呕吐物上清中的DNA。将鼻咽拭子上清经双抗处理后接种9日龄~11日龄SPF鸡胚,0.2mL/枚,无菌收集96 h后未死亡的鸡胚尿囊液,应用1%鸡红细胞进行血凝试验。根据病毒RNA提取试剂盒说明书分别提取鼻咽拭子上清和有血凝活性的鸡胚尿囊液中的病毒全基因组。
1.2.3 病原的PCR鉴定 首先,将提取的肛门拭子和呕吐物上清中的DNA,用CPV特异性引物进行PCR扩增。其次,将提取的鼻咽拭子上清和鸡胚尿囊液中的病毒基因组RNA,分别用CDV,CIV特异性引物进行RT-PCR扩增。PCR扩增的条件如下:94℃5min;94℃30 s,53℃30 s,72℃60 s,33个循环;72℃10min。用1%琼脂糖凝胶电泳分析扩增效果。
1.2.4 血凝(HA)试验及血凝抑制(HI)试验 将收集的鸡胚尿囊液参照国标方法(国标号:GB/T 14926.53-2001)进行HA试验,将具有血凝活性的鸡胚尿囊液作为被检抗原,应用H1、H3、H5、H7、H9亚型标准阳性血清和阴性血清,参照国标方法(国标号:GB/T 14926.54-2001)进行HI试验。
1.2.5 分子序列同源性及系统进化分析 用胶回收试剂盒分别回收HA和NA基因PCR产物,然后将回收产物克隆到pMD18-T载体上,转化E.coli DH5α细胞内,筛选阳性克隆后送往上海英潍捷基公司测序。将测序的结果用BLAST(http://blast.nc⁃bi.nlm.nih.gov/Blast.cgi)进行同源性检索,用clustalx 2.0进行多序列比对,用Mega 5.0构建系统进化树。
2 结果
2.1 病毒的PCR鉴定 用CDV和CPV的特异性引物分别进行PCR,均未扩增出目的条带。但用CIV M基因特异性引物进行RT-PCR,可见1 000 bp大小的特异性条带,与预期(1 027 bp)相符(图1)。
2.2 HA试验及HI试验 收集的鸡胚尿囊液对1%鸡红细胞的HA效价为26,该血凝性能被H3亚型流感病毒阳性血清中和,与H1、H5、H7、H9亚型阳性血清和阴性血清无交叉反应。因此,鉴定此分离株为H3亚型CIV,命名为A/canine/Guangdong/01/2011,简称为CGD2011。
2.3 全基因组扩增 根据设计的H3N2亚型CIV的11对引物进行RT-PCR扩增,经电泳检测,可见预期大小条带(图2)。
2.4 分子序列同源性及系统进化分析
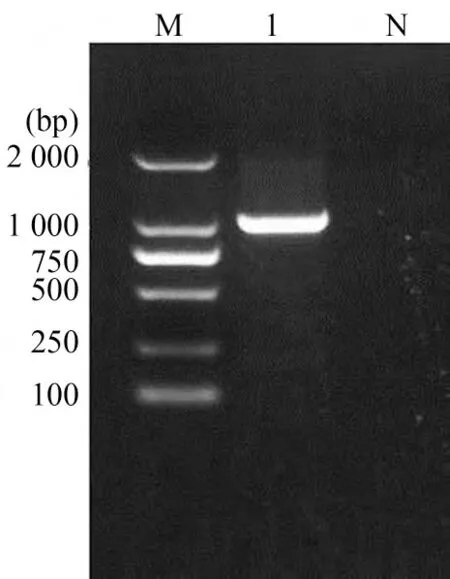
图1 分离株的RT-PCR检测
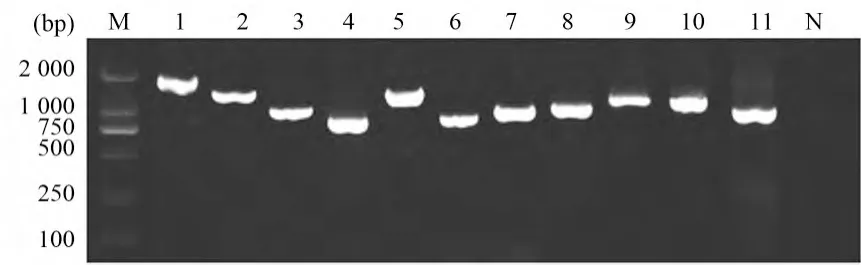
图2 分离株各基因的RT-PCR扩增
2.4.1 HA基因序列分析 将扩增得到的HA基因序列与国内外登录的16株A型流感病毒株的HA基因序列进行比较,参考基因序列登录号分别为:JX101433.1、JF714153.1、JX101353.1、JN247579.1、JX163256.1、GU433345.1、JN087096.1、JN087112.1、AJ427297.1、AB537451.1、AB450457.1、EU301210.1、GU473367.1、DQ124196.1、CY067382.1。扩增得到的HA基因片段与禽源H3N2亚型CIV HA基因的核苷酸同源性最高,达到98.4%~99.1%,与H3亚型禽流感病毒HA基因的同源性为90.6%~97.1%,与马源H3N8亚型CIV HA基因的同源性为74.0%~74.2%。系统进化树分析,本次分离的CIV HA基因与2006年-2010年广东、江苏、浙江、北京、辽宁分离到的H3N2亚型CIV属于同一分支,与H3亚型禽流感病毒的亲缘关系也较近,与马源H3N8亚型CIV的亲缘关系较远(见图3)。因此,可鉴定分离到的此株CIV属于禽源H3亚型。
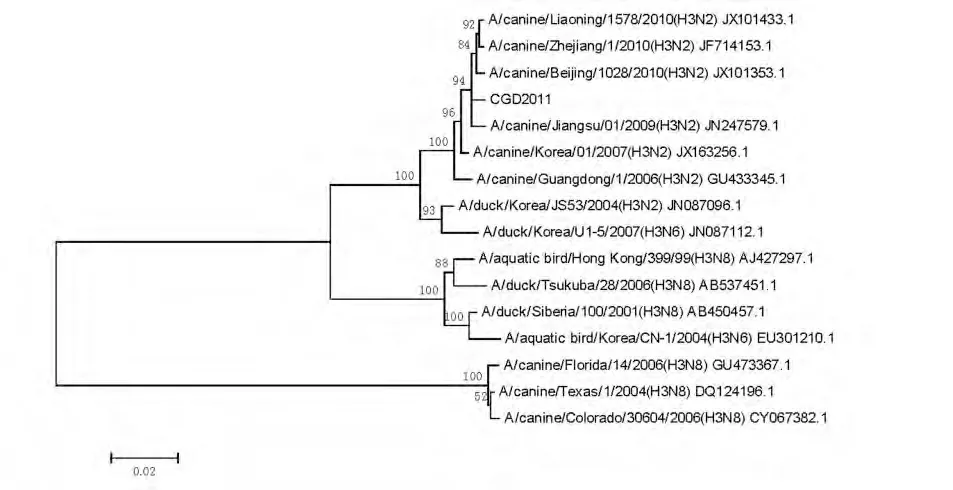
图3 H3N2亚型CIV HA基因核苷酸序列系统进化树
2.4.2 NA基因序列分析 将扩增得到的NA基因序列与国内外登录的14株A型流感病毒株的NA基因序列进行比较,参考基因序列登录号分别为:JN247581.1、JX101371.1、JX101435.1、JF714155.1、JX163258.1、GU433347.1、AY862641.1、EU301274.1、AF156395.1、CY109428.1、AB302790.1、HQ993101.1、CY067344.1、DQ124159.1。扩增得到的NA基因片段与禽源H3N2亚型CIV NA基因的核苷酸同源性最高,达到98.3%~99.3%,与N2亚型禽流感病毒NA基因的同源性为92.6%~94.7%,与马源H3N8亚型CIV NA基因的同源性为27.4%~28.8%。系统进化树分析,本次分离的CIV NA基因与2006年-2010年广东、江苏、浙江、北京、辽宁分离到的H3N2亚型CIV属于同一分支,与N2亚型禽流感病毒的亲缘关系也较近,与马源H3N8亚型CIV的亲缘关系较远(见图4)。因此,可鉴定分离到的此株CIV属于禽源N2亚型。

图4 H3N2亚型CIVNA基因核苷酸序列系统进化树
3 讨论
CIV感染引起犬发生严重的急性呼吸道系统症状,患犬出现发热、咳嗽、喷嚏、肺炎、肌炎,心脏功能障碍、中枢神经综合征等症状[9]。发热是流感病毒感染最显著的临床特征,据推测,致热细胞因子包括肿瘤坏死因子-α、白细胞介素、干扰素等是引起发热的原因[10]。本试验病犬表现出发热和消化系统症状,与典型的流感病毒感染症状不同,推测其原因为流感病毒感染引起病犬发热,病毒感染导致机体抵抗力下降,诱发幼犬出现胃肠炎。治疗过程以抗病毒,消炎补液,纠正酸碱平衡和离子平衡,补充能量为主,经过5 d治疗,病犬转归,康复出院。本病例易误诊为单纯胃肠炎,不进行抗病毒治疗,后期易发展成呼吸道系统症状,多数H3N2亚型CIV感染死亡病例皆因其发展成呼吸系统疾病而致[11]。
流感病毒感染期间,病毒通过鼻咽分泌物,喷嚏和咳嗽传播,病毒的排毒持续时间和排毒数量是决定其传染性的重要因素[12]。CI的治疗策略既要减轻其临床症状,同时要减弱其传染性。与未出现发热症状的流感病毒感染病例相比,出现发热的病例会出现更高量的鼻腔排毒,较高水平的病毒排毒量反应了疾病的严重性,或是减弱了宿主的防御机制,需立即引起注意和治疗[10]。因此,临床上若遇到发热的疑似病例,应立即进行隔离治疗,减弱其传染性。
流感病毒尤其是H5N1亚型高致病禽流感病毒的种间传播,是对人类健康的潜在威胁[13]。禽源H3N2亚型流感病毒感染犬,致使犬发生急性呼吸道系统疾病,并在犬中进行水平传播[4]。这说明禽流感病毒能突破种间屏障(禽到哺乳动物)进行传播,也存在从禽类传播给人类的可能[14]。流感病毒能在家养肉食动物中传播,研究人员推测这些哺乳动物作为流感病毒的载体,在流感病毒的传播过程中可能占有重要角色[15]。因而需要系统监测H3N2亚型CIV的发病情况和病毒演化,为CI的防控提供依据。
[1] Wright P F,Neumann G,Kawaoka Y.Orthomyxoviruses[C].Fields Virology 5th ed,2007,1691-1740.
[2] AwladWadair Ali SAID,TatsufumiUSUI,TsuyoshiYAMAGUCH,etal.A Sero-Survey of Subtype H3 Influenza A Virus Infection in Dogs and Cats in Japan[J].Virology,2011,73(4):541-544.
[3] Crawford P C,E JDubovi,R O Donis,et al.Transmission of equine influenza virus to dogs[J].Science,2005,310:482-485.
[4] Song D,B Kang,JOh,etal.Transmission of avian influenza vi⁃rus(H3N2)to dogs[J].Emerg InfectDis,2008,14:741-746.
[5] Giese M,Harde TC,Vahlenkamp TW,et al.Experimental in⁃fection and natural contact exposure of dogswith avian influenza virus(H5N1)[J].Emerg InfectDis,2008,14:308-310.
[6] Shoujun Li,Zhihai Shi,Guihong Zhang,et al.Avian-origin H3N2 canine influenza A viruses in Southern China Infection[J].Genetics and Evolution,2010,10:1286-1288.
[7] Yan Lin,Yanbing Zhao,Yongjie Liu,e tal.Genetic and pathobi⁃ologic characterization of H3N2 canine influenza viruses isolated in the Jiangsu Province of China in 2009-2010[J].Veterinary Mi⁃crobiology,2012,158(3-4):247-258.
[8] Yipeng Sun,Shasha Sun,Jinhua Liu,et al.Identification and characterization of avian-origin H3N2 canine influenza viruses in northern China during 2009-2010[J].Virology,2013,435:301-307.
[9] Nicholson K G.Clinical features of influenza[J].Semin Respir In⁃fect,1992,7:26-37.
[10] Daesub Song,Hyoungjoon Moon,Bokyu Kang,et al.Associa⁃tion between nasal shedding and fever that influenza A(H3N2)induces in dogs[J].Virology Journal,2011,8:1.
[11] Jung K,Lee CS,Song D S,etal.Pathology in dogswith experi⁃mental canine H3N2 influenza virus infection[J].Research in Vet⁃erinary Science,2010,88:523-527.
[12] Yu-Na Lee,Hyun-Jeong Lee,Chang-Seon Song,et al.Severe canine influenza in dogs correlateswith hyperchemokinemia and high viral load[J].Virology,2011,417:57-63.
[13] Korteweg C,Gu J.Pathology,molecular biology,and pathogene⁃sis of avian influenza A(H5N1)infection in humans[J].Am J Pathol,2008,172:1155-1170.
[14] Paul E,Gibbs J,Anderson Tara C.Equine and canine influenza:a review of current events[J].Animal Health Research Reviews,2012,11(1):43-51.
[15] Piccirillo A,Pasotto D,Cordioli P,et al.Serological survey for influenza type A viruses in domestic dogs(Canis lupus familiar⁃is)and cats(Felis catus)in north-eastern Italy[J].Zoonoses Pub⁃lic Health,2010,57:239-243.

