种鸭源猪丹毒丝菌分离及血清学调查
王 腾,靳 换,纪丽丽,张清水,韩相敏,孙海港,白如念,杨秀环,何伟勇,苏敬良
(1.中国农业大学动物医学院农业部动物流行病学与人畜共患病重点实验室,北京 海淀100193;2.北京市畜牧兽医总站,北京 朝阳100107)
猪丹毒丝菌(Erysipelothrix rhusiopathiae)是一种兼性厌氧的革兰阳性小杆菌,作为多种家养和野生动物的病原菌或共生菌广泛存在于自然界,包括海洋环境中,与扁桃体丹毒丝菌(E.tonsillarum)和E.inopinata共同构成丹毒丝菌属[1]。根据目前的血清学分型方法,采用琼脂扩散试验可将该属成员可分为至少23个血清型(serovar 1-23)及N型株,其中猪丹毒丝菌包括血清型1a、1b、2、4、5、6、8、9、11、12、15、16、17、19、21型和N型;扁桃体丹毒丝菌包括血清型3、7、10、14、20、22型和23型;血清型13和18则可能属于E.inopinata[2-4]。在所有的丹毒丝菌中,其中以猪丹毒的流行范围最广,并造成巨大的经济损失。猪丹毒丝菌血清1、2型在猪群中分离率最高(占75%~80%)。近年来,家禽丹毒丝菌感染已有过不少的报道,其中以火鸡感染造成的损失最为严重。各日龄的火鸡均易感,感染后主要表现为虚弱、精神沉郁、腹泻和猝死,产蛋鸡的产蛋量下降[5]。
本研究先后对两个出现产蛋异常的鸭群进行诊断,从送检鸭脑组织中分离到2株细菌,经过对分离株的16S rRNA基因序列分析鉴定为猪丹毒丝菌,并通过小鼠感染试验对分离株的毒力进行了检测,同时,采用生长凝集试验对3个不同鸭场的种鸭血清样本进行了检测。
1 材料与方法
1.1 病例概况 病例1为60周龄北京鸭父母代种群,临床表现为死淘率偏高,日均死亡率为0.2%~0.3%,饮水应用多种抗生素未能降低死亡率,送检4只,剖检主要表现为肝脏轻度肿大、质脆,个别鸭脾脏肿大,其他脏器无明显的肉眼病变。
病例2为40周龄北京鸭父母代种群,鸭群外表正常,但产蛋最高峰始终维持在84%左右。送检3只死淘鸭,剖检无明显的肉眼病变。
1.2 病原分离和鉴定
1.2.1 细菌分离培养 取脑、肝脏组织分别接种于添加2%小牛血清的胰酶大豆琼脂平板(TSA,BD公司),于烛缸37℃培养24 h,观察细菌生长情况。待细菌生长后,挑取可疑菌落划线接种于TSA平板,于烛缸37℃培养24 h。经过传代纯化培养后对分离细菌进行革兰染色和镜检。
1.2.2 16S rRNA基因扩增及序列分析 挑选单个菌落接种于10mL添加1%小牛血清的胰蛋白大豆肉汤培养基(TSB,BD公司)中,37℃摇振培养18 h。离心收获细菌,采用StarPrep Bacterial DNA Kit(北京全式金生物技术有限公司)提取细菌基因组DNA,保存于-20℃备用。
利用细菌16S rRNA保守区通用引物[6],以细菌的DNA为模板进行扩增。PCR反应体系(25μL)为:Taq Mix(Genstar)12.5μL,DNA模板1μL,上、下游引物各1μL,加灭菌双蒸馏水至25μL。PCR扩增条件为:95℃,5 min;95℃40 s,54℃40 s,72℃50 s,30个循环;72℃10min。反应结束后,取5μL PCR扩增产物用1%琼脂糖凝胶中进行电泳检查。剩余20μL产物经纯化后送北京三博远志生物技术有限责任公司进行核酸序列测定。获得的序列结果应用DNAStar软件进行分析,并与GenBank数据库中细菌的16S rRNA基因序列进行比较,确定细菌种属。
1.2.3 多重PCR检测spa基因 根据Shen等的报道[11],合成针对丹毒丝菌的spa A、spa B和spa C基因的特异性引物(见表1),采用多重PCR方法扩增spa基因。多重PCR 20μL反应体系:10μLPCRMix(Gene star),上、下游引物各0.5μL(10μmol/L),模板DNA 1μL,加水至20μL。PCR的反应条件为:95℃,5min;95℃,40 s,55℃,40 s,72℃,1min,30个循环;之后72℃延伸7min。反应结束后,取5μLPCR扩增产物用1%的琼脂糖凝胶中进行电泳检查。
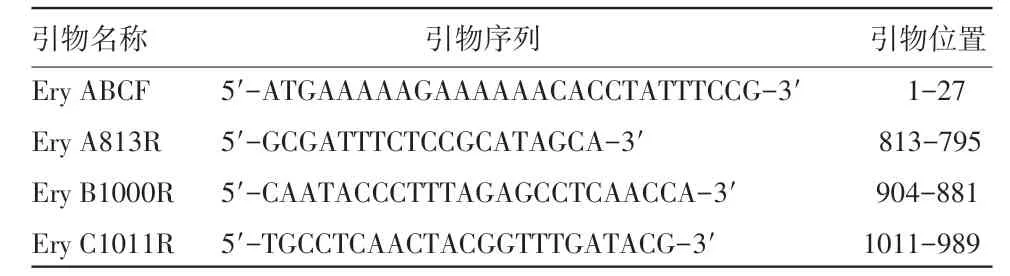
表1 spa基因PCR扩增引物序列
1.2.4 细菌药物敏感性检测 将细菌接种于TSB培养基,于37℃摇振培养过夜,之后将菌液浓度调整至108CFU/mL,均匀涂布于TSA平板上,然后放置不同药敏纸片(购自北京天坛药物生物技术开发公司),37℃培养18 h后读取结果。
1.2.5 病毒分离 为了检查鸭群是否发生病毒性感染,在进行细菌培养的同时,取肝脏、脾脏和脑组织混合后,加灭菌缓冲液制成20%悬液,研磨并冻融2次后,用孔径0.22μm滤器过滤除菌,经尿囊腔途径接种5枚9日龄鸭胚(0.3 mL/枚),37℃孵育观察5 d,收集鸭胚尿囊液盲传2代。
1.3 细菌毒力检测 取6周龄雌性BALB/c小鼠45只,分成9组。从9组中随机选出1组作为阴性对照组,余下8组分别接种2个分离株。菌液的稀释度分别为10-2、10-3、10-4和10-5,经腹腔注射0.2 mL/只,对照组注射0.2 mL PBS,观察8 d并记录小鼠临床表现和死亡情况。同时将接种的菌液用无菌PBS作10倍系列稀释,涂布于TSA平板,37℃过夜培养,计算活菌含量。
1.4 鸭血清抗体检测 利用分离株B作为抗原,参照Y.Shimazaki等报道的生长抑制凝集试验方法进行[8]。具体试验方法如下:(1)预先将96孔V型板在75%酒精中浸泡4 h,并在用前将其静置与超净工作台中紫外照射30min左右,风干;(2)在96孔V型板上,每孔加80μL TSB培养基(pH值7.6含有0.1%Tween-80,25μg/mL庆大霉素,250μg/mL卡那霉素),在第1孔中加待检血清100μL,之后做2倍系列稀释。每板中选2孔以SPF鸡血清、无丹毒丝菌感染雏鸭血清为阴性对照;(3)将TSB液体培养的细菌作为抗原加到V型板中,每孔5μL;4)将96孔V型板放置在无菌的大平皿中,同时于平皿中加一灭菌水浸泡过的无菌纱布以保持平皿内部的湿润,37℃作用24 h。结果判定:若血清样本中有抗体存在,在V型孔底部则出现菌体凝集、上清澄清,且倾斜V型板不流动;若为阴性,则培养液浑浊底部有菌体沉淀,无凝集,倾斜V型板可见菌体沉淀流动;如抗体效价达到或者高于1∶16,即判断为猪丹毒丝菌抗体阳性。
2 结果
2.1 细菌分离及培养特性 组织样本经无菌处理后接种鸭胚并盲传2代均未引起胚体死亡或出现肉眼病变。尿囊液血凝检测为阴性,初步排除病毒感染。
从2个鸭场送检的鸭脑组织中分离到2株细菌,分别命名为Ery-BJa株和Ery-BJb株。分离菌在加血清的TSA平板上生长良好,菌落透明、表面光滑、微凹、圆形、边缘整齐露珠状小菌落。将在液体培养基中过夜培养的细菌涂片进行革兰染色,结果2株细菌均为革兰阳性,但在形态上两株细菌存在较大差异,其中Ery-BJa株菌丝较长,菌丝中存在部分着色不均现象,而Ery-BJb株菌则较为短小,仅个别菌体较长。
2.2 16S rRNA基因鉴定 利用细菌16S rRNA基因通用引物进行PCR扩增,获得预期片段大小约为750 bp(图1),核酸序列分析结果显示2个分离株与已知的猪丹毒丝菌的同源性高达100%,判定为猪丹毒丝菌。
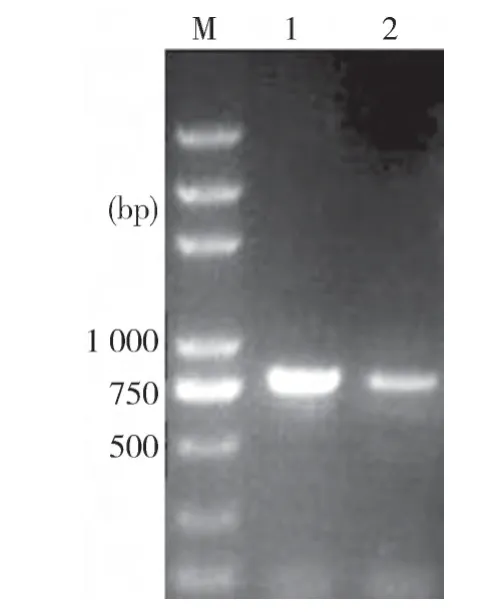
图1 猪丹毒丝菌分离株16S rRNA基因PCR扩增结果
2.3 spa基因多重PCR检测 为了确定分离株的spa基因型,采用多重PCR对两株细菌进行了检测,结果Ery-BJa株扩增出大小约1 000 bp的片段,与报道的spa C型一致;Ery-BJb株的片段大小约900 bp,与spa B型一致(图2)。
图2多重PCR对猪丹毒丝菌分离株spa基因分型结果
2.4 细菌对小鼠的致病力 小鼠接种Ery-BJa菌后各组在感染后第2天未表现明显的前驱症状即出现急性死亡高峰,根据Reed-Muench法计算A株的LD50为103CFU/0.2mL。Ery-BJb菌在接种后第4天和第5天出现死亡高峰,LD50≤102CFU/0.2mL。
2.5 药敏试验结果 纸片法进行体外药敏试验表明,此次分离菌株对庆大霉素、阿米卡星、卡那霉素、链霉素、新霉素、大观霉素、红霉素、万古霉素、磺胺甲噁唑/甲氧苄及头孢噻肟耐药;对青霉素G、阿莫西林/克拉维酸、氨苄西林、四环素、头孢曲松、头孢呋辛钠、头孢噻吩敏感。
2.6 鸭群抗体水平测定 采用生长凝集试验对3个种鸭场血清抗丹毒丝菌抗体水平检测结果显示,A场50份血清中,41份(82%)抗体水平可判为阳性(≥1∶16)。B场20份血清中,4份抗体水平可判为阳性。C场20份血清中,7份抗体水平可判为阳性。抗体水平具体分布见图3。

图3 A、B和C三个种鸭场鸭血清抗猪丹毒丝菌抗体水平分布
3 讨论
本研究从北京地区2个出现生产性能异常的种鸭群分离到2株猪丹毒丝菌,并通过血清学检测证明鸭群中均存在丹毒丝菌抗体阳性个体,表明种鸭群存在不同程度的猪丹毒丝菌感染。
据报道,猪丹毒丝菌不仅可造成雏火鸡和雏鸭死亡,也可引起雄禽的授精能力下降和感染鸡群产蛋下降[5]。Eriksson等报道,瑞典一蛋鸡场发生丹毒丝菌感染引起死亡和产蛋下降,6 030只鸡从60周龄到66周龄之间死亡1 861只[9]。Nakazawa曾报道几乎所有的鸡群均有丹毒丝菌污染[10]。Kurian等对新西兰鸡群进行血清学调查发现,55个鸡群中有46个为阳性(83%),检查的545份血清的阳性率为39.8%,其中12周龄以上的阳性率明显高于12周龄以内的鸡[11]。鸭和鹅自然感染也可引起严重的经济损失。Dhillon等报道过美国一鸭场北京鸭发生丹毒丝菌感染,2 000只的雏鸭群在15~21日龄死亡约700只,同时一个2 400只鸭的种鸭群每天的死亡率为4%~5%。剖检变化为肝脏肿大、质脆,浆膜下层有针尖状出血点[12]。刘文华等从送检的鸭肝脏组织中也分离到丹毒丝菌[13],但有关种鸭丹毒丝菌感染的流行病学以及丹毒丝菌感染所造成的危害尚不完全清楚。本研究采用生长抑制凝集试验对3个鸭群的调查,结果血清学抗体阳性率分别为20%至82%,表明我国种鸭群存在不同程度的感染,与国外报道的鸡群中血清抗体阳性率相近。其中,A场阳性率最高,B、C相对较低。所分离到的丹毒丝菌Ery-BJb株即从A场患病鸭群中分离得到,由此分析本场鸭群可能普遍感染过丹毒丝菌,但大部分个体呈耐过,而抗体水平在血清采集时依旧处于较高水平。B、C两场并未分离到丹毒丝菌,也未发现有相关症状个体出现。
丹毒丝菌的表面保护性抗原(surface protective antigen,spa)具有高度的免疫原性和保护原性。已报道的丹毒丝菌有3种spa型,即spa A、spa B和spa C,其中spa A主要存在于血清型1a、1b、2、5、8、9、12、15、16、17和N,spa B主要存在于血清型4、6、11、19和21,而spa C则主要存在于丹毒丝菌2株(E.sp.strain 2)血清型18种。同型spa蛋白的氨基酸高度同源,对同一spa型细菌感染具有完全的保护作用,但对异型的交叉保护作用相对较低。因为spa抗原是丹毒丝菌目前研究最为清楚的具有保护原性表面蛋白,所以鉴定细菌的spa型对确定的细菌的致病性和免疫原性具有重要的意义。采用多重PCR对2个分离株进行spa基因分型结果表明分别属于spa C型和spa B型,而国外报道的猪源分离株通常拥有spa A共同抗原,预示种鸭源菌株可能与猪群的流行株不同。因此,丹毒丝菌感染对商品鸭群的危害有待于进一步研究。
此外,猪丹毒丝菌作为一种人畜共患病病原,人类感染主要表现为局部皮肤感染、类丹毒(一种全身性皮肤感染)和与心内膜炎相关的败血症等3种病型,主要与所从事的职业有关,通常是接触被污染的动物、动物性产品及排泄物而感染。最易被感染的人群有屠宰人员、兽医、农民、渔民等通过皮肤伤口感染[4]。因此该菌对公共卫生安全也构成一定的威胁,应引起高度重视。
[1] Stackebrandt E,Family I.Erysipelotrichaceae Family I[M].In:Bergey’sManual of Systematic Bacteriology 2nd edn vol.3(Vos P,Garrity G,Jones D,etal.Eds.),Springer New York,2009:1299-1306.
[2] Wang Q,Chang B,Riley T.Erysipelothrix rhusiopathiae[J].Veter⁃inary Microbiology,2010,140:405-417.
[3]Takahashi T,Fujisawa T,Umeno A,et al.A taxonomic study on erysipelothrix by DNA-DNA hybridization experiments with nu⁃merous strains isolated from extensive origins[J].Microbiol ogy and Immunology,2008,52(10):469-478.
[4] Brooke C,Riley T.Erysipelothrix rhusiopathiae:bacteriology,epi⁃demiology and clinicalmanifestations of an occupational pathogen[J].Journal ofMedicalMicrobiology,1999,48:789-799.
[5]Saif,Y M禽病学[M].12版.苏敬良,高 福,索勋 主译,北京:中国农业出版社2012,p1079-1094.
[6]Wilson K H,Blitchington R B,Greene R C.Amplification of bac⁃terial 16S ribosomal DNA with polymerase chain reaction[J].Jour⁃nal of Clinical Microbiology,1990,28(9):1942-1946.
[7]Shen H,Bender J,Opriessnig T.Identification of surface protective antigen(spa)types in Erysipelothrix reference strains and diagnostic samples by spamultiplex real-time and conventional PCR assays[J].Journal of Applied.Microbiology,2010,109:1227-1233.
[8]Shimazaki Y,Gamoh K,Imada Y,et al.Detection of Antibodies to Erysipelothrix in stray dogs in Japan[J].Acta Veterinaria Scan⁃dinavica,2005,46:159-161.
[9]Eriksson H,Brännström S,Skarin H,et al.Characterization of Erysipelothrix rhusiopathiae isolates from laying hens and poultry red mites(Dermanyssus gallinae)from an outbreak of erysipelas[J].Avian Pathology,2010,39:505-509.
[10]Nakazawa H,Hayashidani H,Higashi J,et al.Occurrence of Ery⁃sipelothrix spp.in chicken meat parts from a processing plant[J].Journal of Food Protection,1998,61:1207-1209.
[11]Kurian A,Neumann E J,Hall W F,et al.Serological survey of exposure to Erysipelothrix rhusiopathiae in poultryin New Zealand[J].New Zealand Veterinary Journal,2012,106-9.
[12]Dhillon A,Winterfield R,Thacker H,et al.Erysipelas in domes⁃tic white Pekin ducks[J].Avian Disease,1980,24:784-787.
[13]刘文华,苏敬良,刘颖,等.鸭源丹毒菌的分离与鉴定[J].中国兽医杂志,2008,44(5):43-45.

