高含量全反式番茄红素的全合成方法研究
俞伊莎,李珊珊,晏弥卉,陈浙蓉,陈建辉*
(1.绍兴文理学院化学化工学院,浙江 绍兴 312000;2.浙江医药股份有限公司新昌制药厂,浙江 绍兴 312500)
番茄红素(Lycopene)是一种酯溶性不饱和碳氢化合物,是类胡萝卜素的一种,分子式为C40H56,分子量536.85,熔点174 ℃,为针状红色晶体;在自然界中多以全反式构型(all-trans)的形式存在,广泛分布于各种植物中,如番茄、胡萝卜、西瓜、南瓜、红莓和柑桔等,其中番茄中含量最高,约为3~40 mg/100 g。番茄红素最早由Harlsen于1873 年从Tamus communis L.berries 中分离出来,1930 年Karrer 等人提出了番茄红素的化学结构式是由11 个共轭及2 个非共轭的碳碳双键组成的非环状平面多共轭双键的结构,并由Kuhn和Grundmann 在1932 年证实[1]。番茄红素作为不饱和程度最高的类胡萝卜素,最近几年来,在人体健康及疾病防治方面的潜在作用引起了人们越来越浓厚的兴趣,研究表明它在抗氧化[2-3]、抗癌[4]、防肿瘤[5]、调节免疫功能[6]、保护心血管[7]和抗疲劳[8]等方面有着优越的生理功能,被广泛应用于药物、食品添加剂和饲料添加剂中。
目前番茄红素主要制备方法有浸提法[9-10]、微生物发酵法[11-12]和化学合成法[13-14]。由于番茄红素在番茄中含量低,提取工艺复杂,生产成本高,浸提法无法满足市场需求;微生物发酵法生产周期长、产率低,仍处于小试阶段,同样难以满足市场对番茄红素的需求。化学合成法有生产周期短、成本低和产量高等优点,近年来受到各国制药企业和科研院所的极大关注。目前采用化学合成工艺生产番茄红素主要是Roche 公司和BASF 公司[15-16],两家公司都以假紫罗兰酮为原料,采用Wittig 合成法,合成方式为2C15+C10,两者的主要区别是膦盐的阴离子部分不同。本课题研发小组对现有的合成番茄红素路线进行总结,吸收各文献优点,并结合已有的合成类胡萝卜素的工作思想和经验[17-20],成功开发了一种高含量全反式番茄红素的全合成新工艺,工艺路线如下(合成路线如图1 所示):(1)采用弱碱性交换树脂催化醛酮缩合,用格氏试剂诱导制备六碳醇,再与亚磷酸三乙酯发生Wittig-Horner 反应合成六碳膦酸酯,该路线能够有效降低六碳醇的合成工艺中丙酮废水含量,避免了乙炔、液氨及金属钙等危险化学品的使用,安全环保压力得以降低;(2)以甲基庚烯酮为起始原料经Darzen 反应制备九碳醛,与六碳膦酸酯经过格氏反应,催化氢化,脱水,成盐得到十五碳磷酸酯,经过结晶手性拆分制备全反式十五碳磷酸酯;(3)2-位双键全反式十五碳膦酸酯通过Wittig-Horner 缩合反应直接与十碳双醛反应得到番茄红素,转位重排制备得到番茄红素,该工艺路线简洁,所用原料国产化,所得产物番茄红素收率较高,具有很大的工业化生产潜力。
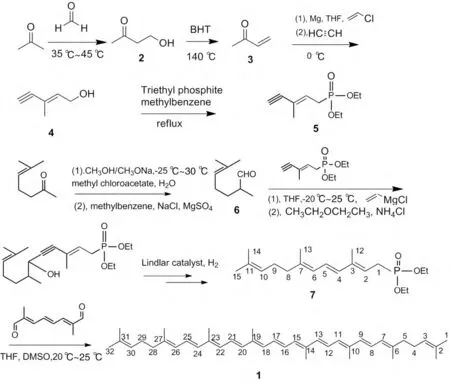
图1 全反式番茄红素(1)的合成路线
1 实验部分
1.1 仪器及试剂
Bruker DPX400 型核磁共振仪;上海天美7890F 气相色谱仪。
所用试剂均为市售分析纯,用前不经处理。
1.2 合成部分
1.2.1 丁酮醇(2)的合成
碱性树脂500 g 在2000 mL 去离子水中浸泡24 h,直到树脂液清澈,过滤。用2000 mL 5%NaOH 水溶液浸泡24 h 以上,过滤。再用去离子水将树脂洗至中性后,浸泡于1000 mL 去离子水中备用。
装柱,柱子采用φ80 mm 的夹套保温柱,夹套通循环热水,热水温度控制在35 ℃~45 ℃,柱高300 mm。将35%甲醛水溶液与丙酮以1:18(V/V)左右体积比预先混合好,混合溶液以10 mL/min的速度过柱反应;反应过程中柱温控制在35 ℃~45 ℃,下面流出液经GC 跟踪检测。流出液中的丙酮用旋转蒸发仪回收,回收后的丙酮与甲醛混和后直接套用,蒸发瓶中的残留液含有丙酮,丁酮醇,双丙酮醇和少量杂质。目标产物丁酮醇经连续精馏可从丙酮、水、双丙酮醇中分离出来。
1.2.2 甲基乙烯酮(3)的合成
连续用蠕动泵将上述产物丁酮醇加入500 mL配有蒸馏装置的三口烧瓶中,外温控制140 ℃,用蒸馏收集瓶收集丁酮醇的裂解产物甲基乙烯酮和水,加入氯化钠与无水硫酸钠进行干燥除水,备用。裂解过程中在裂解瓶与收集瓶需加BHT。
1.2.3 六碳醇(4)的合成
在1000 mL 不锈钢耐压反应釜中,投入镁粉24.0 g,四氢呋喃500 mL,打开氯乙烯储罐进液阀通入氯乙烯5.5 g,升温至80 ℃,在60 min 左右缓慢通入氯乙烯57.0 g,在通氯乙烯过程中,观察釜中压力不超过0.3 MPa,通毕,在80 ℃~90 ℃继续保温60 min,冷却至室温,泄压,得氯镁乙烯的THF 溶液。
将上述制备的氯镁乙烯的THF 溶液转移到3000 mL 四口烧瓶中,放入冷冻浴中,冷至-5 ℃~0 ℃,通入乙炔至饱和,约30 min 滴加甲基乙烯酮70.0 g,控制0 ℃左右,继续保温60 min,在40 ℃以下回收THF,用甲苯夹带THF,滴加水,用30%硫酸调pH=3~4,用氯仿萃取,用水洗涤油层二次,加氢醌,维持内温60 ℃~63 ℃,转位反应1.5 h。氯仿层用饱和碳酸氢钠溶液洗至中性,回收氯仿,进行粗馏,再精馏,收集60 ℃~65 ℃(1.06 kPa)馏分,即得精品六碳醇70.0 g,收率72.9 %。
1.2.4 六碳膦酸酯(5)的合成
六碳醇70.0 g,亚膦酸三乙酯182.0 g,甲苯100 mL 加热回流24 h,回收甲苯得六碳膦酸酯(5)157.5 g。
1.2.5 2,6-二甲基-5-庚烯醛(6)的合成
在氮气保护下,将126 g(1 mol)甲基庚烯酮和162 g(1.5 mol)氯乙酸甲酯加入到1000 mL 四口瓶中,冷浴保温-30 ℃左右,滴加30%甲醇钠的甲醇溶液300 mL,保持-25 ℃以下1.5 h 左右滴完,然后关掉冷浴,升温至0 ℃左右加入150 g水,搅拌反应0.5 h,再加热升温至45 ℃搅拌反应1 h。
反应液用1200 mL 甲苯分3 次萃取。合并有机层用300 mL 10% NaCl 水溶液洗涤,MgSO4干燥,过滤,溶剂减压蒸干后得到2,6-二甲基-5-庚烯醛粗品149.1 g,减压收集65 ℃~68 ℃/3 mmHg 馏分119.0 g,为浅黄色液体,含量97.1%,收率85.0%。
本反应以甲基庚烯酮为原料,与氯乙酸甲酯在碱性缩合剂(甲醇钠)存在下,经Darzens 缩合生成α,β-环氧酸酯,在温和的条件下水解,生成游离酸,但很不稳定,受热后,即脱去二氧化碳,转化成比原有反应物醛、酮增多一个碳原子的醛、酮。
1.2.6 全反式十五碳磷酸酯(7)的合成
六碳膦酸酯(5)157.5 g 溶于1000 mL 四氢呋喃,2,6-二甲基-5-庚烯醛100.0 g(0.714 mol)甲苯100 mL 溶液冷冻到-20 ℃~-25 ℃左右,滴加氯乙烯格氏试剂的四氢呋喃溶液550 mL(1.6 mol/L),滴加完毕于-10 ℃以下反应1 h。加入乙醚1000 mL,和氯化铵饱和水溶液250 mL,过滤,滤液用无水硫酸镁干燥,蒸除溶剂,加入林德拉催化剂1.0 g[21],搅拌计量通入氢气16 L,过滤,得到3,7,11-三甲基-2,4,6,10-四烯十二烷基膦酸二乙酯242.76 g,收率93.6%。1H NMR (δ,ppm,400 MHz,CDCl3):6.741 (t,J=19.6 Hz,1H,C2-H);6.242 (t,J=11.2 Hz,1H,C5-H);5.996 (d,J=11.6 Hz,1H,C6-H);5.628 (t,J=19.2 Hz,1H,C1-H);5.062~5.141 (m,2H,C4-H,C10-H);4.023~4.095 (m,4H,O-C*H2-CH3);3.43~3.53 (m,1H,C3-H);2.056~2.151 (m,4H,C8-H,C9-H);1.825,1.803 (s,3H,C13-H);1.686 (s,3H,C14-H);1.609 (s,3H,C15-H);1.313 (t,J=7.2 Hz,6H,O-CH2-C*H3);1.154 (d,J=6.8 Hz,3H,C12-H)。13C NMR (δ,ppm,400 MHz,CDCl3):156.7 (C2);140.6 (C7);131.7 (C11);129.9 (C4);125.5 (C6);123.9 (C10);119.4 (C5);114.9 (d,J=186.4 Hz,C1);61.6 (d,J=5.5 Hz,O-C*H2-CH3);40.3 (C8);36.1(d,J=21.1 Hz,C3);26.6 (C9);25.7 (C15);19.7(C13);17.7 (d,J=2.7 Hz,C12);16.9 (C14);16.34,16.28 (O-CH2-C*H3)。
1.2.7 高含量全反式番茄红素(1)的制备
在氮气保护的250 mL 三颈瓶中加入6.8 g(0.02 mol)3,7,11-三甲基-2,4,6,10-四烯十二烷基膦酸二乙酯和30 mL 8:1(体积比)的四氢呋喃和二甲基亚砜的混合液,机械搅拌于5 ℃左右(冰水浴)加入2.3 g(0.021 mol)叔丁醇钾,保温搅拌2 h,然后于5 ℃左右滴加入10 mL 溶有1.6 g(0.0098 mol)十碳双醛的8:1(体积比)的四氢呋喃和二甲基亚砜的混合液,约20 min 滴完,继续保温搅拌15 min,将上述溶液升温于20 ℃~25 ℃反应1 h。反应完毕加入100 mL 氯仿,用5%的氯化钠水溶液洗3 次(每次75 mL),有机层用硫酸镁干燥后过滤,滤液减压蒸去溶剂得番茄红素粗品。
得到番茄红素粗品滤饼中加水搅拌以洗掉残留的无机盐类,过滤,烘干。然后将干滤饼转移至300 mL 无水乙醇中,加热转位异构5 h 后减压回收乙醇。将转位后的番茄红素粉末真空干燥得到番茄红素成品3.3 g,含量97%,全反式番茄红素以C10 双醛计,收率70%。1H NMR (δ,ppm,400 MHz,CDCl3):5.111,5.975~6.943 (m,8H,双键H);5.11 (m,1H),1.552 (s,6H);1.616 (s,3H);1.689(s,3H);2.129 (s,3H);1.427~2.212 (m,4H)。13C NMR (δ,ppm,400 MHz,CDCl3):139.52 (C5);137.37 (C12);136.56 (C13);136.19 (C9);135.42(C10);132.66 (C14);131.76 (C1);131.58 (C8);130.09 (C15);125.73 (C11);125.17 (C2);124.82(C6);123.96 (C7);40.25 (C4);26.69 (C3);25.72(C20);18.42 (C19);16.97 (C18);12.91 (C17);12.81(C16)。
2 结论
本课题小组以甲基庚烯酮为起始原料,利用自主研发新工艺制备六碳醇重要中间体,并采用新方法以九碳醛与六碳膦酸酯制备十五碳磷酸酯,目标产物全反式番茄红素的实验室收率为70%(以C10 双醛计),含量97%。同Roche 和BASF 公司现有的番茄红素生产工艺相比,该路线有效地降低了丙酮的消耗,避免了使用氨基钙所带来的大量液氨污染,提高了全反式十五碳膦酸酯的收率,节约了生产成本,提高了核心竞争力,为全反式番茄红素的国产化大规模生产提供技术支持。
[1]Kuhn R,Grundmann C.Die konstitution des lycppins[J].Ber Deutsch chem Ges,1932,65:80-89.
[2]Di Mascio P,Kaisert S,Sies H,et al.Lycopene as the most eEfficient biological carotenid single oxygen quencher[J].Arch Bichem Biophys,1989,274(1):1-7.
[3]Van K H,Brouwer I A,West C E,et al.Bioacailability of lutein from vegetables is 5 times higher than that of betacarotene[J].Am J Clin Nutr,1999,70(2):261-268.
[4]Giovannucci E,Ascherio A,Rimm E B,et al.Carotenoid and cancer[J].Food Technology,1995,87:1767-1776.
[5]Klein E A,Thompson I M.Update on chemoprevention of prostate cancer[J].Curr Opin Urol,2004,14(3):143-149.
[6]耿姗姗,蔡东联.番茄红素对免疫系统的调节作用[J].中国临床康复,2005,9(27):148-149.
[7]Rao A V,Agarwal S.Tomato lycopene and low density lipoprotein oxidation:a human dietary intervention study[J].Lipids,1998,33(10):981-984.
[8]李军汉,周进,黄雷.番茄红素的生物学特性及其在体育运动领域的应用[J].吉林体育学院学报,2009,25(4):64-65.
[9]Mark L.Evaluation of extraction method for the analysis of carotenoids in fruits and vagetables [J].Food chem,1998,63(4):577-84.
[10]赵京城.高纯度番茄红素的制备方法:CN,ZL02146560.6[P].2003-03-26.
[11]DSM IP 资产有限公司.无外源胡萝卜素生成抑制剂条件下培养基中生成高产量番茄红素的三孢布拉霉:CN,ZL02821563.X [P].2007-08-08.
[12]薛娇.番茄红素的一种新型生成途径-Erwina.Herbicola的crtI 基因在Rhodobacter Sphaerodies 中表达[D].重庆:重庆大学,2008.
[13]Karrer P,Eugster C H,Tobler E.Synthesen von carotinoidfarbstoffen III.totalsynthese des lycopins [J].Helv.Chim.Acta.,1950,33(5):1349-1352.
[14]Isler O.Synthese voncrocetindialdhyd und lycopin[J].Helv.Chim.Acta.1956,4:463-473.
[15]Hoffmann-La Roche Inc.Method for the manufacture of carotinoids and novel intermediates:US,5166445 [P].1990-01-11.
[16]BASF Aktiengesellschaft.Preraration of phosphonium salts:US,6187959B1[P].1998-08-07.
[17]南京工业大学,浙江医药股份有限公司新昌制药厂.2,7-二甲基-2,4,6-辛三烯-1,8-二醛的合成方法:CN,103172504 A[P].2013-06-26.
[18]南京工业大学,浙江医药股份有限公司新昌制药厂.3,7,11-三甲基十二碳-2,4,6,10-四烯-1-基膦盐的制备方法:CN,103172673 A[P].2013-06-26.
[19]浙江医药股份有限公司新昌制药厂.全反式假性紫罗兰酮的制备方法:CN,102070424 B[P].2013-05-10.
[20]浙江医药股份有限公司新昌制药厂.(e)-假性紫罗兰酮的制备方法:CN,102070423 A[P].2011-05-25.
[21]Isler O,Gutmann H,Lindlar H,et al.Synthesis in the carotenoid series.VI.Synthesis of crocetin dialdehyde and lycopene[J].Helv Chim Acta,1956,39(1):463-473.

