长蛸(Octopus minor)初孵幼体培育与生长研究*
薄其康 郑小东① 王培亮 毕可智
(1.中国海洋大学水产学院 青岛 266003;2.马山集团有限公司 威海 264319;3.荣成市绿色食品办公室 威海 264300)
长蛸(Octopus minor)又称马蛸、八腿蛸和八蛸等,隶属头足纲、八腕目、蛸科、蛸属,广泛分布于我国南北沿海、朝鲜半岛和日本沿海(Yamamoto,1942;董正之,1988;钱耀森,2011),Octopus variabilis为同物异名(Luet al,2012)。长蛸个体较大,肉质鲜美,可食率很高,其生鲜及加工食品在海内外市场广阔,是我国北方主要出口蛸类。近十几年来,国内外对长蛸研究主要涵盖组织学和组织化学(Iwakoshiet al,2000;许星鸿等,2008)、生态学(吴常文等,1995)、繁殖生物学(钱耀森等,2013)、生理(Seolet al,2007)、遗传(孙宝超等,2010;Zuoet al,2011;Chenget al,2012)、营养分析(钱耀森等,2010)以及养殖(邵楚等,2011;刘畅,2013;Zhenget al,2014)等方面。长蛸作为资源修复种备受关注,2012年农业部批准建设山东荣成月湖长蛸国家级水产种质资源保护区,同时山东省级长蛸原种场也正在建设中。
长蛸以摄食甲壳类、贝类、环节动物等无脊椎动物、鱼类为主,在各生长阶段均体现出较强的摄食能力(Boletzkyet al,1983;董正之,1988)。光滑河蓝蛤(Potamocorbula laevis)多生长在江河入海处,在我国南北沿岸均有广泛的分布(张素萍,2008)。菲律宾蛤仔(Ruditapes philippinarum)是我国习见经济贝类(王如才等,2008)。幼体培育是增养殖和资源修复的前期工作和重要环节,本研究使用这两种价廉的经济双壳贝类培育长蛸初孵幼体,分析幼体生长的基本指标、相关关系并描述幼体生长规律,旨在为养殖产业化提供基础数据,同时为培育增殖和资源修复用幼体提供新途径。
1 材料与方法
1.1 亲蛸采捕繁育和孵化
2012年6—8月份在山东荣成月湖采捕长蛸亲体916只,置于 5个室内水泥池(5.7m×2.7m×1.5m)中暂养,水深 0.5m,水温 19.5—25.1°C,盐度 28—31,遮光充气,常流水,日换水量为总水体的 2倍,投放PVC管作为采卵器和遮蔽物。暂养49d后,亲蛸陆续产卵。实验所用幼体来自同一亲蛸。将附着有受精卵的采卵器放在同样的水泥池中流水孵化。孵化过程中有亲体护卵。受精卵前期孵化是在3—18°C的自然水温下进行,后期为11.8—13.4°C。
1.2 幼体培育
幼体培养在中国海洋大学养殖技术实验室进行,采用 0.45m×0.35m×0.34m 玻璃缸培养幼体,水深0.25m,盐度 28—31,pH 7.9—8.1,水温(13±1)°C,自然光照。缸底铺有 8mm左右厚的砂,投放足量的菲律宾蛤仔壳和脉红螺壳作为幼体遮蔽物,砂和贝壳在使用前需清洗和消毒。放置遮蔽物时,蛤壳内侧、螺的壳口朝下。每天吸底1次,每10d全量换水1次。
1—15d幼体投喂的是光滑河蓝蛤,之后投喂菲律宾蛤仔。将孵化出的幼体分为A、B组,将其余还未孵化的分为C组。A、C组使用菲律宾蛤仔壳作为遮蔽物,B组使用脉红螺壳作为遮蔽物。投喂前用解剖刀将蛤左右分开,将蛤肉暴露,每个壳附带有部分蛤肉。每天投饵1次,18:00进行投喂,次天早上8:00收残饵。每份蛤肉可以重复使用3次。
1.3 数据分析
饵料溶失计算VW(%) =(Wf-Wi) /Wi×100%,Wi和Wf分别指未供幼体取食的饵料在溶水前后的重量。F=Wi/Wf,是用来计算摄食量的校正系数。
幼体培养 80d,每 10d取样进行形态测量,包括鲜重(Wt)、全长(TL)、胴长(MLd)、胴背宽(MWd)、腕长(AL)以及吸盘数(SC)等。测量前先将幼体放在含有2%酒精海水中麻醉10min(Villanuevaet al,1997)。用吸水纸尽量吸干幼体表面和胴体腔中的海水,然后称重;使用IMAGEJ软件测量体长。用80%酒精固定24h,保存样品。
培育期间,按照Koueta等(1999,2001)所描述的计算测定摄食量(FI)、摄食率(FR)、生长率(GR)、饵料效率(CER)、瞬时生长率(IGR)和成活率(SR)等,公式如下:
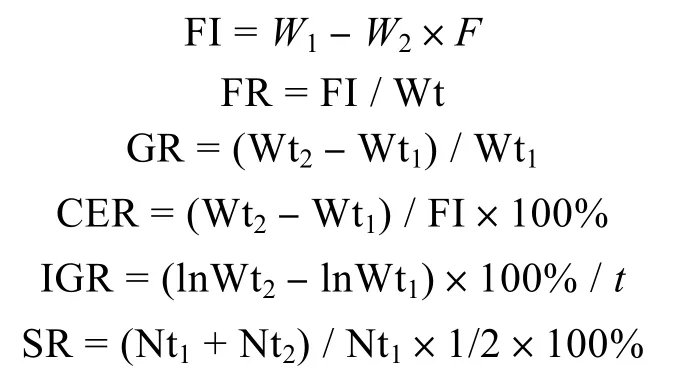
式中,W1和W2分别表示饵料被摄食前后质量,Wt1和Wt2分别表示幼体上次称量的鲜重与10d后再次称量时的鲜重,所以GR为旬生长率;Nt1和Nt2分别表示上次取样后与10d后再次取样前蛸幼体只数,SR为旬成活率。
采用SPSS 16.0统计分析。回归分析显著性运用F检验法检验。用单因素方差分析(ANOVA)比较同时期不同组生长状况,并运用 Duncan’s多重极差检验方法进行多重比较。
2 实验结果
2.1 初孵幼体
初孵幼体体表光滑,具极细的色素色斑,TL=(44.97±3.76)mm(40.7—47.8mm,n=3);胴体呈长卵圆形,MLd =(10.31±0.08)mm(10.3—10.8mm,n=3),为TL的 22.22%,是MWd的1.31倍(图1a)。各腕长不等,第一对腕最长,约为胴长的 2.9倍;腕式 1 >2 > 3 > 4,吸盘两列。
2.2 幼体摄食行为与成活率
幼体白天多躲避在遮蔽物下,时而将腕伸出遮蔽物四处视探,晚上取食。夜间能观察到幼体趴伏在蛤肉上进行摄食(图1b),白天收残饵时会发现蛤软体部仅剩外套膜(图1c,图1d)。若遇有光照刺激,幼体有喷墨现象。实验中还观察到幼体间的互残现象(图1e)。
由于各组培养幼体数量不同加之实验定期采样,B、C组分别培养了60d和35d,A组培养时间最长,为80d。幼体旬成活率比较稳定且比较高,70d中幼体旬成活率约在72.7%以上,B组40—60d和C组20—30d阶段幼体几乎不死亡;幼体 30d总成活率 80.99%,50d为 65.61%,70d为54.65%,80d成活率迅速降低至18.70%。
2.3 幼体生长
三组幼体MLd/TL比随时间增加,表明胴体的增长快于腕。以A组为例(图2,图3),0—80d的培育中,幼体MLd和TL分别由10.1mm和45.0mm增加到15.3mm和56.5mm,增长率分别为51.04%和25.53%,两者比值由0.224增加到0.271;MLd/TL比前50d增加慢,平均比值为0.224,50—80d比值增加快,平均为 0.263。1—80d各腕吸盘数(SC)变化不显著,各腕SC范围分别为第一对腕 50—72,第二对腕 49—64,第三对腕 36—62,第四对腕 36—52;第三对腕与第四对腕SC相近。
2.4 幼体饵料效率、摄食率和生长率
幼体饵料效率(CER)、摄食率(FR)和生长率(GR)随时间波动,幼体FR在0.90—3.38/10d,CER最高为29.29%。在前27d培养幼体平均生长率10.63%/10d,前50d幼体平均生长率7.86%/10d。在幼体培育的过程中,可明显看出FR与CER、GR呈负相关关系(图4,图5)。CER与 GR呈极显著线性回归关系(P<0.01),y= 1.452x-2.731(R2=0.865)(图6)。经过80d培养,幼体最终生长率为 122.05%,平均生长率为9.97%/10d。

图1 长蛸幼体80d培育Fig.1 The 80d hatching rearing of O.minor
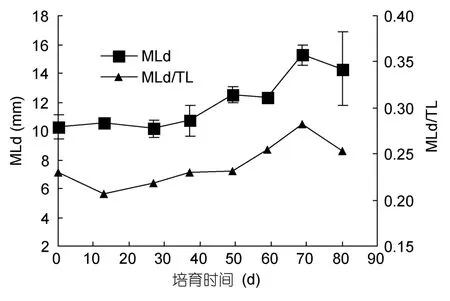
图2 A组长蛸幼体胴长及胴长/全长值变化Fig.2 The trends of MLd and MLd/TL of A group
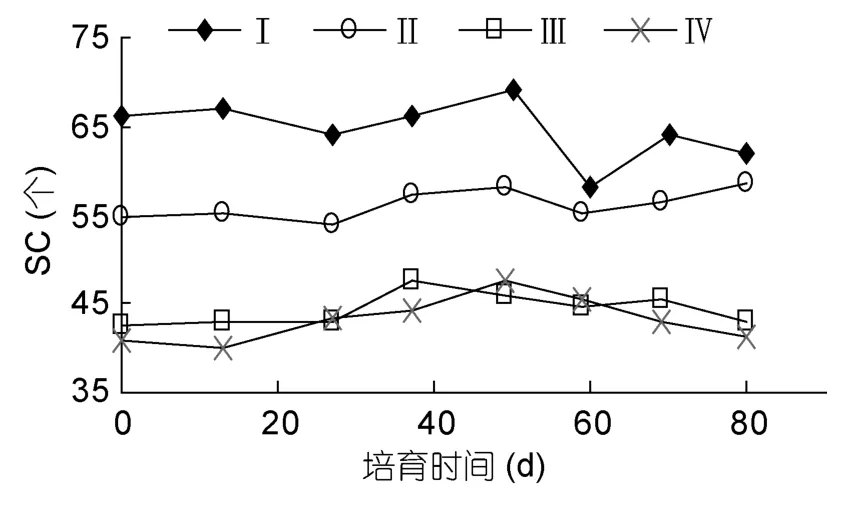
图3 A组长蛸幼体腕吸盘平均数Fig.3 The amount of SC in Group A
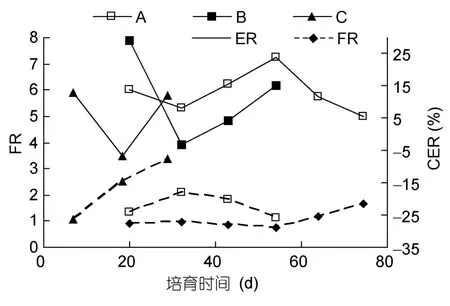
图4 长蛸幼体摄食率与饵料效率Fig.4 The FR and CER of O.minor’s hatchings
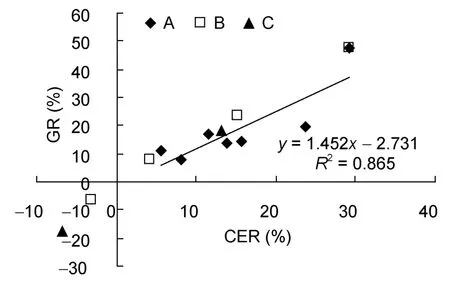
图5 长蛸幼体饵料效率与生长率的关系Fig.5 The relation between CER and GR of O.minor’s hatchings
2.5 幼体鲜重与培养天数的关系
初孵幼体平均鲜重(Wt)(0.322±0.006)g(0.316—0.327g,n=3)。幼体Wt随培养时间(t)增加而增加,Wt与培养天数呈指数函数关系,A、C组Wt与培养天数关系Wt = 0.294e0.010t(R2=0.894,P<0.01),B组平均鲜重与培养天数关系为 Wt = 0.316e0.010t(R2= 0.872,P<0.01),幼体总体生长曲线为 Wt = 0.301e0.010t(R2=0.854,P<0.01)。
2.6 遮蔽物的优劣
在培养中,虽然B组中个体鲜重与A、C组无显著差异,但其平均值均大于 A组(表1),表明螺壳作为遮蔽物有利于幼体培养。
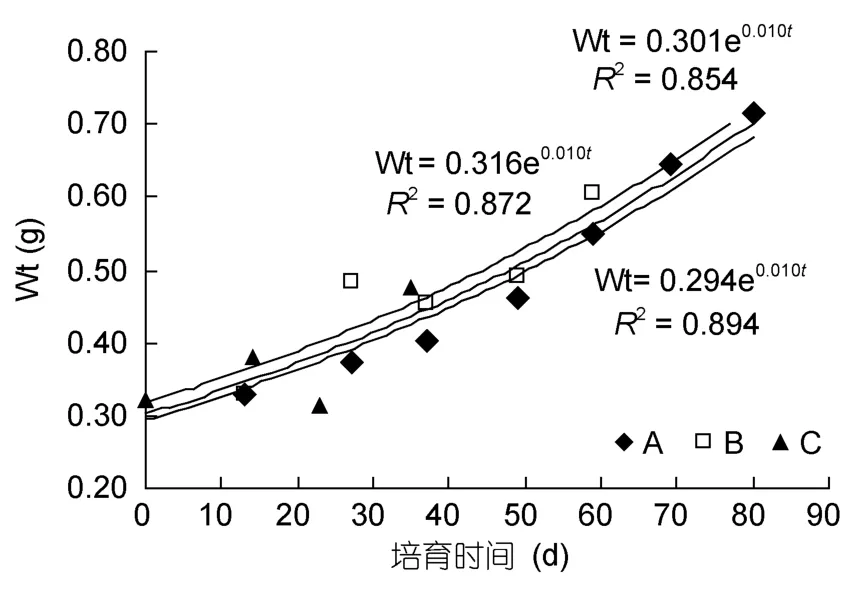
图6 长蛸幼体鲜重变化Fig.6 The trends of Wt of O.minor’s hatchings

表1 3组幼体平均鲜重的比较Tab.1 The comparison between the hatchings of O.minor at same stage from 3 groups
3 讨论
3.1 幼体遮蔽物的选择
长蛸喜阴暗和安静环境,通常会隐蔽躲藏。钱耀森(2011)和刘畅(2013)分别使用蛤蜊壳、牡蛎壳、海藻以及空心陶瓷坠作为遮蔽物,钱耀森(2011)认为海藻不仅起到遮蔽物的效果,而且海藻中的小生物还能作为幼蛸饵料;刘畅(2013)认为由于蛤蜊壳内常聚集多只幼体,易争斗,影响幼体成活率,其效果不如陶瓷坠。本实验所用菲律宾蛤仔壳和螺壳作遮蔽物,结果表明后者效果更好(表1)。
本文还在玻璃缸底铺了砂,由于幼体的活动,壳下会形成凹陷的小砂坑,白天幼体就藏匿在砂坑与壳形成的空间中,并借壳边缘留出的缝隙吸入和呼出海水,也起到了一定的遮蔽作用。
3.2 幼体生长与饵料选用
Octopus pallidus是一种底栖种类,体重、体长和生活史与长蛸相当,且其初孵幼体底栖,鲜重(0.230g)与长蛸初孵幼体相似。Leporati等(2007)和 André等(2008)在水温14—16°C下培育O.pallidus,平均生长率(GR)分别得到13.8%/10d和14.3%/10d。本文使用光滑河蓝蛤和菲律宾蛤仔作为长蛸幼体开口和后期饵料,在水温 11.8—13.4°C 下,50d幼体的 GR 为7.86%/10d,较前者低,远低于在培育水温 21°C下使用蟹苗作开口饵料得到的 GR值 4.63%/d(刘畅,2013),但是幼体成活率(30d总成活率80.99%,50d总成活率65.61%)高于后者(47天的成活率45.4%)。
GR和FI是随培育温度升高而增加的(Segawaet al,2002;Semmenset al,2004),本作者认为使用光滑河蓝蛤作为饵料,幼体平均生长率偏低可能与培育温度有一定关系。此外,可能与饵料自身营养或长蛸幼体对食物喜好有关。
Smale等(1981)认为甲壳类和鱼类的混合饵料对蛸类最合适。邵楚等(2011)指出投喂招潮蟹,长蛸摄食稳定,生长快,特定生长率及饵料转化率高,活动力强。长蛸幼体的后期培育仍然选用蓝蛤和菲律宾蛤仔,结果显示长蛸幼体能够摄食两种蛤,这两种双壳贝类能维持长蛸幼体的基本生长和能量所需。
钱耀森(2011)按 5—10个/mL卤虫无节幼体和1—2个/mL桡足类混合作为长蛸幼体的开口饵料,并在幼体13d以后逐渐增加桡足类和蟹苗的比例,效果较好。本实验使用光滑河蓝蛤和菲律宾蛤仔作为开口饵料,可以满足幼体摄食需要。蓝蛤可以让初孵幼体度过开口期,比虾、蟹幼体等活饵料低廉,易持续获得,特别是在冬季培育幼体阶段。但两种贝类作为后期饵料,效果不是很理想。
3.3 幼体生长特征和互残现象
长蛸初孵幼体的形态结构与成体接近。幼体腕长(AL)约为胴长(MLd)的 2.9倍,而成体腕长约为胴长的 6—7倍(董正之,1988)。幼体胴长占全长的比(MLd/TL)是随着培养天数增加的(图2),幼体MLd增长率(51.04%)大于 TL增长率(25.53%),且幼体腕吸盘数无显著变化(图3),表明幼体初期生长主要集中在胴体生长,可能与幼体在此阶段内脏器官的发育有关,如消化器官的发育(Moguelet al,2010)。也许幼体下一阶段的生长中会集中在腕的生长,尚需进一步验证。
长蛸幼体 Wt与培养天数(t)呈指数函数关系(图6),与O.pallidus生长函数相似(Andréet al,2008),同时也发现了FR与CER的负相关关系(图4)。André等(2008)认为头足类的生长主要包括肌纤维的增生和增粗两个过程,肌纤维增生耗能多,增重不明显;而增粗耗能少,增重明显。此外,刘畅(2013)在人工饲养 110d后,可根据有无茎化腕判断长蛸性别。本实验经过80d的养殖,没有观察到茎化腕。
蛸类存在相互残食现象。Promboon等(2011)在室内研究砂蛸全生活史时发现在 0—70d容易发现幼体的互残。王卫军等(2009)认为短蛸自身相残的行为是遗传行为,可能是由基因控制的,环境因素属于次要原因,但是这些因素不良时可以加剧相残行为。本文作者目睹一只活力强的幼体趴伏在活力弱的个体上进行咬食(图1d),此外观察到的残缺眼睛或只剩部分头的残体也进一步证明存在互残现象。本文认可由于饵料单一或营养缺乏引发幼体间相残(钱耀森,2011)。相残造成受伤幼体个体伤口感染,增加死亡率,此外,后期样本量基数减小,稍有个体死亡便会引起高的死亡率,这是后期死亡率增加的直接原因。
王卫军,杨建敏,周全利等,2009.短蛸幼体同类相残行为的观察.水产养殖,30(10):14—18
王如才,王昭萍,2008.海水贝类养殖学.青岛:中国海洋大学出版社,376—395
刘 畅,2013.长蛸生活史养殖技术研究.青岛:中国海洋大学硕士学位论文,18—20
许星鸿,阎斌伦,郑家声等,2008.长蛸生殖系统的形态学与组织学观察.动物学杂志,43(4):77—84
孙宝超,杨建敏,孙国华等,2010.中国沿海长蛸(Octopus variabilis)自然群体线粒体.海洋与湖沼,41(2):259—265
吴常文,吕永林,1995.浙江北部沿海长蛸Octopus variabilis生态分布初步研究.浙江水产学院学报,14(2):148—150
张素萍,2008.中国海洋贝类图鉴.北京:海洋出版社,356
邵 楚,王 亚,王春琳,2011.3种饵料对暂养长蛸生长的影响.水产科学,30(3):140—143
钱耀森,2011.长蛸生态习性和人工育苗技术研究.青岛:中国海洋大学硕士学位论文,49—53
钱耀森,郑小东,王培亮等,2010.天鹅湖长蛸营养成分的分析及评价.海洋科学,34(12):14—18
钱耀森,郑小东,刘 畅等,2013.人工条件下长蛸(Octopus minor)繁殖习性及胚胎发育研究.海洋与湖沼,43(1):165—170
董正之,1988.中国动物志 软体动物门 头足纲.北京:科学出版社,181—182
André J,Pecl G T,Semmens J Met al,2008.Early life-history processes in benthic octopus:Relationships between temperature,feeding,food conversion,and growth in juvenileOctopus pallidus.Journal of Experimental Marine Biology and Ecology,354(1):81—92
Boletzky S V,Hanlon R T,1983.A review of the laboratory maintenance,rearing and culture of cephalopod mollusks.Memoirs of the National Museum Victoria,44:147—187
Cheng R,Zheng X,Lin Xet al,2012.Determination of the complete mitochondrial DNA sequence ofOctopus minor.Molecular Biology Reports,39(4):3461—3470
Iwakoshi E,Hisada M,Minakata H,2000.Cardioactive peptides isolated from the brain of a Japanese octopus,Octopus minor.Peptides,21(5):623—630
Koueta N,Boucaud-Camou E,1999.Food intake and growth in reared early juvenile cuttlefishSepia officinaliL.(Mollusca Cephalopoda).Journal of Experimental Marine Biology and Ecology,240(1):93—109
Koueta N,Boucaud-Camou E,2001.Basic growth relations in experimental rearing of early juvenile cuttlefishSepia officinalisL.(Mollusca:Cephalopoda).Journal of Experimental Marine Biology and Ecology,265(1):75—87
Leporati S C,Pecl G T,Semmens J M,2007.Cephalopod hatchling growth:the effects of initial size and seasonal temperatures.Marine Biology,151(4):1375—1383
Lu C C,Zheng X D,Lin X Z,2012.Diversity of Cephalopoda from the waters of the Chinese mainland and Taiwan.见:林 茂,王春光主编.第一届海峡两岸海洋生物多样性研讨会文集.北京:海洋出版社,76—87
Moguel C,Mascaró M,Avila-Poveda O Het al,2010.Morphological,physiological and behavioral changes during post-hatching development ofOctopus maya(Mollusca:Cephalopoda) with special focus on the digestive system.Aquatic Biology,9(1):35—48
Promboon P,Nabhitabhata J,Duengdee T,2011.Life cycle of the marbled octopus,Amphioctopus aegina(Gray)(Cephalopoda:Octopodidae) reared in the laboratory.Scientia Marina,75(4):811—821
Segawa S,Nomoto A,2002.Laboratory growth,feeding,oxygen consumption and ammonia excretion ofOctopus ocellatus.Bulletin of Marine Science,71(2):801—813
Semmens J M,Pecl G T,Villanueva Ret al,2004.Understanding octopus growth:patterns,variability and physiology.Marine and Freshwater Research,55:367—377
Seol D W,Lee J,Im S Yet al,2007.Clove oil as an anesthetic for common octopus(Octopus minor,Sasaki).Aquaculture Research,38(1):45—49
Smale M,Buchan P,1981.Biology ofOctopus vulgarisoff the east coast of South Africa.Marine Biology,65(1):1—12
Yamamoto T,1942.On the ecology ofOctopus variabilis typicus(Sasaki),with special reference to its breading habits.The Malacological Society of Japan,12(1—2):9—20
Zheng X D,Qian Y S,Liu Cet al,2014.Chapter 22Octopus minor.In:Cephalopod Culture,Iglesias J,Lidia F &Villanueva R eds.Springer,415—426
Zuo Z R,Zheng X D,Yuan Yet al,2011.Development and characterization of 12 polymorphic microsatellite loci inOctopus minor(Sasaki,1920).Conservation Genetics Resources,3(3):489—491

