冬季和夏季南海北部浮游纤毛虫的分布特点*
于 莹 张武昌 蔡昱明 丰美萍 李海波 肖 天
(1.中国科学院海洋研究所 海洋生态与环境科学重点实验室 青岛 266071;2.国家海洋局第二海洋研究所 国家海洋局海洋生态系统与生物地球化学重点实验室 杭州 310012;3.中国科学院大学 北京 100049)
海洋浮游纤毛虫个体微小(粒径 5—200 µm),在海洋中广泛分布,是海洋微型浮游动物的重要组成部分,主要包括无壳纤毛虫及砂壳纤毛虫两大类。纤毛虫主要摄食 pico-和 nano-级浮游生物,同时被meso-级浮游动物和鱼类幼体等所摄食,是连接微食物网和经典食物链的重要中介(Azamet al,1983;Pierceet al,1992),在海洋生态系统的物质循环和能量流动中发挥重要作用。
南海是我国最大的边缘海,以热带海洋性气候为主,夏季盛行西南季风,冬季盛行东北季风;生态环境复杂多样,既受珠江等径流的影响,又存在着季节性的上升流和沿岸流(Ganet al,2010)。Ning等(2004)认为南海浮游植物生物量的时空变化受到“季风-环流-营养盐”变化的驱动,存在着明显的物理-化学-生物海洋学耦合过程。南海复杂的物理化学环境可能通过影响浮游植物进一步影响纤毛虫的时空分布。
南海纤毛虫丰度和生物量分布的研究不多,主要集中在南海北部海域。刘华雪等(2010)报道了2007年夏季南海北部 2个断面表层纤毛虫丰度的水平分布特征;张翠霞等(2010)报道了 2007年秋季海南岛东部海域13个断面纤毛虫丰度在0、10和30 m水层的水平分布特征;郑丽平等(2012)报道了 2009年冬季(1月)南海北部 4个站位纤毛虫丰度的水平分布和垂直分布特征。这些研究主要揭示单个季节纤毛虫丰度的分布特点,对纤毛虫丰度的断面分布和季节变化没有深入研究。本文报道2009年冬季和夏季南海北部纤毛虫丰度和生物量的水平分布和垂直分布特点,初步探讨纤毛虫的空间分布与南海物理环境的耦合关系,以期为南海浮游生态系统的研究提供基础资料。
1 材料与方法
分别于2009年冬季(2月11日—2月21日)和夏季(8月12日—8月24日)搭乘“中国海监81”船在南海北部进行浮游纤毛虫的调查。两个航次站位一致,均在111°—117°E、18°—22°N海域内设S1、S2两个主要断面及g、e、h、m站,共18个站位(图1)。采用Niskin采水器按0、10、25、50、75、100、150和200 m采集表层到底层(或200m以浅)水样,使用颠倒温度计测定水温,使用耦合式感应盐度计测定盐度。
每层取500mL水样GF/F滤膜过滤,滤膜置于-20°C冰箱保存。滤膜带回实验室用90%丙酮在黑暗中-20°C下萃取24 h后,用Turner II荧光光度计测量叶绿素a(chla)浓度。
每层取1 L水样装入塑料样品瓶内,用Lugol’s液固定,终浓度1%。样品分析按照Utermöhl的方法(Utermöhl,1958)进行,自然沉淀至少48 h,用虹吸管将水样上层清液小心吸出,剩余约150 mL,倒入小瓶中,于阴凉处保存。取16 mL放于沉降杯内,在Olympus IX71倒置显微镜下100倍或400倍镜检。记录无壳纤毛虫、砂壳纤毛虫的丰度,无壳纤毛虫经Lugol’s液固定后,鉴定种类难度较大,本文没有其分类学信息;砂壳纤毛虫根据文献(Nie,1934;Nieet al,1947;徐奎栋等,2001;张武昌等,2012)鉴定到种。测量纤毛虫虫体的体长、体宽,按最接近的几何形状(如柱体、球体和锥体)计算体积。生物量由体积乘转换系数(0.19pg C/µm3,Puttet al,1989)得来,砂壳纤毛虫的体积直接按照肉体体积计算。
水体平均chla浓度(mg/m3)、水体平均纤毛虫丰度(ind/m3)和生物量(mg C/m3)是分别将底层或200 m以浅不同水层的chla浓度、纤毛虫丰度和生物量按水层进行积分,除以水深(水深大于 200 m的站位按照200 m计算)得出。纤毛虫丰度、生物量与环境因子的相关性分析采用统计软件 SPSS 16.0,采用Pearson相关分析方法,置信度设为95%。

图1 调查站位图Fig.1 Sampling stations in the northern South China Sea
2 结果
2.1 纤毛虫的丰度和生物量范围
冬季纤毛虫的平均丰度为(486±484)ind/L,范围为0ind/L(S2-10站的150m层)—2109ind/L(S1-6站的10m 层);平均生物量为(2.84±3.26)μg C/L,范围为0.00μg C/L(S2-10 站的 150m 层)—16.89μg C/L(S1-2站的10m层)。
夏季纤毛虫的平均丰度为(809±1008)ind/L,范围为5ind/L(S2-9站的150m和200层)—5594ind/L(S1-2站的表层);平均生物量为(1.96±3.80)μg C/L,范围为0.01μg C/L(S2-9站的100 m层)—29.32μg C/L(S1-8站的125m层)。
2.2 水体平均chl a浓度、水体平均纤毛虫丰度和生物量的水平分布
2.2.1 近岸到远岸 冬季,S1断面的S1-1站水体平均 chla浓度最高,且明显高于其他站位,水体平均chla浓度基本呈现从近岸向远岸降低的趋势。S2断面水体平均chla浓度最高值出现在S2-1站,水体平均chla浓度呈现明显的从近岸向远岸递减的趋势(图2)。

图2 冬季S1、S2断面水体平均chl a浓度的水平分布Fig.2 Horizontal distribution of depth-weighted average chl a concentration along Transect S1 and S2 in winter
冬季,S1断面水体平均纤毛虫丰度在 S1-2和S1-6站较高,基本从近岸向远岸降低,在最远的S1-9和S1-10站又略有升高;S1断面水体平均纤毛虫生物量在S1-1和S1-2站较高,基本从近岸向远岸降低。S2断面水体平均纤毛虫丰度和生物量的水平分布模式类似,均在S2-1站较低,S2-3站最高,从S2-3站向远岸基本逐渐降低(图4)。
夏季,S1、S2断面水体平均chla浓度的水平分布模式同冬季类似(图3)。
夏季,S1断面水体平均纤毛虫丰度在S1-1站较低,S1-2站最高,从S1-2站向远岸基本逐渐降低;S1断面水体平均纤毛虫生物量在S1-8站最高,除了S1-8站外,水体平均纤毛虫生物量基本从S1-2站向远岸降低。S2断面水体平均纤毛虫丰度和生物量的水平分布模式类似,均在 S2-1站最高,呈现明显的从近岸向远岸递减的趋势(图5)。
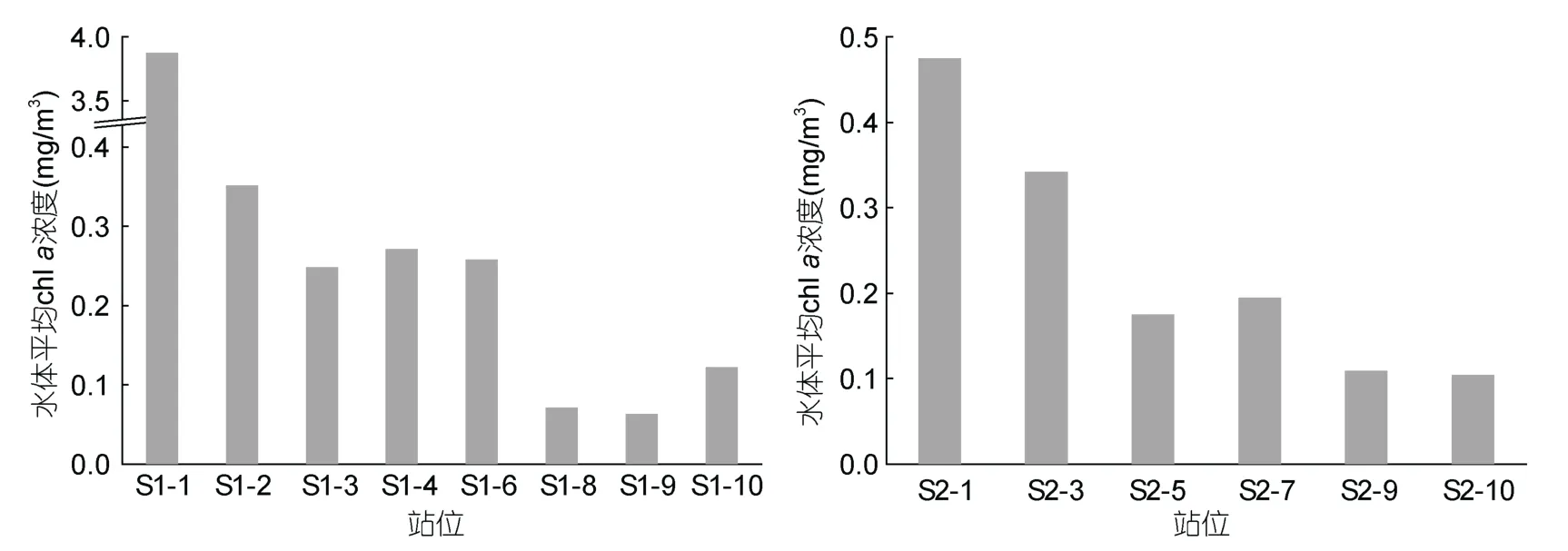
图3 夏季S1、S2断面水体平均chl a浓度的水平分布Fig.3 Horizontal distribution of depth-weighted average chl a concentration along Transects S1 and S2 in summer

图4 冬季S1、S2断面水体平均纤毛虫丰度和生物量的水平分布Fig.4 Horizontal distribution of depth-weighted average abundance and biomass of ciliates along Transects S1 and S2 in winter

图5 夏季S1、S2断面水体平均纤毛虫丰度和生物量的水平分布Fig.5 Horizontal distribution of depth-weighted average abundance and biomass of ciliates along Transects S1 and S2 in summer
2.2.2 S1和S2断面比较 冬季,S1断面的水体平均 chla浓度[(0.41±0.37)mg/m3]比 S2断面的[(0.37±0.19)mg/m3]略高。S1断面的水体平均纤毛虫丰度[(569±223)×103ind/m3]约为 S2 断面[(388±268)×103ind/m3]的1.5倍,S1断面的水体平均生物量[(4.15±2.76)mg C/m3]约为 S2 断面[(1.53±0.86)mg C/m3]的2.7倍。
夏季,S1断面的水体平均chla浓度(0.66±1.30 mg/m3)约为S2断面[(0.23±0.15)mg/m3]的2.8倍。S1断面的水体平均纤毛虫丰度[(788±580)×103ind/m3]约为 S2断面[(146±146)×103ind/m3]的 5.4倍,S1断面的水体平均生物量[(1.47±0.85)mg C/m3]约为 S2 断面[(0.20±0.18)mg C/m3]的7.3倍。
2.3 环境因子、纤毛虫丰度和生物量的垂直分布
冬季,温度在S1和S2两个断面的近岸站位出现垂直混合,远岸站位出现层化。盐度基本在水体上层及近岸较低,在水体下层及远岸较高。chla浓度在S1断面的 S1-1站明显较高,其他站位较低,且一般在各站的50m层出现高值;chla浓度在S2断面各站的差异不大,一般在各站的50—75m层出现高值,形成狭长的带状分布。在 S1断面,纤毛虫丰度一般在各站的10m层出现高值,在10m层以下随水深降低;在S2断面,纤毛虫丰度一般在10m层或25m层出现高值,在最大层以下丰度逐渐降低。纤毛虫生物量的垂直分布模式同纤毛虫丰度的基本一致(图6)。
夏季,温度在S1及S2断面各站均出现层化,随水深逐渐降低。盐度在S1及S2断面出现层化,随水深逐渐升高。chla浓度在S1断面的S1-1站明显较高,在其它站位较低,高值出现在近岸S1-2、S1-3、S1-4站的表层及远岸S1-6、S1-8、S1-9、S1-10站的50—75m层;chla浓度在 S2断面各站分布没有明显的差异,一般在各站的 50—75m 层出现高值,形成狭长的带状分布。S1断面纤毛虫丰度的垂直分布没有统一的规律,高值分别出现在 S1-2、S1-4、S1-8、S1-9站的表层,S1-3、S1-6站的70 m层及S1-8、S1-9站的150 m层;纤毛虫丰度在 S2断面的 S2-1站表层出现高值,在其它各站的50m层出现高值。纤毛虫生物量在S1-8站的125m和150m层出现高值,明显高于其它站位,分别达到29.32、22.01μg C/L,其中一类体长约90μm的大型无壳纤毛虫占绝对优势,占纤毛虫生物量的90%以上;S2断面纤毛虫生物量的垂直分布与丰度的类似(图7)。
2.4 砂壳纤毛虫
冬季砂壳纤毛虫很少检出,其丰度约占纤毛虫丰度的 1.7%。夏季砂壳纤毛虫丰度占纤毛虫丰度的22.6%,共鉴定出砂壳纤毛虫 14属 22种,拟铃虫属(Tintinnopsis)种类最多(表1),其中较为优势的种类为:简单薄铃虫(Leprotintinnus simplex)、筒状拟铃虫(Tintinnopsis tubulosoides)、根状拟铃虫(Tintinnopsis radix)、白领细壳虫(Stenosemella nivalis)及兆氏类杯虫(Metacylis jorgensenii)。
2.5 纤毛虫丰度、生物量和环境因子的相关性分析
纤毛虫丰度与温度没有明显的相关性,纤毛虫生物量与温度呈显著的负相关(r= –0.151,P<0.05);纤毛虫丰度与盐度呈显著的负相关(r= –0.150,P<0.05),纤毛虫生物量与盐度没有明显的相关性;纤毛虫丰度、生物量与Chla浓度均没有明显的相关性(表2)。
3 讨论
本研究中冬季和夏季纤毛虫的平均丰度分别为(486±484)ind/L 和(809±1008)ind/L,与以往的研究结果相当,如 2007年夏季南海北部纤毛虫的平均丰度为796ind/L(刘华雪等,2010),2007年秋季南海北部纤毛虫的平均丰度为(848±776)ind/L(张翠霞等,2010),2009年冬季南海北部无壳纤毛虫丰度的范围为 20—425ind/L,砂壳纤毛虫丰度的范围为 0—162ind/L(郑丽平等,2012)。本研究中夏季纤毛虫的丰度较冬季高,但生物量较冬季低,这可能是因为夏季纤毛虫的粒级较小,导致生物量较低。
3.1 纤毛虫丰度和生物量的水平分布
本文冬季和夏季纤毛虫的水平分布模式类似,纤毛虫丰度和生物量均基本由近岸向远岸降低,这与南海北部以往的研究结果一致(刘华雪等,2010;张翠霞等,2010;郑丽平等,2012)。这种近岸高、远岸低的水平分布特点在其他海区也有报道,如 Patagonian南部海区,砂壳纤毛虫丰度近岸较高,陆架海区较低(Santoferraraet al,2011)。本文研究海区位于珠江口附近,受珠江冲淡水的影响较大,大量的陆源营养物质随珠江径流被带入珠江口及其邻近海域。此外,冬季在东北季风的作用下,高营养盐的沿岸水从东海经台湾海峡进入南海,在南海北部沿岸形成西南向的沿岸流(Fanget al,1998);夏季在西南季风的作用下,广东沿岸形成上升流区,底层水涌升,将营养盐带入真光层中(Ganet al,2009)。上述这些复杂的物理过程均给南海北部沿岸带来丰富的营养盐,从而使得沿岸chla浓度保持较高水平(郝锵等,2011),导致纤毛虫可利用的饵料增多(Chenet al,2009),从而使纤毛虫丰度和生物量呈现近岸高远岸低的趋势。

图6 冬季S1及S2断面温度、盐度、chl a浓度、纤毛虫丰度和生物量的垂直分布Fig.6 Vertical distribution of temperature,salinity,chl a concentration,ciliate abundance and biomass along Transects S1 and S2 in winter

图7 夏季S1及S2断面温度、盐度、chl a浓度、纤毛虫丰度和生物量的垂直分布Fig.7 Vertical distribution of temperature,salinity,chl a concentration,ciliate abundance and biomass along Transects S1 and S2 in summer
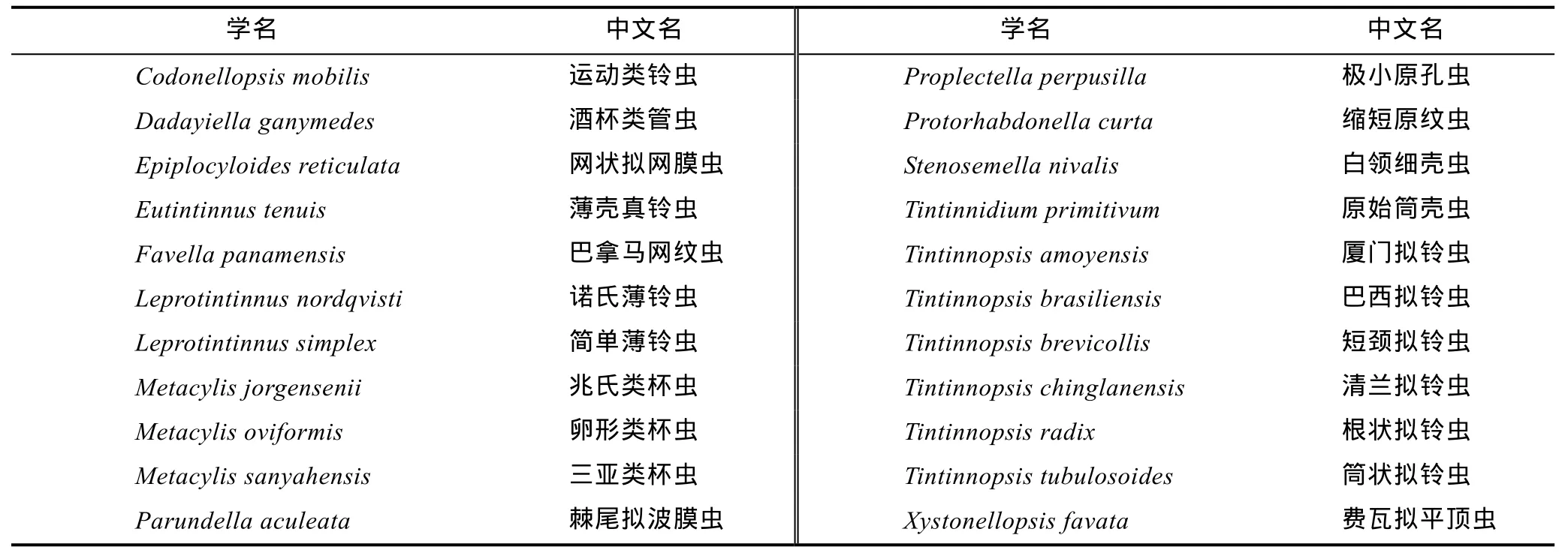
表1 夏季砂壳纤毛虫种类名录Tab.1 List of tintinnid species in summer

表2 纤毛虫丰度、生物量和环境因子的相关性分析Tab.2 Pearson’s correlation coefficients between ciliate abundance and biomass and environmental factors
本研究中冬季和夏季S1断面的纤毛虫平均丰度和生物量均明显高于 S2断面,且该趋势在夏季表现得更为突出;同时,Chla浓度也表现出类似的水平分布特征。我们推测,这可能是由于 S1断面更靠近珠江口,受珠江冲淡水的影响较大,大量的陆源营养物质随珠江径流被带入珠江口及其邻近海域,刺激浮游植物、细菌等的生长(杨阳等,2010),从而为纤毛虫提供丰富的饵料,支持了 S1断面较高的丰度和生物量。同时,夏季珠江径流较大,这可能导致夏季 S1和S2断面纤毛虫丰度和生物量的差异更为明显。
3.2 纤毛虫丰度和生物量的垂直分布
本文冬季和夏季纤毛虫的垂直分布模式不同,冬季纤毛虫丰度和生物量的高值一般出现在次表层;夏季纤毛虫的垂直分布没有统一的规律,纤毛虫丰度和生物量的高值在表层、中层和近底层都有分布。
冬季纤毛虫的垂直分布特点在其他海区较为常见,如 Sargasso Sea(Andersenet al,2011)和Disko Bay(Levinsenet al,1999);但本研究中纤毛虫丰度和生物量的最大值层(10或25m层)与chla最大值层(50m层)并不相同,相关性分析也表明纤毛虫丰度、生物量与chla浓度没有明显的相关性。这种分布不一致的现象在其他研究中也有报道(Tsudaet al,1989;Suzukiet al,1998),当chla最大值层分布较深时,纤毛虫丰度的最大值层趋向分布在表层和chla最大值层之间。Suzuki等(1998)认为这可能与无壳纤毛虫(本文冬季无壳纤毛虫占纤毛虫丰度的98%以上)趋向利用chla最大值层之上的再生生产力有关。
夏季纤毛虫的垂直分布特点在其他海区并不多见,大多数海区纤毛虫一般趋向分布在水体的中上层,如Irminger Sea(Montagneset al,2010)及东海(Tsaiet al,2011)。本研究中夏季S1断面的远岸站位S1-8、S1-9的近底层出现了纤毛虫丰度和生物量的高值区,这在以往的研究中没有发现过,我们无法判定这种垂直分布格局的成因。此处chla浓度较低,在计数样品时,发现样品中的沉积物较多,我们猜测该水层可能存在纤毛虫的其他饵料,如异养的鞭毛虫和甲藻等。所以这个现象还需要深入研究。
3.3 砂壳纤毛虫
本研究中冬季砂壳纤毛虫很少检出,夏季共鉴定出砂壳纤毛虫14属22种,与以往的报道相比,砂壳纤毛虫种数偏少。张翠霞等(2010)在2007年秋季南海北部共鉴定砂壳纤毛虫16属49种,刘华雪等(2010)在 2007年夏季南海北部共鉴定出砂壳纤毛虫 15属27种,这可能是由于采样时间、站位的不同所致。
本文不同季节砂壳纤毛虫丰度占纤毛虫丰度的比例差异显著,冬季较低(1.7%),夏季较高(22.6%)。这种季节变化在其它海区也有报道,砂壳纤毛虫丰度占纤毛虫丰度的比例一般在温度较高的季节,如夏季或秋季,较高。如Adriatic Sea的北部,砂壳纤毛虫丰度占纤毛虫丰度的比例夏季较冬季高(Revelanteet al,1985);胶州湾砂壳纤毛虫丰度占纤毛虫丰度的比例在夏季最高(于莹等,2011)。
致谢温度和盐度数据由国家海洋局南海分局环境监测中心提供,中国海监 81调查船全体船员对海上采样工作提供无私帮助,谨致谢忱。
于 莹,张武昌,赵 楠等,2011.胶州湾浮游纤毛虫丰度和生物量的周年变化.海洋与湖沼,42(5):690—701
刘华雪,谭烨辉,黄良民等,2010.夏季南海北部纤毛虫群落组成及其水平分布.生态学报,30(9):2340—2346
杨 阳,孟 强,夏华永等,2010.2006 年夏季珠江冲淡水扩展及生态响应.热带海洋学报,29(6):15—21
张武昌,丰美萍,于 莹等,2012.砂壳纤毛虫图谱.北京:科学出版社,1—499
张翠霞,张武昌,肖 天,2010.2007年10月南海北部浮游纤毛虫的丰度和生物量.生态学报,30(4):0867—0877
郑丽平,相卫国,黄邦钦,2012.冬季南海北部海域微型浮游动物及其对浮游植物摄食压力研究.台湾海峡,31(1):72—78
郝 锵,宁修仁,蔡昱明等,2011.南海北部初级生产力的物理-生物海洋学耦合特征及其对固碳量的影响.海洋学研究,(02):46—57
徐奎栋,洪华生,宋微波等,2001.台湾海峡的砂壳纤毛虫研究(纤毛动物门:砂壳亚目).动物分类学报,26(4):454—466
Andersen N G,Nielsen T G,Jakobsen H Het al,2011.Distribution and production of plankton communities in the subtropical convergence zone of the Sargasso Sea.II.Protozooplankton and copepods.Marine Ecology Progress Series,426:71—86
Azam F,Fenchel T,Field J Get al,1983.The ecological role of water column microbes in the sea.Marine Ecology Progress Series,10:257—263
Chen Y H,Yang Y F,2009.Characteristics of the microzooplankton community in Jiaozhou Bay,Qingdao,China.Chinese Journal of Oceanology and Limnology,27(3):435—442
Fang G.,Fang W,Fang Yet al,1998.A survey of studies on the South China Sea upper ocean circulation.Acta Oceanographica Taiwanica,37(1):1—16
Gan J,Cheung A,Guo Xet al,2009.Intensified upwelling over a widened shelf in the northeastern South China Sea.Journal of Geophysical Research,114:C09019,doi:10.1029/2007 JC004660
Gan J,Lu Z,Dai Met al,2010.Biological response to intensified upwelling and to a river plume in the northeastern South China Sea:A modeling study.Journal of Geophysical Research,115:C09001,doi:10.1029/2009JC005569
Levinsen H,Nielsen T G,Hansen B W,1999.Plankton community structure and carbon cycling on the western coast of Greenland during the stratified summer situation.II.Heterotrophic dinoflagellates and ciliates.Aquatic Microbial Ecology,16:217—232
Montagnes D J S,Allen J,Brown Let al,2010.Role of ciliates and other microzooplankton in the Irminger Sea(NW Atlantic Ocean).Marine Ecology Progress Series,411:101—115
Nie D S,1934.Notes on Tintinnoinea from the Bay of Amoy.Annual Report of the Marine Biology Association of China,3:71—80
Nie D S,Cheng P S,1947.Tintinnoinea of the Hainan region.Contributions from the Biological Laboratory of the Science Society of China:Zoological Series,16(3):41—86
Ning X,Chai F,Xue Het al,2004.Physical-biological oceanographic coupling influencing phytoplankton and primary production in the South China Sea.Journal of Geophysical Research,109:C10005,doi:10.1029/2004JC00 2365
Pierce R W,Turner J T,1992.Ecology of planktonic ciliates in marine food webs.Reviews in Aquatic Sciences,6(2):139—181
Putt M,Stoecker D K,1989.An experimentally determined carbon:volume ratio for marine “oligotrichous” ciliates from estuarine and coastal waters.Limnology and Oceanography,34(6):1097—1103
Revelante N,Gilmartin M,Smodlaka N,1985.The effects of Po River induced eutrophication on the distribution and community structure of ciliated protozoan and micrometazoan populations in the Northern Adriatic Sea.Journal of Plankton Research,7(4):461—471
Santoferrara L F,Gomez M I,Alder V A,2011.Bathymetric,latitudinal and vertical distribution of protozooplankton in a cold-temperate shelf(southern Patagonian waters)during winter.Journal of Plankton Research,33(3):457—468
Suzuki T,Taniguchi A,1998.Standing crops and vertical distribution of four groups of marine planktonic ciliates in relation to phytoplankton chlorophylla.Marine Biology,132(3):375—382
Tsai A Y,Gong G C,Chiang K Pet al,2011.Long-term(1998—2007)trends on the spatial distribution of heterotrophic ciliates in the East China Sea in summer:effect of the Three Gorges Dam construction.Journal of Oceanography,67(6):725—737
Tsuda A,Furuya K,Nemoto T,1989.Feeding of micro- and macrozooplankton at the subsurface chlorophyll maximum in the subtropical North Pacific.Journal of Experimental Marine Biology and Ecology,132(1):41—52
Utermöhl H,1958.Zur Vervollkommnung der quantitativen Phytoplankton Methodik.Mitteilingen der Internationalen Vereinigung fur Theoretische und Angewandte Limnologie,9:1—38

