临床试验进展:大数据方法在临床试验中的应用
汤森路透
临床试验进展:大数据方法在临床试验中的应用
汤森路透
药物研发的复杂性与日俱增,而大数据时代的到来使得临床试验的进展大大加快。本期“临床试验进展”讨论了皮肤病学新创试验中面向数据的亮点,探讨了现实采用的大数据方法,剖析了对风险导向监察的新兴方法学。此外还汇总了银屑病和特应性皮炎新疗法的临床研究报告,揭示了这些疾病的影响以及Ⅱ期和Ⅲ期研究中已经取得成功的候选药。
大数据;临床试验;实时监察;银屑病;特应性皮炎
1 引言
药物研发的复杂性与日俱增,制药企业倍感吃力,在临床试验中启用新技术随之成为希望的灯塔。希望与大数据相伴而来,有望实现患者的快速招募、临床试验实时监察、生物信息助力研究阶段加快进展以及部分试验精准用药的巨大优势。基于风险的监察也将受益。FDA发力构建集中化数据,企业推出转化行动——TransCelerate,减弱试验风险的新时代随之开始。随着研究中心开展实时统计分析,试验全局数据提供了效率更高、功效更大的监察方法,密集型现场监察的传统方法正在成为过去。然而,一说到大数据,诸多挑战横亘在前。患者隐私、商业投资保护、技术匮乏及数据变异都是缺点,需要再三考虑。
2014年的美国皮肤科学会年会详细讨论了银屑病、特应性皮炎及其他皮肤病的临床试验。本文汇总了银屑病和特应性皮炎新疗法的临床研究报告,揭示了这些疾病的影响以及Ⅱ期和Ⅲ期研究中已经取得成功的候选药。本期“临床试验进展”还讨论了皮肤病学新创试验中面向数据的亮点,探讨了现实采用的大数据方法,剖析了对风险导向监察的新兴方法学。
2 大数据对临床试验的意义
有些人辩称“大数据”挑战存在身边已有很长一段时间,但直到最近,随着数据增长速度陡然加快,结构性越来越差,大数据才真的越变越大。这些看似有道理的言论,要求对数据量、速度及多样性做出重大变化,数据转变为可以操作的知识这一过程变得更为复杂。
我们来看看临床领域。临床试验数据库和临床研究结果及相关文章逐年增加,不仅仅是数量,更为重要的是多样性和差异性也在增加。在患者层次,技术性突破(“组学”革命)介导的生物数据爆炸,使得生物医学信息迅速增加了前所未有的深度和复杂性。社交媒体和其他在线场景中自发产生了丰富的人口学、流行病学、健康和生活方式信息,若我们也能加以考虑,则可以想象临床数据会越变越大。但不论我们选择什么标签,临床开发领域中的大数据机遇和挑战又在何方?
通过挖掘消费者数据和生活方式分析工具,或可加速患者招募,从而更快识别符合入选标准的受试者。Orexigen Therapeutics公司借助这一方法,让“The Light研究”比预期提前一年启动了将近9 000例有心血管风险因素受试者的随机化工作。临床中心的选择也可受益于医疗和在线患者数据的地理并置和可视化。
多家机构拥有的医疗记录和临床试验资源库林林总总,同样可运用大数据方法,将其整合后标准化,方便识别可能符合试验入组条件的患者。研究心血管的Total Cancer CareTM Consortium和 PINNACLE Registry Research Alliance等健康保健提供者及研究机构网络,正是为了这一目的而设。
通过联网活动及允许实时监测的移动应用程序测量的健康相关信息和习惯,将挖掘出宝贵的“真实世界”信息和效果,用于评估治疗干预和对疾病的了解(如Health eHeart研究)。例如,受试者将基因组数据及不良作用信息贡献给大型数据库时,这些技术在研究中便可能具有直接作用。在电子患者时代,与医疗保健提供者的联系更为紧密,提出了大数据挑战,但若处理妥当,则可加快临床开发,推进对疾病的了解。
大数据途径及生物信息学提供了所需的定量和统计把握度,为大型生物数据集和医疗数据集之间建立有意义的联系,这样已知药物就能快速进入后期临床开发。例如,这种再利用策略促发了地昔帕明(1962年面市的一种抗抑郁药)治疗小分子肺癌的Ⅱa期试验。目前,生物医学数据最大的一个挑战是形形色色的分子数据库快速增加,临床研究出现大规模蛋白组学和基因组学读数。大数据工具无疑有望让纷繁的分子信息具有临床意义,从而更好地开启精准医学。
这些仅是临床试验中如何运用大数据的一些例子。显然,并非所有治疗领域、研究类型或开发计划都会从大数据工具均等受益,仍有技术和统计障碍需要克服。围绕数据共享的患者隐私和限制的担心也需要解决。尽管难以想象利用大数据方法得到的信息有朝一日会取代良好对照的临床试验,但如今有足够的线索得出结论,这些方法对临床试验构思、设计及执行都有诸多裨益。此外,大数据解决方案对药物再利用和加快转化研究都有高度价值。随着大数据分析工具及可视化即将揭开数据中隐蔽的形式,这些策略会产生哪些未曾预见的临床见解,让人拭目以待。
3 风险导向监察的新时代
历史上,脚踏实地的方法是临床试验风险导向监察(risk-based monitoring,RBM)的金标准。申办者倚重精深的源数据核实(SDV)和现场监测,但随着药物开发成本的攀升,这一方法的光环开始消退。技术的飞跃,加之大数据图谱的出现,给企业提供了一条思路——为何不将临床试验信息路由到集中化数据库,藉此展开监察,从而受益于实时电子数据采集?场外监察的优势引人注目——减少了差旅费用和碳足迹,能够评估权衡风险以取得最大安全性和最高数据质量,并能在源数据错误破坏试验之前将其捕获。这并不是说集中统计监察(CSM)毫无缺点——行业专家同意最佳方法是个体化监察,并可能纳入全面的方法学。
在回顾性分析中,TransCelerate 生物制药有限公司、美国FDA和临床试验学会(SCT)都发现传统的试验监察方法成本高昂却效率低下。现场监察方法不但使全球临床试验成本升高30%,而且对环境影响较大,难以发现错误。欧洲第二项卒中预防研究(ESPS2)的分析中,通过场外统计监察发现一家研究中心的血浆浓度分布数据明显不同于其他中心。此次分析完成之前尝试过2次现场监察,未能发现试验中哪些早期标志属于作假或行为不端的高风险中心。对于这一情况,现场监察力度不足导致剔除了438例已完成临床试验患者的数据。除了识别现场监察无法捕获的风险和数据错误外,SCT还表示,RBM计划中加入统计定向监察,使临床试验中的中心访视大概减少25%,减轻了负担并改善了监察活动。人为错误也构成了现场监察的缺点。ICON plc 公司是一家全球合同研究组织(CRO),称现场监察的平衡有赖于临床研究专员(CRA)。仅仅依靠CRA进行基于风险的临床试验监察有一些特定缺点。CRA仅凭既往经验,查看现场,检查数据质量,视角狭窄,不具有交叉试验甚或试验全局视角。这并不是说集中化监察支持者会忽视临床专科医生及训练有素者火眼金睛的价值。TransCelerate是关注RBM和加快药物开发的一家著名促转化组织,与Icon公司都同意需要全面了解试验的专业人员,甚至可能还需要了解适应证相关临床情况,方能有效评价分析工具,将其结合实际。Icon公司称他们可以协调使用分析和可视化工具、人工智能以及涉及CRA靶向现场监测既定作用过程的自动化系统。总之,他们的方法及时有效地查出并纠正了中心层次的失败。
“临床试验转化创议”(CTTI)是为提升临床试验质量和效率专设的合作,提出了整个研究过程中采用“质量源于设计”(QbD)方法,开展基于风险监测的方法。他们同意从方案设计起,设计本身兼顾安全性和数据质量风险的研究,并且能修改以保持关注关键过程和关键数据,便能确保质量。TransCelerate RBM方法在其质量风险管理方法中综合了这一QbD方法。该创议在其意见书《面向风险的监察方法》中也推荐“源数据复核”(SDR)应优于SDV。这就允许对方案依从性及中心和过程质量进行更为全面的评估,而不仅仅是数据转录核实,TransCelerate称其检查试验错误可以忽略不计。SDR关注的是现场监察活动,目标是使用他们称之为“风险评估分类工具”(RACT),在RBM计划开发早期识别关键数据和过程。风险驱动的靶向监察能降低成本,提高安全性,加强数据验证。2013全球临床试验(GCT)大会在波士顿举办,众多行业专家都同意需要建立一套全行业的风险评价标准和工具。小组专家提倡将TransCelerate模式作为实施标准。
TransCelerate的方法遵照循序渐进的步骤,从计划层次和方案层次的风险评估开始,通过RACT过滤,制定“综合质量风险管理计划”(IQRMP),指定每项研究的风险等级,确定关键数据和过程,最终制定出潜在风险指标及相关阈值。场外监察员将遵循IQRMP内的试验专设监察计划(MPS),尽量降低风险。他们的计划灵活多变,可按各项研究现有技术量身裁定,随着所有临床试验数据都转向数字化,相关性将会越来越高。TransCelerate首篇观点论文再次修订了《面向风险的监察更新-第Ⅰ卷》,解决对SDV无效的担心。该组织将在2014年5月发布回顾性分析的结果,进一步评价SDV作为质量控制指标的重要意义。FDA已经审阅了TransCelerate的先导研究监察计划,给出了修订反馈意见,更新后的RBM指南及修订的RACT将在2014年第1季度择时发布。TransCelerate的网站有培训材料,提供给想实施TransCelerate风险面向监察方法的人。
场外和统计监察的缺点隐而不露,制定摆脱老路的RBM计划时须记住几个难点。在大规模全球试验中,总有些研究中心(特别是农村地区)可能缺乏技术参加场外监察。在可能有未整理数据的中心,数据量小(特别是罕见病)、可提供的数据有多有少及各中心之间的系统差别都是缺点。根据这些,我们通过统计分析能检查出临床试验数据中的一堆错误,如意外和粗心所致的数据错误以及虚构和篡改数据。SCT提供了使用实际试验数据集进行此类回顾性分析的示例。GCT 2013上的专家同意需设数据隐私专员,原因是这些数据固有的敏感性,特别是因为知情同意书及患者原始资料完全电子化并通过临床试验管理系统(Clinical Trial Management System,CTMS)在CRO之间共享。
数字时代的技术进步,赋予了医药企业临床试验中做出统计推断找寻风险的能力。百分之百依赖SDV和现场监察,形成了临床试验监察费力而低效的方法,非但不能发现错误,经济影响也较大。事实上,行业提出的以集中化场外监察和定向现场监察为核心的风险面向关键数据,应作为金标准。由于重点是临床试验监督中的集中化监察,FDA明确同意指南文件《风险面向监察途径》,但他们只提供了一个总体框架。TransCelerate及其他着眼于未来的组织已经制定了自家的风险监察详细计划,充分利用了FDA为其打开的绿灯。其他国家纷纷跟进,提高透明度,为临床试验中的适应证设定RBM计划优先级,欧洲药品局(EMA)立誓在2014年及以后为所有批准药品发表风险导向监察计划摘要。2012年初,他们对临床试验中实施风险导向质量管理的读后体会最终定稿,其中宣扬了CSM的裨益。通过技术提高风险导向监察,是医药行业争论不休的一个话题。随着药品开发的复杂性和成本不断攀升,精简的需求始终存在,行业人员都承认灵活的靶向监测是取得高质量临床试验数据的高速公路。
4 2014年美国皮肤病学会年会报道的皮肤科临床研究最新进展
美国皮肤病学会本年度年会上一个亮点是3月22日(周六)举办的“皮肤病学最新进展”研讨会,包括银屑病试验性推测新疗法的4场大型临床研究报告,以及特应性皮炎的新型候选治疗药,上述2种极为常见的皮肤病对患者及其家人生活有巨大影响,特别是特应性皮炎(主要累及幼儿)。银屑病在全世界的流行趋势(见图1)明确支持对安全有效且耐受良好的治疗需求,以及采取相应的深入研究鉴别这类治疗的需求。
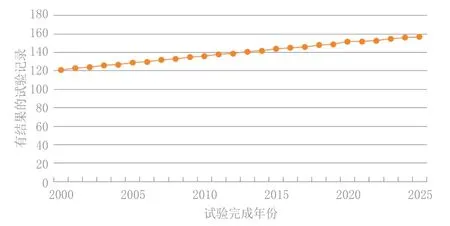
图 1 根据汤森路透发病率和流行趋势数据库(IPD)截至2010年的数据推断出的全球银屑病流行趋势Figure 1 Projected worldwide prevalence of psoriasis based on data through year 2010 according to Thomson Reuters’ incidence and prevalence database (IPD)
银屑病有瘙痒等严重症状,会破坏患者的生活质量,还因为有可见的皮肤病变,对患者的自我意识也有明显影响。其生活质量严重受损,对精神健康、身体健康、睡眠和一般功能也有影响。特应性皮炎的影响相似,加之父母担心子女的幸福,当子女步入玩耍或积极活动年龄时,皮肤屏障受损导致皮肤感染风险升高。尽管柔润剂和皮肤保健产品确实能暂时地改善银屑病和特应性皮炎的症状体征,但人们还在孜孜追求可作用于这2种疾病病理生理现象的活性药物治疗,旨在更好地控制对应发病机制产生的全部症状体征。在科罗拉多丹佛市举办的皮肤病学研讨会最后的报告和讨论上,专家称使用具有特异性靶向作用机制的治疗方案所开展的试验展现出阳性结果,给人们带来了希望。
4.1 Secukinumab治疗中重度银屑病起效快于依那西普
2014年3月在丹佛市举办的美国皮肤病学会会议上,还报告了secukinumab治疗银屑病的FIXTURE试验和其他试验的数据以及其他信息。但由于快速缓解银屑病症状对患者意义重大,故比较secukinumab和依那西普治疗中重度斑块型银屑病的FIXTURE研究,研究人员对其结果进行事后分析,以比较评估2种治疗的起效。在此试验中,327、327、326和326例患者随机分组,分别接受白介素-17阻滞抗体secukinumab(150或300 mg)、肿瘤坏死因子α拮抗剂依那西普(50 mg,每周2次)或安慰剂到第8周,从第12周起,原用安慰剂治疗患者随机用3个活性治疗方案中的任意一个。如图2所示,银屑病部位和严重程度指数(PASI)评分降低50%的中位时间,secukinumab 300 mg 组(3.0 周)比secukinumab 150 mg(3.9 周)短。依那西普起效较慢,达到这一终点的平均时间是7.9周。迅速临床见效后症状继续改善,第16周达到高峰,此时secukinumab治疗患者的PASI75缓解率高于依那西普治疗患者,尽管依那西普的缓解率高于安慰剂,但仍然有效。第16周时研究者总体评估为“清除”或“几近清除”(IGA评分0或1)的患者比例,接受secukinumab的患者高于接受依那西普或安慰剂的患者(见图3)。Secukinumab使用者的缓解率较高,研究维持阶段大部分保持到第52周。
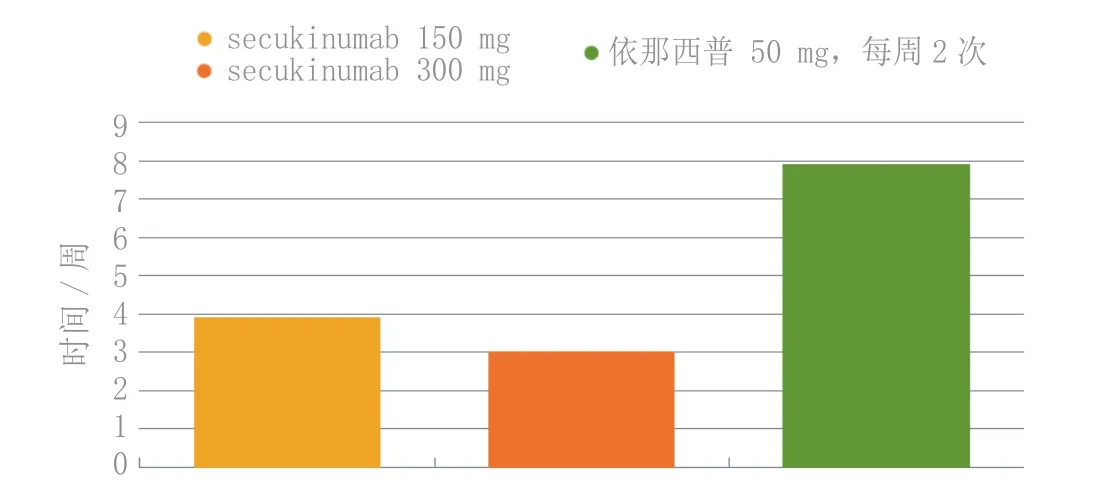
图 2 FIXTURE试验中接受secukinumab(150 或 300 mg)或依那西普(50 mg,每周2次)治疗的中重度银屑病患者病变面积及严重程度指数评分降低50%所需中位时间Figure 2 Median time to reach a 50% decrease in the psoriasis area and severity index scores in patients with moderate to severe psoriasis initiating treatment with secukinumab (150 or 300 mg), or etanercept (50 mg, twice weekly) in the FIXTURE trial

图 3 FIXTURE试验中接受secukinumab(150或300 mg)或依那西普(50 mg,每周2次)治疗第16周时病变面积及严重程度指数75%缓解或研究者总体评分为0/1(病变清除或几乎清除)的患者比例Figure 3 Proportion of patients with a psoriasis area and severity index 75% response or an investigator’s global assessment of 0/1 (lesions cleared or almost cleared) by week 16 of treatment with secukinumab (150 or 300 mg), etanercept (50 mg, twice weekly), or placebo in the FIXTURE trial
Secukinumab与依那西普相比耐受性良好。Secukinumab 150 mg、secukinumab 300 mg、依那西普和安慰剂组的平均暴露时间分别为317.5、320.7、331.9 和 95.2 d,不良事件发生率分别为77.6%、80.5%、73.3%和51.4%。总的来看,secukinumab治疗银屑病临床功效的其他报道,以及本研究的分析结果,表明该治疗方案起效比其他治疗快,考虑到了患者对缓解症状的需求,是一个具有价值的额外优势。
4.2 Ⅱ期研究表明guselkumab治疗银屑病有效性和耐受性良好
Ⅱ期X-PLORE试验证实了抗-白介素-23抗体治疗中重度银屑病的功效,这项试验是一项随机、安慰剂和阳性药对照试验,每组41~43例患者,每12周皮下使用5、50或200 mg guselkumab或每8周使用15或100 mg guselkumab、批准剂量的阿达木单抗或安慰剂。给予40周治疗,但该试验的主要终点是第16周的缓解。如图4所示,使用100和200 mg guselkumab的患者当时高达85.7%和83.3%的“研究者总体评分”评定为清除或几近清除(评分为0或1),而接受阿达木单抗患者的缓解率明显较低,尽管后者与安慰剂相比疗效不错。对应PASI75缓解率也表明guselkumab优于阿达木单抗(见图5),就像既往试验中的依那西普一样,是一种肿瘤坏死因子α阻滞剂。考虑“皮肤病学生活质量指数”评分为0或1的患者比例(见图6),较高剂量guselkumab的反应较大,说明guselkumab对患者的生活质量有益,反映在症状体征的改善,包括对健康和外貌的自我认识。对于研究者总体评估,guselkumab 100 和 200 mg 比阿达木单抗更为有效,有效率与guselkumab 15 或 50 mg 相仿。Guselkumab对银屑病症状体征的这种总体作用保持到第40周,此时50、100和200 mg剂量与阿达木单抗相比表现出统计学意义。此外,先用安慰剂后换为每8周使用1次guselkumab 100 mg,第40周的缓解率也较高。该药在研究期间可良好耐受,严重不良事件发生率较低,未见恶性病或重大心血管不良事件,各组的不良事件总发生率相仿。Guselkumab(联用)和安慰剂组到第16周发生注射部位反应的比例为0.6%,阿达木单抗组为6.6%,研究期间guselkumab使用者的不良事件总发生率为63.4%,阿达木单抗使用者为72.1%。
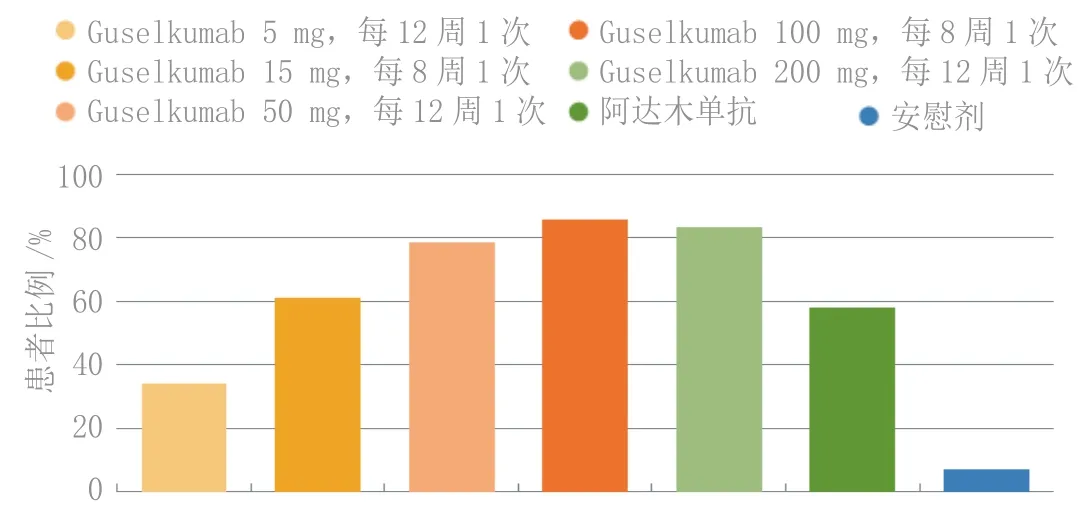
图 4 X-PLORE试验中guselkumab、阿达木单抗或安慰剂治疗第16周时研究者总体评分为0/1(病变清除或几乎清除)的患者比例Figure 4 Proportion of patients with an investigator’s global assessment of 0/1 (lesions cleared or almost cleared) by week 16 of treatment with guselkumab, adalimumab or placebo in the X-PLORE trial
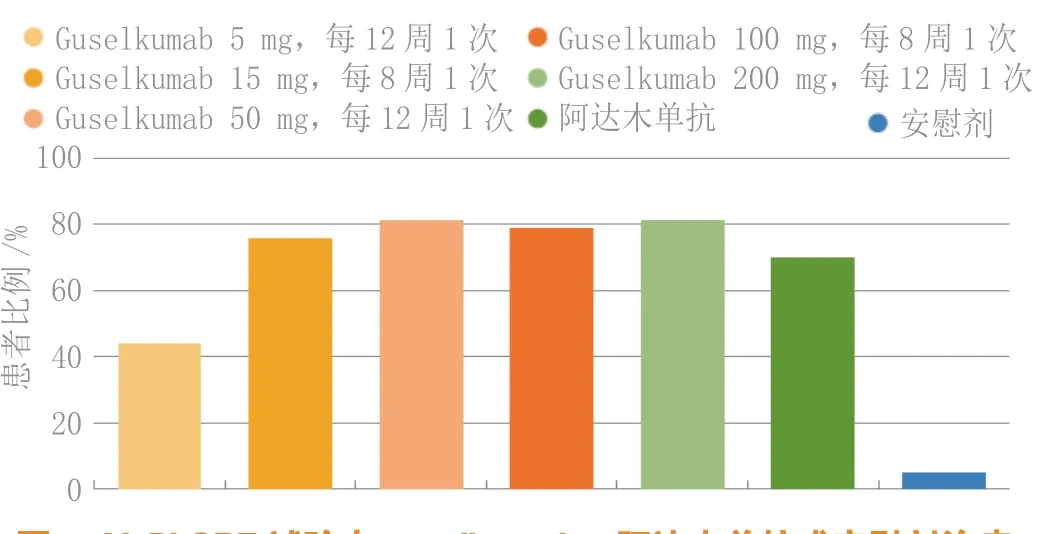
图 5 X-PLORE试验中guselkumab、阿达木单抗或安慰剂治疗到第16周时银屑病面积和严重程度指数75%缓解的患者比例Figure 5 Proportion of patients with a psoriasis area and severity index 75% response by week 16 of treatment with guselkumab, adalimumab or placebo in the X-PLORE trial
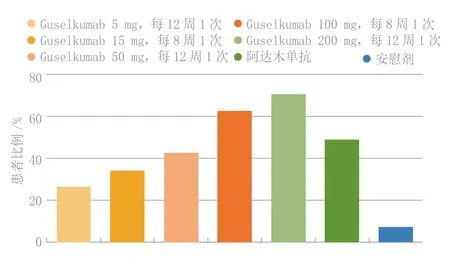
图6 X-PLORE试验中guselkumab、阿达木单抗或安慰剂治疗到第16周时皮肤病生活质量指数为0或1分的患者比例Figure 6 Proportion of patients with a dermatology life quality index score of 0 or 1 by week 16 of treatment with guselkumab, adalimumab or placebo in the X-PLORE trial
4.3 Ⅲ期试验表明托法替尼口服药治疗银屑病不劣于依那西普注射剂
Secukinumab是一种单克隆抗体,依那西普是一种融合蛋白,都是需要注射给药的大分子化合物。可口服的小分子在治疗中的优势显而易见,美国皮肤科学会年会上的皮肤病研究最新进展研究会上讨论了一些新的临床试验,其中有一部分研究是针对导致银屑病病理生理机制的口服生物药。热烈讨论的一项Ⅲ期试验证明小分子口服药托法替尼不劣于生物注射剂依那西普,重点介绍了小分子口服药对于患者接受度以及免疫原性风险的优势。329、335、330和107例中重度斑块型银屑病患者,分别使用托法替尼5和10 mg每日2次、每周2次皮下注射依那西普50 mg和安慰剂,并对其疗效进行比较。到第12周(试验的主要终点),使用高剂量口服药患者中获得PASI75缓解的人数至少与接受注射治疗药患者一样多。医生总体评估为皮肤病变清除或几近清除,口服接受10 mg托法替尼患者与接受依那西普注射剂患者报告的一样多。如图7所示,2种情况下托法替尼5 mg的疗效都降低,但仍比安慰剂明显更为有效。总的来看,结果证明对于控制银屑病的症状体征,每日2次口服托法替尼10 mg不劣于每周2次皮下注射依那西普50 mg。所有治疗都可良好耐受,托法替尼治疗者的严重不良事件报告率为2.1%和1.8%,依那西普治疗者为2.1%,安慰剂治疗者为4.7%。很少因不良事件而需要停药,所有研究表现出的安全性和耐受性均良好。

图 7 口服托法替尼(5或10 mg)或皮下注射依那西普(50 mg,每周2次)治疗第12周时病变面积及严重程度指数75%缓解或研究者总体评分为0/1(病变清除或几乎清除)的患者比例Figure 7 Proportion of patients with a psoriasis area and severity index 75% response or an investigator’s global assessment of 0/1 (lesions cleared or almost cleared) by week 12 of treatment with tofacitinib (5 or 10 mg, po) or etanercept (50 mg, sc, twice weekly)
4.4 Ⅱ期试验证实了CT-327对银屑病的止痒疗效
慢性瘙痒对银屑病和特应性皮炎等慢性皮肤病患者的生活质量有重大影响,但其严重程度与疾病活动度无关,提示针对瘙痒的治疗具有开发潜力。一项由160例轻度银屑病患者参加的Ⅱb期试验考察了选择性TrkA激酶抑制剂CT-327的止痒作用。受试者被给予3种剂量的CT-327(0.05%、0.1%和0.5%)或辅料,每日2次使用8周。结果显示,瘙痒视觉模拟评分最高降低60%,辅料组降低20%,对已缓解的瘙痒部位和严重程度指数评分具有边缘性额外作用,但未见局部反应或全身吸收。因此,与赋形剂组相比,CT-327组的不良事件较少,因瘙痒而停药也较少。基于这些有利结果,研究人员正针对银屑病患者开展一项Ⅲ期试验,而一项Ⅱb期试验也在进行之中,以评价试验性药物治疗特应性皮炎相关瘙痒患者的疗效。汤森路透Cortellis竞争情报中提供了CT-327治疗银屑病或特应性皮炎患者的Ⅱ期临床试验的详细情况。
4.5 Dupilumab可明显改善特应性皮炎成人患者的生活质量
这次盛会的报告和电子壁报环节中讨论了其他单克隆抗体和小分子治疗银屑病患者的更多临床试验,但皮肤病学研究研讨会的最新进展中还包括检查特应性皮炎靶向临时性治疗新药的临床试验。特应性皮炎是年幼儿童极为常见的一种皮肤疾病。但儿童临床试验的一大顾虑是安全性,因此针对靶向白介素-4受体α的完全人源化单抗dupilumab的一项Ⅱ期、随机、双盲研究,以中重度特发性皮炎的成人患者为对象。这项研究纳入109例受试者,随机使用12周的dupilumab 300 mg(sc)或安慰剂,治疗长达16周后再进行安全性评估。将其中64例患者分为2组,每组32例,根据《特应性皮炎生活质量指数(QoLIAD)》量表测评,并对这一部分患者进行了分析。到第12周时,使用dupilumab患者的“湿疹部位及严重程度指数(EASI)”评分降幅明显高于使用安慰剂的患者。如图8所示,QoLIAD评分及视觉模拟量表中瘙痒的数字评级相应降低,也表明dupilumab具有明显优势。活性治疗组达到EASI 50%和EASI 75%缓解的患者比例分别为90.6%和68.8%,对照组分别为40.6%和12.5%,进一步证明了dupilumab治疗特应性皮炎的临床功效。此外,QoLIAD评分的变化与使用视觉模拟量表及标准化5-D量表的瘙痒评分变化相关。Dupilumab耐受性良好,不良事件总发生率为89.1%,而安慰剂组为83.3%,但严重不良事件发生率极低(1.8% vs 20.4%)。Dupilumab使用者的皮肤感染频率明显低于安慰剂使用者(5.5% vs 24.1%)。上述研究结果表明,dupilumab安全性和耐受性均较好,对特异性皮炎成人患者的生活质量具有明显改善作用。

图 8 Dupilumab或安慰剂治疗第12周时特应性皮炎和瘙痒视觉模拟评分中湿疹面积、严重程度指数、生活质量指数的百分比变化Figure 8 Percent change in the eczema area and severity index, quality of life index for atopic dermatitis and pruritus visual analog scale scores by week 12 of treatment with dupilumab or placebo
在为期4天的会议上,还讨论了银屑病、特应性皮炎以及累及皮肤和皮肤结构的其他疾病的更多临床试验。
编者注:本文来源于汤森路透“制药事务报告”
(2014年5月发布)
Developments in Clinical Trials: Applications of Big Data Method in Clinical Trials
Thomson Reuters
The complexity of drug development has been ever-increasing, while the big data era greatly speeds up the development of clinical trials. Data-focused highlights of novel dermatological trials, as well as real-life big data approaches and an insight on the new methodology of riskbased monitoring, are all discussed in this edition of Developments in Clinical trials. This review of clinical research reports on novel therapies for psoriasis and atopic dermatitis revealed the impact of these diseases . The drug candidates that have been successful in phase II and III studies were also introduced.
big data; clinical trial; real-time monitoring; psoriasis; atopic dermatitis
R969
A
1001-5094(2014)11-0868-06

