硝苯地平-海藻酸钠骨架缓释片的制备及处方工艺优化
汪洁,涂家生
(中国药科大学药剂教研室,江苏 南京 210009)
·药学研究· PHARMACEUTICAL RESEARCH
硝苯地平-海藻酸钠骨架缓释片的制备及处方工艺优化
汪洁,涂家生*
(中国药科大学药剂教研室,江苏 南京 210009)

目的:研制硝苯地平-海藻酸钠骨架缓释片并优化处方工艺。方法:以海藻酸钠为缓释骨架材料,乳糖为填充剂,硬脂酸镁为润滑剂,乙醇为黏合剂,湿法制粒并制备硝苯地平骨架缓释片。在处方单因素考察的基础上,选择对缓释片释放行为影响较大的3个处方因素——海藻酸钠用量、磷酸氢钙用量和海藻酸钠黏度,以累积释放度为指标,利用正交实验设计L9(34)对缓释片处方进行优化。考察制备的硝苯地平骨架缓释片的释放机制。将自制缓释片的体外释放行为和大鼠体内药动学与市售缓释片进行比较。结果:在3个处方因素中,磷酸氢钙用量对硝苯地平-海藻酸钠骨架缓释片的体外释放度影响最大,最佳处方组成为45%海藻酸钠、20%磷酸氢钙和黏度为105 mPa • s的海藻酸钠。处方优化的硝苯地平骨架缓释片体外释放行为符合一级动力学方程,属于Baker-Lonsdale球形扩散机制。与市售产品相比,自制缓释片的缓释效果更好;其经口给予大鼠后,硝苯地平的tmax明显延长,药物作用时间延长及生物利用度提高。结论:自制的硝苯地平-海藻酸钠骨架缓释片具有明显的缓释效果,并优于市售产品。
硝苯地平;海藻酸钠;骨架缓释片;处方优化;体外释放;药动学
硝苯地平是临床上治疗高血压的首选药物之一,其不足之处是半衰期较短和有显著的肝脏首过效应,因此,患者需频繁用药,导致血药浓度波动大,且易引发头痛、面部潮红和心率加速等不良反应[1-2]。为提高患者顺应性和生物利用度,硝苯地平宜被设计制成缓控释制剂。
海藻酸分子是由甘露糖醛酸(M) 和古洛糖醛酸(G) 2种单体组成的嵌段线性聚合物。而海藻酸钠具有pH敏感性和胶凝作用,可在极其温和的条件下形成凝胶,当有二价阳离子(如Ca2+)存在时,G单元上的Na+可与二价阳离子发生离子交换反应,致使G单元堆积形成交联网络结构,从而形成水凝胶[3-6]。海藻酸钠在制药工业中主要用作黏合剂、崩解剂和缓释材料[7]。本文以海藻酸钠作为凝胶骨架材料制备了硝苯地平-海藻酸钠缓释片,并采用正交实验设计优化处方,且将最佳处方制得的缓释片的体外释放行为及大鼠体内药动学数据与市售产品进行比较。
1 材料
1.1 仪器
BZJ-360M II旋转压片机(上海立森机械仪器有限公司);752紫外可见分光光度计(上海精密科学仪器有限公司);ZRS-8R智能溶出试验仪(天津天大天发科技有限公司);BHX型电热恒温鼓风干燥箱 (南京科尔仪器设备有限公司)。
1.2 试药与试剂
硝苯地平(纯度大于98.0%,批号:1209001,陕西西岳制药有限公司);尼群地平(纯度大于99%,批号:10122101, 陕西九源生物科技有限公司 );海藻酸钠 ( 青岛黄海制药有限责任公司);乳糖(德国美剂乐集团);硬脂酸镁(安徽山河药用辅料股份有限公司);微晶纤维素(旭化成有限公司);淀粉(安徽山河药用辅料股份有限公司);伲福达(市售硝苯地平缓释片,规格:20 mg/片,批号:1305102,青岛黄海制药有限责任公司)。其他试剂均为分析纯;实验用水为双蒸水。
1.3 实验动物
SD大鼠,雄性,体质量(250±20) g,动物合格证号:scxk(苏)2013-0011。
2 方法
2.1 硝苯地平-海藻酸钠骨架缓释片的制备
依据每片质量为200 mg的处方,每片含硝苯地平20 mg,并以海藻酸钠作为缓释材料,乳糖作为填充剂,硬脂酸镁作为润滑剂;此外,鉴于海藻酸钙的凝胶强度高于海藻酸钠,故在处方中加入了磷酸氢钙,其可与海藻酸钠反应而形成海藻酸钙。在避光条件下,取处方量硝苯地平,粉碎,过110 目筛备用;辅料过80目筛,原辅料按处方比例等量递增混合,50%乙醇制软材,过20目筛,制粒;制得的湿颗粒,于60 ℃干燥2 h,过18目筛,整粒,采用7 mm冲头压制成片,片剂硬度控制在8~10 kg。
2.2 缓释片释放度和释放曲线的测定与相似因子法评价
按照释放度测定法(中国药典2010年版二部附录X D第一法),采用溶出度测定法第一法装置,在避光条件下,测定缓释片释放度,释放介质为pH6.8的磷酸盐缓冲液(含0.3%的吐温80)900 mL(经脱气),转篮转速为100 r·min-1,温度为(37±0.5)℃,在各设定时间点吸取溶出液10 mL,并及时补加37 ℃等量新鲜介质;每次吸取的溶出液经滤过,取续滤液作为供试品溶液,用紫外可见分光光度计于333 nm处测定吸收度,计算缓释片在不同取样时间点的累积释放百分率,以累积释放百分率为纵坐标,时间为横坐标,绘制释放曲线[8]。
采用相似因子法评价不同缓释制剂间释放曲线的差异,其计算公式[9]如下:

其中,n为取样时间点数,Wt为权重因子,Rt和Tt分别为t时刻参比制剂和受试制剂的释放度,f2值则用于表征受试制剂与参比制剂之间释药行为的近似程度。若f2=100,表明受试制剂与参比制剂的两条释放曲线完全相同;若f2趋近于0,便表明这两条释放曲线近似程度降低。一般认为,当50≤f2≤100时,两种制剂具有相似的体外释放度。
2.3 处方单因素试验
按照“2.1”项下方法,制备硝苯地平缓释片。其间,分别以海藻酸钠黏度(24、105、272和339 mPa·s)、海藻酸钠用量(用质量分数表示,30%、40%和50%)、海藻酸钠与磷酸氢钙的用量比(用质量比表示,1 : 1、1.5 : 1、2 : 1和2.5 : 1)、填充剂的种类[微晶纤维素PH101(MCC PH101)、MCC PH102、乳糖和淀粉]和作为黏合剂的乙醇浓度(用体积分数表示, 30%、50%、70%和90%)为变量,进行处方单因素试验,考察这些变量因素对所制备的缓释片释药行为的影响。
2.4 正交实验
依据处方单因素试验结果,采用正交实验进一步筛选处方。以海藻酸钠为主要缓释材料,乳糖为填充剂,选择对硝苯地平缓释片体外释放度影响较大的3个因素:海藻酸钠的用量(A)、磷酸氢钙的用量(B)和海藻酸钠的黏度(C),按正交设计L9(34)表作3因素3水平的实验筛选[10]。采用综合评分法,对各处方缓释片于2、4、10 h等3个时间点的释放度进行评分,将评分结果进行加权相加后得出总分,最后采用直观分析法进行分析。2、4和10 h累积释放率(D%、E%和F%)分别以30%、60%和85%为基准,它们的权重系数定为1,得到计算公式:G=丨D-30丨×l+丨E-60丨×l+丨F-85丨×l,G值越小,因素的水平数越佳。根据正交实验设计的因素水平(见表1),对各因素分配正交表,得出9个实验处方,以G值为评价指标,筛选缓释片的最佳处方组成。

表1 正交实验因素水平表Table 1 Factors and levels of orthogonal test
2.5 缓释片制备工艺重现性考察
按最佳处方组成和“2.1”项下方法连续制备3批次硝苯地平缓释片样品,并按“2.2”项下方法测定其释放度和释放曲线,考察缓释片制备工艺的重现性。
2.6 缓释片释放机制考察
目前评价药物缓控释制剂释放机制的数学模型主要有零级动力学方程(Q=Kt)、一级动力学方程[Q=1-exp(-Kt)]、Hixson-Crowell溶 蚀 方 程 [(1-Q)1/3=1-Kt]、Higuchi平面扩散模式方程(Q=Kt1/2)、Baker-Lonsdale球形扩散模式方程{3/2[1-﹙1-Q﹚2/3]-Q=Kt}和Ritger-Peppas方程(Q=Ktn),式中,Q为累积释放百分率,K为释放速率常数,t为时间,n为扩散指数。将硝苯地平-海藻酸钠骨架缓释片体外释放实验所得数据代入上述各方程,进行拟合,初步分析其释放机制。
2.7 自制与市售缓释片的比较
2.7.1 释放行为比较 测定按最佳处方制得的硝苯地平-海藻酸钠骨架缓释片与市售缓释片伲福达的释放度和释放曲线,并进行比较。
2.7.2 药动学比较 取SD大鼠10只,随机平均分为2组,即受试制剂(自制缓释片,T)组和参比制剂(市售缓释片,R)组。各组动物在经口给药前均禁食12 h,并分别于给药后0.5、1、2、3、4、6、8、12、16、24、36 h,从眼底静脉丛取血0.5 mL,置于涂有肝素钠的试管中,于4 ℃,5 000 r·min-1离心10 min,取上层血浆备用;取血浆样品200 µL,加入尼群地平内标溶液(10 mg·L-1)20 µL,再加入乙腈400 µL,涡旋混合1 min,12 000 r·min-1离心10min,转移上层清液,置于EP管中,40 ℃真空干燥,用100 µL流动相重溶,涡旋3 min,5 000 r·min-1离心15 min,取上清进行液相色谱分析。采用统计矩原理对体内数据进行非模型化分析,应用Kinetica 4.4软件对受试制剂及参比制剂的体内数据进行分析[11]。
3 结果
3.1 海藻酸钠黏度对硝苯地平-海藻酸钠骨架缓释片释放行为的影响
在处方单因素试验中,用不同黏度海藻酸钠制得的硝苯地平缓释片释放曲线(见图1)及以24 mPa·s的海藻酸钠制备的缓释片作为参比制剂、其他黏度的海藻酸钠制备的缓释片为受试制剂而计算得到的f2值(见表1)表明,海藻酸钠的黏度越高,所制得的缓释片释放速率越缓慢,即由低黏度海藻酸钠制得的缓释片释放速率较快,而海藻酸钠的黏度过高,则会导致制得的缓释片累积释放度过低。因此,用于制备缓释片的海藻酸钠黏度宜在105~272 mPa·s之间。

图1 不同黏度海藻酸钠制得的硝苯地平缓释片释放曲线 (n=6)Figure 1 Release curves of nifedipine sustained-release tablets prepared using sodium alginate with different viscosities
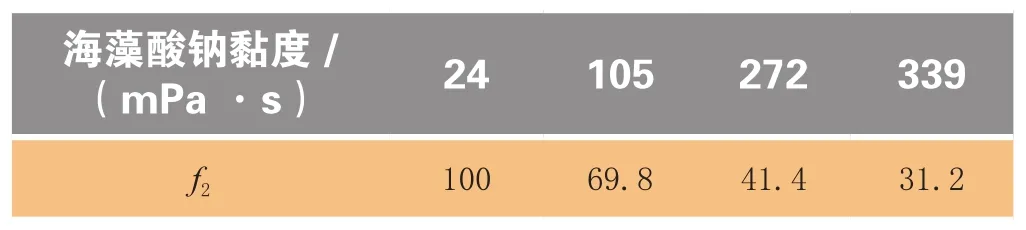
表2 不同黏度海藻酸钠制得的硝苯地平缓释片释放曲线f2值Table 2 f2values of release curves of nifedipine sustained-release tablets prepared using sodium alginate with different viscosities
3.2 海藻酸钠用量对硝苯地平-海藻酸钠骨架缓释片释放行为的影响
在处方单因素试验中,海藻酸钠不同用量制得的硝苯地平缓释片释放曲线(见图2)及以用量为30%的海藻酸钠制备的缓释片作为参比制剂、其他用量的海藻酸钠制备的缓释片为受试制剂而计算得到的f2值(见表3)表明,海藻酸钠用量对缓释片释放行为有显著影响,即随着海藻酸钠用量的增加,所制得的缓释片释放速率变慢。这是由于片剂中海藻酸钠含量的增加,导致片剂水化速率加快,凝胶层增厚,从而使片剂释放速率趋于缓慢。

图2 海藻酸钠不同用量制得的硝苯地平缓释片释放曲线 (n=6)Figure 2 Release curves of nifedipine sustained-release tablets prepared using different amounts of sodium alginate

表3 海藻酸钠不同用量制得的硝苯地平缓释片释放曲线f2值Table 3 f2values of release curves of nifedipine sustained-release tablets prepared using different amounts of sodium alginate
3.3 海藻酸钠和磷酸氢钙的用量比对硝苯地平-海藻酸钠骨架缓释片释放行为的影响
在处方单因素试验中,海藻酸钠和磷酸氢钙以不同用量比制得的硝苯地平缓释片释放曲线(见图3)及以用量比为1:1的海藻酸钠和磷酸氢钙制备的缓释片作为参比制剂、其他用量比的海藻酸钠和磷酸氢钙制备的缓释片为受试制剂而计算得到的f2值(见表4)表明,海藻酸钠和磷酸氢钙的用量比较高时,所制得的缓释片前期释放速率特快;而海藻酸钠和磷酸氢钙的用量比过低,则会导致制得的缓释片在前1 h几乎不释放药物。这是由于海藻酸钠与Ca2+能形成海藻酸钙,而海藻酸钙的凝胶强度高于海藻酸钠。由此可见,海藻酸钠和磷酸氢钙的用量比宜为2:1左右。

图3 不同用量比的海藻酸钠和磷酸氢钙制得的硝苯地平缓释片释放曲线 (n=6)Figure 3 Release curves of nifedipine sustained-release tablets prepared using different ratios of sodium alginate and CaHPO4

表4 不同用量比的海藻酸钠和磷酸氢钙制得的硝苯地平缓释片释放曲线f2值Table 3 f2values of release curves of nifedipine sustainedrelease tablets prepared using different ratios of sodium alginate and CaHPO4
3.4 填充剂的选择
在处方单因素试验中,使用不同种类填充剂制得的硝苯地平骨架缓释片释放曲线(见图4)及以乳糖为填充剂制备的缓释片作为参比制剂、其他种类填充剂制备的缓释片为受试制剂而计算得到的f2值(见表5)表明,用微晶纤维素作为填充剂制备的缓释片第1 h内几乎无释放,这是因为微晶纤维素为水不溶性填充剂,用其制备的缓释片在释放介质中开始时很难吸水形成凝胶,导致药物释放非常缓慢,而之后4 h内释放加快;虽然淀粉作为填充剂制备的缓释片其释放行为较好,但在实际操作中该类缓释片的可压性较差,压力调至最大时硬度为4 kg左右,且重现性差。故综合考虑,选用乳糖作为填充剂。

图4 不同种类填充剂制得的硝苯地平缓释片释放曲线(n=6)Figure 4 Release curves of nifedipine sustained-release tablets prepared using different fillers

表5 不同种类填充剂制得的硝苯地平缓释片释放曲线f2值Table 5 f2values of release curves of nifedipine sustainedrelease tablets prepared using different fillers
3.5 黏合剂的选择
在处方单因素试验中,使用不同浓度乙醇作为黏合剂制得的硝苯地平骨架缓释片释放曲线(见图5)及以50%乙醇为黏合剂制备的缓释片作为参比制剂、其他浓度乙醇为黏合剂制备的缓释片为受试制剂而计算得到的f2值(见表6)表明,使用不同浓度乙醇作为黏合剂制得的缓释片释放曲线f2值均大于50,即各释放曲线相似。可见,作为黏合剂的乙醇其浓度对制得的缓释片释放行为没有明显的影响,这也许是因为黏合剂在片剂处方中所占的比重很小。此外,试验发现,在制粒过程中,30%乙醇可使湿材迅速凝胶化,黏度增大,导致原辅料湿度不易均匀且过筛困难,干燥后颗粒硬度大;而用70%和90%乙醇制得的颗粒易脆碎,粒度分布不均。故选用50%乙醇作为黏合剂。

图5 不同浓度乙醇作为黏合剂制得的硝苯地平缓释片释放曲线 (n=6)Figure 5 Release curves of nifedipine sustained-release tablets prepared using different concentrations of ethanol as an adhesive

表6 不同浓度乙醇作为黏合剂制得的硝苯地平缓释片释放曲线 f2值Table 6 f2values of release curves of nifedipine sustainedrelease tablets prepared using different concentrations of ethanol as an adhesive
3.6 正交设计优化处方
正交实验中,极差R反映的是设定的各因素对规定的评价指标的影响程度,其数值越大,表明影响程度越大。实验结果显示,本文所选择的3个因素其R值排序为B>C>A,说明因素B即磷酸氢钙在处方中的用量对缓释片释放度影响最大;依据评价指标G值,各因素的水平优劣排序分别为:因素A水平3>1>2、因素B水平2>3>1及因素C水平1>2>3,故硝苯地平-海藻酸钠骨架缓释片最佳处方组成为A3B2C1(见表7)。

表7 正交实验结果Table 7 Result of orthogonal test
3.7 缓释片制备工艺重现性
按正交实验所得最佳处方制备的3批次硝苯地平-海藻酸钠骨架缓释片释放曲线见图6。

图6 优化处方制备的3批次硝苯地平缓释片释放曲线(n=6)Figure 6 Release curves of three batches of nifedipine sustained-release tablets prepared using the optimized formulation
由图6可见,制备的3批次硝苯地平缓释片具有明显的缓释效果,且以第1批次样品为参比制剂、第2、3 批样品为受试制剂而计算得到的f2值分别为94.37和94.79,而第2与第3批样品的释放曲线间f2值为89.02,说明样品批间差异小,重现性良好。
3.8 硝苯地平-海藻酸钠骨架缓释片释放机制
将硝苯地平-海藻酸钠骨架缓释片释放曲线分别用各种数学模型进行拟合后,根据r接近1的程度判断,该硝苯地平缓释片的释放行为更符合Baker-Lonsdale球形扩散模式方程,其次符合一级动力学方程(见表8)。说明,该硝苯地平缓释片的释药速度主要由药物的扩散速率决定,且符合一级释放。

表8 硝苯地平缓释片释放曲线的数学模型拟合结果Table 8 fitting results of release curve of nifedipine sustained-release tablets by mathematical models
3.9 自制与市售缓释片的比较
3.9.1 释放行为比较 将自制的硝苯地平-海藻酸钠骨架缓释片与市售硝苯地平缓释片伲福达的释放曲线进行比较发现,到8 h时,伲福达已释放完全,而自制缓释片才释放75%左右,且之后缓慢释放,12 h累计释放度达90%(见图7)。可见,自制缓释片比市售缓释片的缓释效果更好。

图7 自制与市售的硝苯地平缓释片释放曲线比较(n=6)Figure 7 Comparison of release curves of the homemade and the commercially available nifedipine sustainedreleased tablets
3.9.2 药动学比较 大鼠实验中,T组和R组大鼠的血药浓度[C/(mg·L-1)]-时间(t/h)曲线见图8;两组大鼠药动学数据经Kinetica 4.4软件的非房室模型拟合(NCA)见表9。

图8 两组大鼠的血药浓度-时间曲线(n=5)Figure 8 Plasma concentration-time curves from rats in 2 groups

表9 两组大鼠的主要药动学参数( x±s, n=5)Table 9 Main pharmacokinetic parameters from rats in 2 groups
4 讨论
高分子骨架缓释片是缓释剂型的一种,具有制备方法简便易行、工艺参数易于调控等优点,得到了广泛的应用。本文以海藻酸钠作为凝胶骨架材料制备的硝苯地平-海藻酸钠缓释片成型性好,体外释放行为符合拟定的释药要求,且硝苯地平体外释放分析方法的线性关系、精密度、回收率均符合要求。由正交试验可见,处方中磷酸氢钙的用量对该缓释片影响最大。从体外释放曲线来看,该缓释片的缓释效果优于市售产品,释放度重现性良好。大鼠体内药动学数据显示,与市售产品相比,该缓释片经口给药后,tmax明显延长,药物作用时间延长及生物利用度提高。
[1]余裕炳,涂家生.硝苯地平骨架型和膜控型缓释微丸的制备及比较[J].药学与临床研究,2010,18(3):235-238.
[2]Kambere Amerigos Daddy J C, Lü Y, Zhao H, et al. Modulating the nifedipine release from sustained release matrix tablets using hydrophilic polymers[J]. J Pharm Res,2013,32(6):314-320.
[3]仲静洁,王东凯,张翠霞,等.海藻酸钠在药物制剂中的研究进展[J].中国新药杂志,2007,16(8):591-593.
[4]Mandal S, Basu S K, Sa B. Ca2+ion cross-linked interpenetrating network matrix tablets of polyacrylamide-grafted-sodium alginate and sodium alginate for sustained release of diltiazem hydrochloride[J]. Carbohydr Polym,2010,82(3):867-873.
[5]Bagre A P, Jain K, Jain N K. Alginate coated chitosan core shell nanoparticles for oral delivery of enoxaparin: in vitro and in vivo assessment[J]. Int J Pharm,2013,456(1):31-40.
[6]Yang J S, Xie Y J, He W. Research progress on chemical modification of alginate: a review[J]. Carbohydr Polym,2011,84(1):33-39.
[7]盘茂东,李嘉诚,林强,等.海藻酸钠在药物控释中的应用[J].药学专论,2008,17(19):3-4.
[8]Mudie D M, Amidon G L, Amidonk G E. Physiological parameters for oral delivery and in vitro testing[J]. Mol Pharm,2010,7(5):1388-1405.
[9]Li L, Wang L, Shao Y, et al. Drug release characteristics from chitosan–alginate matrix tablets based on the theory of self-assembled film[J]. Int J Pharm,2013,450(1/2):197-207.
[10]祝侠丽,贾永艳,黄海英,等.正交设计法优化布洛芬缓释骨架片的处方工艺[J].中国药房,2014,25(90):830-832.
[11]陈军,尹伟.硝苯地平亲水凝胶骨架缓释片的体内外相关性研究[J].临床医学工程,2012,19(3):345-347.
Preparation of Nifedipine-Sodium Alginate Sustained-Release Matrix Tables and Optimization of Their Formulation
WANG Jie, TU Jiasheng
( Department of Pharmaceutics, China Pharmaceutical University, Nanjing 210009, China)
Objective:To prepare nifedipine- sodium alginate sustained-release matrix tablets and to optimize their formulation. Methods: The nifedipine sustained-release matrix tablets were prepared with sodium alginate as the matrix, lactose as the filler, magnesium stearate as the lubricant and ethanol as the adhesive by a wet granulation compression method. On the basis of single-factor investigation and taking cumulative release percentage degree as index, the formulation of the tablets was optimized by L9(34) orthogonal test design for 3 factors——amount of sodium alginate, amount of calcium perphosphate and viscosity of sodium alginate—— significantly affecting the release behavior of the tablets. And the releasing mechanism of the tablets was investigated. The comparison between the homemade and the commercially available nifedipine sustainedrelease tablets in in vitro release behavior and in vivo pharmacokinetics in rats was made. Results: Among the 3 factors, the amount of calcium perphosphate showed the biggest impact on the in vitro release percentage degree of the homemade tablets. The most desirable formulation included 45% sodium alginate, 20% calcium perphosphate and a viscosity of 105 mPa • s for sodium alginate. The in vitro release of the homemade tablets with the optimized formulation followed first order kinetics and belonged to the Baker-Lonsdale spherical diffusion mechanism. Compared with the commercially available product, the sustained-release effect of the homemade tablets was better and the in vivo tmaxof nifedipine was prolonged significantly after the homemade tablets were orally administrated in rats, suggesting that the acting time was longer and the bioavailability was improved for the drug. Conclusion: the homemade nifedipine- sodium alginate sustained-release matrix tablets can significantly prolong drug-release time and are superior to the commercially available product.
nifedipine; sodium alginate; sustained-release matrix tablet; formulation optimization; in vitro release; pharmacokinetics
R943; R972.4
B
1001-5094(2014)11-0841-07
接受日期:2014-10-20
*通讯作者:涂家生,教授,博士生导师;
研究方向:药物新剂型与新制剂;
Tel:025-83271305; E-mail: jiashengtu@ aliyun.com

