利多卡因对肺缺血再灌注损伤模型大鼠炎症反应因子的影响
倪程耀,陈 新,吴胜军(浙江大学医学院附属第一医院,杭州 310003)
肺缺血再灌注损伤(Lung ischemia reperfusion injury,LIRI)常发生在体外循环手术、肺移植、肺栓塞治疗恢复血液供应后,是在缺血的基础上机体继发的再灌注损伤,会导致患者临床症状不减轻反而加重的病理状态,是危害患者恢复健康的重要障碍[1]。随着人们对LIRI发病机制的深入研究,已应用多种药物治疗LIRI,并取得了良好的效果。利多卡因作为一种膜稳定剂,广泛地应用于多种疾病的治疗,现研究认为其能保护肺泡上皮细胞的功能,可减轻肺损伤[2]。因此本研究应用大鼠建立LIRI模型,体外给予利多卡因干预,观察其对LIRI的保护作用。
1 材料
1.1 仪器
DH-150型动物呼吸机(浙江大学医学仪器厂)。
1.2 药品与试剂
利多卡因注射液(江苏济川制药有限公司,批号:080531,规格:40 mg ∶5 ml);苯巴比妥钠注射液(广东邦民制药有限公司,批号:041042,规格:100 mg ∶1 ml);肿瘤坏死因子α(TNF-α)、白细胞介素(IL)-1、IL-6和IL-8检测试剂盒(美国eBioscience公司)。
1.3 动物
2 方法
2.1 建模
大鼠经耳缘静脉注射30 mg/kg的苯巴比妥钠麻醉,气管切开后插管,接动物呼吸机控制呼吸,呼吸频率60次/min,潮气量单侧肺通气8~10 ml/kg,双侧肺通气15~20 ml/kg,呼吸比1 ∶2。然后经胸骨右缘第3~5肋间开胸,离断周围组织,游离左肺门,呼气末时结扎右肺门,60 min后开放行再灌注,制成LIRI模型。
2.2 分组与给药
取90只大鼠随机均分为假手术组、模型组和预处理组,每组30只。模型组大鼠行左肺缺血再灌注,即开胸游离左肺门后,阻断左肺门60 min,而后松开血管夹形成再灌注;假手术组大鼠只开胸而不行左肺缺血再灌注;预处理组大鼠术前15 min注射利多卡因1.2 mg/kg,并以1 mg/(kg·h)维持30 min,阻断左肺门60 min,而后松开血管夹形成再灌注。
2.3 标本采集与指标检测
各组大鼠于缺血30 min和再灌注60、120 min时采集标本。采集大鼠支气管肺泡灌洗液,采用考马斯亮蓝染色法对其蛋白总量(TP)进行测定;收集支气管肺泡灌洗液沉渣,计数白细胞(WBC)数量,并采用瑞氏染色进行白细胞分类,计算中性粒细胞(PMN)比例;取一定的肺组织,应用天平称量其湿质量(W),置于70 ℃烤箱烘烤48 h后,测量其干质量(D),计算肺组织的湿/干质量(W/D)比值;取肺组织配制成10%的组织匀浆,采用酶联免疫吸附双抗体夹心法(ELISA)检测肺组织匀浆中TNF-α、IL-1、IL-6、IL-8含量,操作步骤严格按照试剂盒说明书进行。
2.4 统计学方法
3 结果
3.1 TP、WBC数量、PMN比例、W/D比值结果
与假手术组比较,模型组大鼠再灌注60、120 min时和预处理组再灌注120 min时TP、WBC数量、PMN比例、W/D比值均明显升高,差异具有统计学意义(P<0.05);与模型组比较,预处理组大鼠再灌注60、120 min时TP、WBC数量、PMN比例、W/D比值均明显降低,差异具有统计学意义(P<0.05)。各组大鼠肺泡灌洗液中TP、WBC数量、PMN比例和W/D比值比较见表1。
表1 各组大鼠肺泡灌洗液中TP、WBC数量、PMN比例和W/D比值比较(,n=10)Tab 1 Comparison of TP,WBC,PMN proportion andW/D in bronchoalveolar lavage fluid in each group rats(,n=10)

表1 各组大鼠肺泡灌洗液中TP、WBC数量、PMN比例和W/D比值比较(,n=10)Tab 1 Comparison of TP,WBC,PMN proportion andW/D in bronchoalveolar lavage fluid in each group rats(,n=10)
与假手术组比较:*P<0.05;与模型组比较:#P<0.05vs.sham operation group:*P<0.05;vs.model group:#P<0.05
3.2 TNF-α、IL-1、IL-6及IL-8含量结果
与假手术组比较,模型组大鼠再灌注60、120 min时和预处理组再灌注120 min时肺组织匀浆中TNF-α、IL-1、IL-6及IL-8含量均明显升高,差异具有统计学意义(P<0.05);与模型组比较,预处理组大鼠再灌注60、120 min时肺组织匀浆中TNF-α、IL-1、IL-6及IL-8含量均明显降低,差异具有统计学意义(P<0.05)。各组大鼠肺组织匀浆中TNF-α、IL-1、IL-6及IL-8含量比较见表2。
表2 各组大鼠肺组织匀浆中TNF-α、IL-1、IL-6及IL-8含量比较(,pg/ml,n=10)Tab 2 Comparison of the contents of TNF-α,IL-1,IL-6 and IL-8 in lung tissue homogenate in each group rats(,pg/ml,n=10)
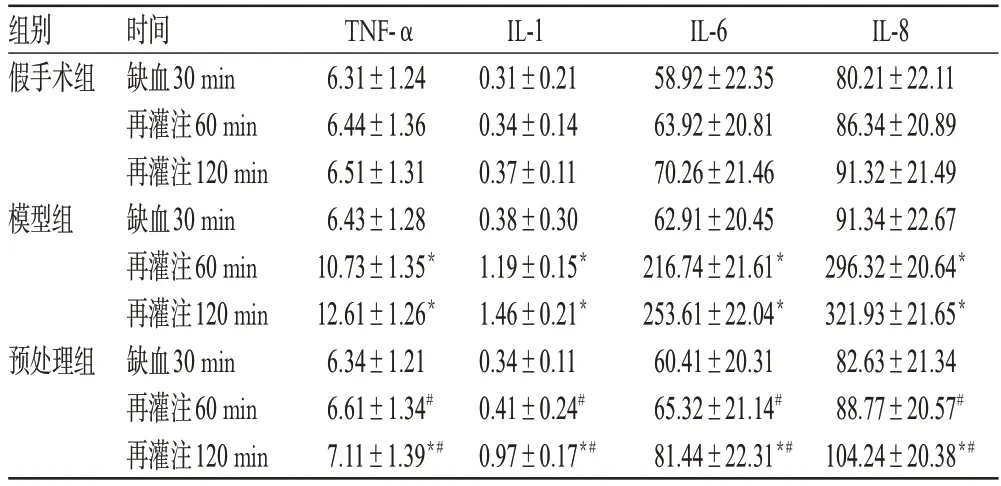
表2 各组大鼠肺组织匀浆中TNF-α、IL-1、IL-6及IL-8含量比较(,pg/ml,n=10)Tab 2 Comparison of the contents of TNF-α,IL-1,IL-6 and IL-8 in lung tissue homogenate in each group rats(,pg/ml,n=10)
与假手术组比较:*P<0.05;与模型组比较:#P<0.05vs.sham operation group:*P<0.05;vs.model group:#P<0.05
4 讨论
近年来,由于LIRI的存在使应用心肺置换术、心肺转流术等的心肺疾病晚期患者临床症状加重,成为术后恢复健康的重要障碍。有报道称,肺移植术后因LIRI导致的死亡率高达16%~25%,严重影响了患者的生命健康,是临床亟需解决的问题[3]。有关LIRI的发病机制至今不明,但多数研究认为其与以下因素有关:氧自由基的释放、脂质过氧化反应、钙稳态的失衡、炎性物质的浸润、免疫因素的干扰及细胞凋亡[4]。其中,免疫因素的干扰占有举足轻重的地位。
免疫因素可通过以下途径参与到LIRI的发病机制中:(1)炎性细胞因子与相应受体结合,激活溶酶体使其溶解消化肺组织;(2)刺激血管内皮细胞分泌黏附分子,增加WBC的黏附作用及聚集作用;(3)刺激巨噬细胞分泌趋化性因子,加重炎症反应,可使PMN大量聚集,导致细胞坏死,释放过氧化物和溶酶体酶等,加剧免疫反应,从而导致肺组织损伤[5-7]。已有研究表明,在LIRI后的肺泡灌洗液中,TNF-α、IL-1、IL-6及IL-8含量显著高于血浆中水平,提示了免疫反应在LIRI方面的重要性[8]。从本研究可以看出,模型组大鼠W/D比值及肺泡灌洗液中WBC数量、PMN比例及TP明显高于假手术组(P<0.05),说明在再灌注中确实存在肺组织损伤及WBC与PMN的聚集。随着再灌注时间的推移,损伤及聚集作用随疾病进展逐渐加剧。模型组大鼠中再灌注60、120 min时肺组织匀浆中TNF-α、IL-1、IL-6、IL-8含量明显高于假手术组(P<0.05),验证了炎性细胞因子参与了LIRI的发病机制,并且肺组织匀浆炎性因子含量随疾病的进程相应增加,说明炎性因子随疾病进展存在着相对应的变化。这一研究结果与国内相关研究[9-10]基本吻合,均提示免疫因素在LIRI疾病中起着重要作用。
随着人们对LIRI发病机制研究的逐步深入,可应用多种内、外源性的化学物质对LIRI进行治疗,从而达到保护肺的作用。其治疗药物根据不同的机制可分为以下几类:(1)抗氧化剂或抗氧化酶,如胆红素、黄酮类、氨溴索;(2)抑制细胞核因子κB(NF-κB)信号通路因子,如抗炎性因子、山莨菪碱、前列腺素E1等;(3)通过信号分子途径,如吸入一氧化氮及一氧化碳、乌司他丁、黄酮化合物等;(4)炎症因子和细胞黏附因子,如盐酸氨溴索、糖皮质激素、分泌型白细胞蛋白酶抑制剂、罗格列酮等[11]。其中,利多卡因被认为是膜稳定剂,可抑制中性粒细胞的炎性反应,通过多种途径来减轻LIRI并加大肺损伤的修复,其机制可归纳为以下几点:(1)稳定细胞膜,抑制炎性反应的各个环节;(2)促进肺泡上皮细胞生长,抑制肺泡上皮细胞凋亡[12]。从本研究结果可以看出,应用利多卡因一段时间后,大鼠W/D比值及肺泡灌洗液中WBC数量、PMN比例及TP明显低于模型组(P<0.05),肺组织匀浆TNF-α、IL-1、IL-6、IL-8含量也明显低于模型组(P<0.05),提示利多卡因可通过抑制炎症反应来减缓LIRI,从而改善肺组织损伤,符合国内外对利多卡因作用机制的研究。
综上所述,本实验建立在针对大鼠的LIRI模型上,在不同时间点上动态观察了免疫相关指标在疾病进程中的变化,并体外给予利多卡因,观察了免疫相关指标的变化。LIRI的主要病理改变为肺组织内皮的广泛破坏、肺毛细血管通透性的增加,从而导致肺泡和间质的水肿和损伤。其机制复杂,早期给予干预措施,可大大提高治愈率和预后恢复。本研究结果显示,免疫因素尤其是炎性细胞因子在LIRI的疾病进展中发挥了重要作用,利多卡因可通过抑制炎性反应来改善肺组织的损伤。本实验从炎性反应因子这一角度探讨了利多卡因改善LIRI的机制,为临床应用该药提供了理论依据,但其临床具体应用仍需进一步研究。
[1]基鹏,姜涛,李羽,等.大剂量辣椒素耗竭初级感觉传入神经对兔肺缺血再灌注损伤氧化应激的影响[J].四川大学学报:医学版,2014,45(2):245.
[2]周燕,游古莲,裘松波,等.阿替卡因与利多卡因在下颌牙慢性牙髓炎急性发作开髓术中的麻醉效果比较[J].中国药房,2013,24(48):4 543.
[3]王昕,陈莉芬,谭昌洪,等.枸杞多糖对脑缺血再灌注损伤模型大鼠的保护作用[J].中国药房,2014,25(15):1 365.
[4]贾玉晶,朱晓鹤,冯力,等.新型氮氧自由基对心脑缺血/再灌注损伤模型大鼠的保护作用研究[J].中国药房,2014,25(17):1 565.
[5]谭敬,朱宇麟,周荣胜,等.乌司他丁对肝大部切除合并缺血再灌注损伤后肝再生和能量代谢的影响[J].西安交通大学学报:医学版,2014,35(1):89.
[6]金健,朴尚国,金英顺,等.普伐他汀对大鼠肾缺血再灌注损伤的保护作用及其机制探讨[J].中华肾脏病杂志,2014,30(2):139.
[7]侯四川,高健刚,李奎,等.核转录因子NF-E2相关因子2在左卡尼汀减轻肾缺血再灌注损伤中的作用[J].中华肾脏病杂志,2014,30(1):60.
[8]王艳蕾,吴丽,李筠璐,等.七叶皂苷钠对肠缺血再灌注损伤大鼠p38MAPK信号通路的影响及其保护作用机制[J].吉林大学学报:医学版,2014,40(1):60.
[9]洪芬芳,张大雷,涂桂林,等.缺血预处理通过抑制白三烯C4生成减轻大鼠肝缺血再灌注损伤[J].中国病理生理杂志,2013,29(3):537.
[10]张良,代维,高志明,等.血必净注射液和丹参注射液治疗兔肢体缺血再灌注损伤的比较研究[J].重庆医学,2013,42(31):3 724.
[11]伊雪,王帅,邬鹏宇,等.莱菔硫烷预处理对大鼠移植心脏冷缺血再灌注损伤的影响[J].实用医学杂志,2013,29(23):3 850.
[12]朱小兵,刘志群,吴论,等.mito-KATP通道在利多卡因预先给药减轻大鼠肾脏缺血再灌注损伤中的作用[J].中华麻醉学杂志,2013,33(11):1 322.

