四川省医疗机构制剂的发展现状及对策探讨
谢 婷,王子寿,赵卫权,朱 芳,何韦静,徐 昊(.成都中医药大学,成都 60075;.四川省食品药品监督管理局,成都 6007)
医疗机构制剂具有制剂规模小、储存时间短、针对性强和使用及时与灵活等特点,长期以来受到医师和患者的好评,起着保证临床医疗需要、弥补市场药品不足、保障居民健康、促进新药开发和卫生事业发展的重要作用[1]。从类别来看,医疗机构制剂可分为中药制剂和化学药制剂2类。2005年6月,原国家食品药品监督管理局(SFDA)发布《医疗机构制剂注册管理办法(试行)》(简称《办法》),对全国的医疗机构制剂进行了清理、整顿、重新申报与审批。经过此次清理整顿,全国各省、市医疗机构制剂的数目均有所减少,医疗机构制剂配制的集中度也得到了提高,如上海市的医疗机构制剂批准文号从2000年的9 712个下降到了2008年的1 655个;北京市从2007年的4 503个降到了2010年的3 419个;江苏省也从2008年的5 862个下降到了2012年的4 274个。据了解,全国的医疗机构制剂室数量减少了44.70%;2005年与2010年相比,北京市的医疗机构制剂室从67家下降到了49家,上海市的医疗机构制剂室也从39家下降到了18家[2-4]。
经过此次清理整顿,截至2013年12月31日,四川省的医疗机构制剂共有2 989个,其中中药制剂2 441个(占81.67%),化学药制剂548个(占18.33%)。中药制剂作为药品的一种重要的补充形式,在四川省医疗机构制剂中具有较为明显的优势,为四川省的医疗卫生事业做出了较大贡献。但经分析表明,四川省医疗机构制剂在发展中仍存在低水平重复生产、降低质量标准要求、原辅料把关不严、关键岗位缺乏高级专业人才等问题,直接影响到了医疗机构制剂的质量,制约了其进一步发展。本文拟通过分析四川省食品药品监督管理局(简称“省局”)2010-2013年发布的医疗机构制剂批件信息(简称《省制剂批件信息》),了解四川省医疗机构制剂的发展现状,并结合医疗机构制剂与药品的注册特性对比,探讨四川省医疗机构制剂的可持续发展对策,为促进四川省医疗机构制剂的可持续发展提供参考。
1 四川省医疗机构制剂的发展现状
1.1 医疗机构制剂品种和数量较多、剂型发展不平衡
四川省从2005年开始对医疗机构制剂进行清理整顿、批准文号换发工作。2006年,四川省局发布的《关于做好医疗机构制剂换发批准文号工作的通知》中明确要求,要清理整顿和淘汰不合法规、不良反应(ADR)多、质量不可控的品种,规范医疗机构制剂名称、说明书,提高质量标准。从《省制剂批件信息》资料分析,四川省的2 989个医疗机构制剂中共有33种剂型,其中数量排名前6位的依次是丸剂(1 001个)、口服溶液(444个)、散剂(395个)、胶囊(355个)、颗粒剂(148个)、洗剂(136个),占全部医疗机构制剂的82.94%。
由于四川省是一个多民族地区,存在一些民族药制剂,目前普遍将其归入中药制剂。但民族药制剂的指导理论、用药药材与中药制剂存在一些差别,故单独列出来进行分析。在2 441个中药制剂中,甘孜、阿坝、凉山3个州的民族药制剂有1 229个,占全部中药制剂的50.35%。四川省民族药制剂有10种剂型,分别是搽剂、膏剂、合剂、酒剂、胶囊、丸剂、散剂、茶剂、涂剂、颗粒剂,所占数目较多的剂型有丸剂(895个)、散剂(263个)、胶囊(73个)。
化学药制剂对安全性要求较高,四川省的化学药制剂中没有注射类剂型,目前一共有22种剂型、548个制剂。化学药制剂按用药途径可分为口服、外用2类。外用途径包括18种剂型、352个制剂,占化学药制剂数的64.23%;口服途径包括4种剂型、196个制剂,占化学药制剂数的35.77%。
四川省医疗机构制剂室及制剂品种数的分布情况见表1。
1.2 医疗机构制剂质量标准拟定依据滞后、制剂室设施设备陈旧、部分命名不规范
医疗机构制剂的质量标准对保证其有效性、安全性非常重要,其质量标准的拟定应当参照2010年版《中国药典》、国家药品标准等。张芳等[5]曾对北京市医疗机构制剂的质量标准制定情况进行分析,发现其拟定依据显得较为落后,且部分项目实施有难度,如需统一增加无菌检查项,申报时需要提供药效、毒理以及临床研究资料等。在医疗机构制剂设备、设施方面,袁丽霞等[6]曾对济宁市的制剂室试验条件进行调查,将医疗机构制剂室与制药企业的设备配置进行对比,发现制药企业一般配有红外光谱仪、紫外分光光度计、气相色谱仪、液相色谱仪等高端精密仪器,而医疗机构制剂室则大多以天平、酸度计、细菌霉菌培养箱和恒温箱为主,设备、设施显得极为陈旧,导致很多制剂的含量测定项操作难以完成。如,药典要求用气相色谱仪检测复方薄荷脑滴鼻液中薄荷脑的含量,而很多医院并不具备这样的条件;加之一些医院制剂室并未对制剂处方中用量较大的成分进行充分研究,使得大部分中药制剂缺乏含量测定项指标。谢正福等[7]也曾对广东省的医疗机构制剂的质量标准进行了分析,发现部分医疗机构制剂的质量标准草案及起草说明不规范,部分检验项目的制定缺乏科学性,如缺少专属性检验、制剂稳定性试验资料。而上述情况在四川省医疗机构制剂的生产中同样存在。四川省医疗机构制剂在质量标准方面,多由市级食品药品检验所对本辖区的医疗机构制剂进行质量标准复核,并全面审查质量标准内容,审核检验方法的可行性、科学性、设定的项目能否控制质量等;但在医疗机构制剂命名方面还存在一些问题,如在医疗机构制剂再注册审核中发现,麦粒肿合剂、一号胶囊等命名不符合中国药品通用名称命名原则,类似情况应引起足够重视。
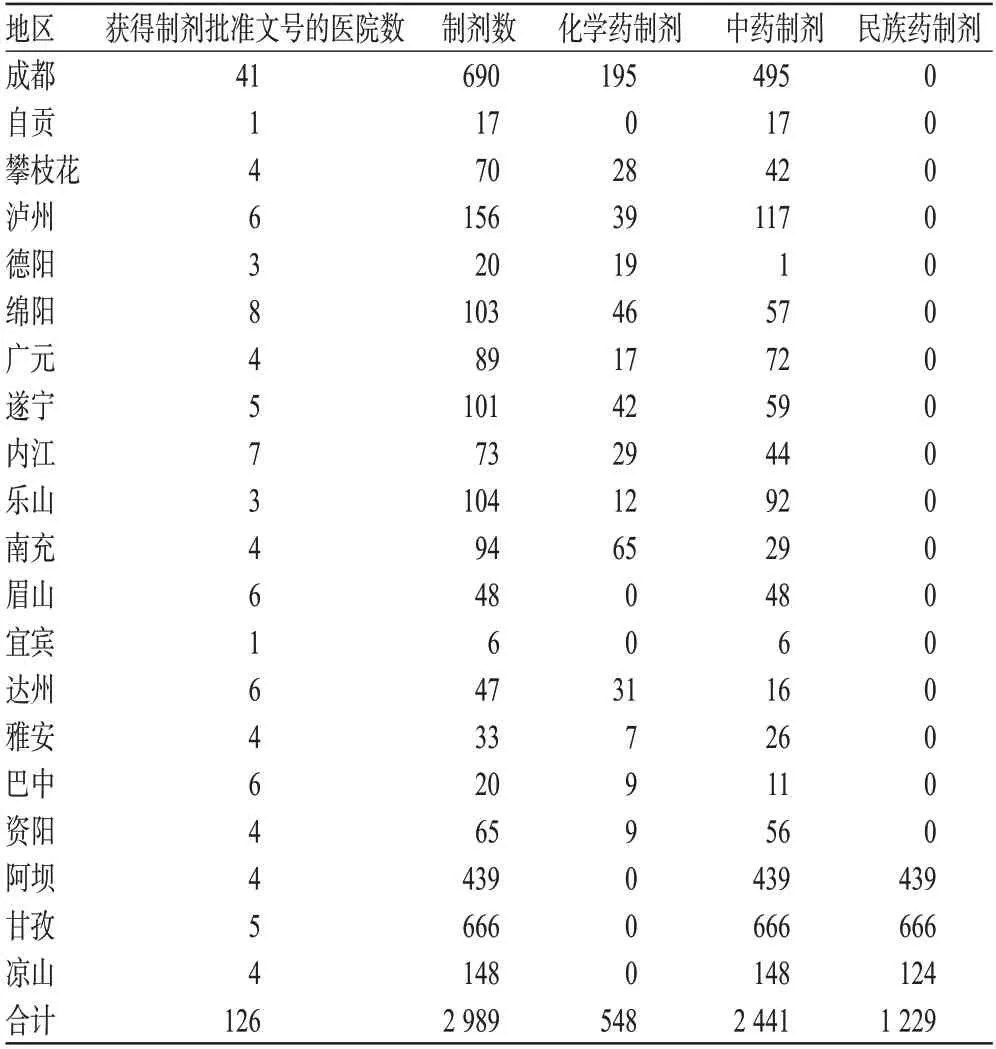
表1 四川省医疗机构制剂室及制剂品种数的分布情况Tab 1 Distribution of preparation departments and the number of preparation types in medical institutions of Sichuan province
2 医疗机构制剂与药品的注册特性对比
2.1 注册特性与分布
与药品注册要求相比,医疗机构制剂本身具有一定的特性。药品注册包括新药注册、仿制药申请、进口药申请等。新药是指未曾在国内上市销售的药品,其化学结构、药品组分和药理作用不同于国内现有的药品;仿制药是指已批准上市的已有国家标准的药品;进口药是指境外生产的药品。药品的处方以国家药监部门审核批准的处方为准,不得随意进行修改。根据《办法》规定,医疗机构制剂的注册品种应是市场上没有的品种,所含成分须已有国家标准,处方须为固定处方,即配制工艺成熟、长期用于临床某一病症的处方。
药品的分布除了“麻、精、毒、放”4类药品,其他药品是没有特定限制的;医疗机构制剂的分布存在一定的地域性。目前,四川省有18个市3个州配制医疗机构制剂,主要分布在成都市以及甘孜、阿坝、凉山3个州。由于地区经济发展不平衡,四川省的医疗机构规模、硬件设备配置不一,更多医药优秀人才集聚到发达地区的“三甲”医院,除甘孜、阿坝、凉山3个州的民族药制剂外,成都市的医疗机构制剂剂型、品种数大大超过其他市。除民族药制剂外,四川省2010-2013年共有1 760个制剂,成都市占39.20%,其次是泸州市,占8.86%。虽然民族药制剂数量大,分布集中,但是制剂工艺水平较低,主要是简单的丸剂、散剂,质量检验也大多只能做到薄层检验水平。
2.2 配制与使用范围
从类型而言,医疗机构制剂是医疗机构自配自用的固定处方制剂,包括中药制剂、化学药制剂,不包括变态反应原外的生物制品。药品的类型包括化学药、中药、生物制品3种。从生产使用看,医疗机构制剂须是本单位临床需要,而市场上没有供应的品种,包括配制和调剂2项内容。药品包括药品生产、药品进口以及药品销售3项内容。但由于医疗机构制剂使用的局限性,也就限制了医疗机构制剂的生产规模,导致医疗机构制剂配制原料药的取得不易,且价格相对药品要高,增加了医疗机构制剂生产成本,这也是造成四川省医疗机构制剂数量逐渐趋于萎缩的原因之一。
2.3 申报与审批的要求
现行《药品注册管理办法》(局令第28号)规定,药品注册需要进行合成工艺、稳定性、药理、毒理等一系列临床前研究,生物制品还要进行包括起始材料来源、质量标准、免疫学等研究。另外,所有新药注册必须进行临床试验。而《办法》规定,医疗机构制剂应当进行相应的临床前研究,包括处方筛选、配制工艺、质量指标、药理、毒理学研究等;中药制剂根据中医药理论组方、利用传统工艺配制、在该医疗机构使用达5年以上的,化学药制剂已有同品种获得批准文号的,可免报毒性、药效、临床等研究。可见,法规对医疗机构制剂的要求不及药品严格。
2.4 现场核查与生产现场检查
现行《药品注册管理办法》(局令第28号)第58、62条规定:对申请注册的药品,需要对其临床试验情况、原始资料的真实性等进行现场核查,同时抽样3批进行标准复核。审核通过后,由药品认证管理中心通知省食品药品检验所对药品批量生产过程进行现场检查,确定工艺可行性,同时抽样1批进行标准复核。进行2次标准复核,是为了确保药品的安全、稳定、质量可控。而《办法》第16、17条规定:应对医疗机构制剂申报资料的真实性、研制现场进行核查,同时抽样3批进行标准复核。经对比分析可发现,医疗机构制剂缺少了确定工艺可行性的批量生产过程的配制现场检查。从医疗机构制剂的质量角度看,小量生产与批量生产有差异,随着工艺规模的增大,是有可能出现医疗机构制剂质量变化的,笔者认为医疗机构制剂的监管在批量配制现场检查的缺失,不足以确保医疗机构制剂的安全、稳定、质量可控。
2.5 ADR收集
药品关于ADR收集方面有新药监测期的规定:5年之内,必须收集药品所有ADR信息,并每年上报省局。四川省医疗机构每年向其所在地区或市级食品药品监督管理局(简称“地、市局”)报告其医疗机构制剂当年的ADR情况,每3年再注册时向省局报告1次3年内ADR的收集情况。而各医疗机构所报医疗机构制剂的ADR报告大多很简略,有的甚至就一句“本制剂无ADR”之类的话,这在中药制剂中表现尤为明显。近年来,中药ADR事件频发,如鱼腥草注射液事件、草乌类毒剧药材引起的ADR事件等,这些事件告诉我们,必须重视中药的ADR,并进行严格监管、合理使用。《办法》第36条规定:撤销质量不稳定、疗效不确切、ADR大或其他危害人体健康的医疗机构制剂。省局根据《办法》要求,于2006-2008年撤销了394个医疗机构制剂的批准文号[8]。医疗机构制剂因其化学药制剂重复品种较多、使用广泛,中药制剂临床使用历史较久,在ADR收集方面,无论是医院还是药监部门的重视度都不够。笔者认为,四川省药监部门在医疗机构制剂的ADR监管方面还应当进一步加强,可参考药品ADR的监管制度,建立更为完善的制度,以督促医疗机构自觉、完整地收集关于本单位医疗机构制剂的所有ADR信息。
3 四川省医疗机构制剂的发展对策
医疗机构制剂中的中药制剂大多来自协定处方,是医疗机构经过长期医疗经验、结合当地疾病特点总结出来的、疗效较好的处方,大多延用多年,疗效确切,使用安全,往往是开发新药的良好途径。鉴于四川省医疗制剂中的中药制剂尤其是民族药制剂数量较多,为了进一步促进其可持续发展,笔者提出如下建议。
3.1 充分发挥中药制剂的特色优势,适应医疗卫生事业的发展需求
四川省医疗机构制剂中的中药制剂所占比例较大,且品种多、独具特色,政府相关部门应为其创造良好的申报环境,以促进优良中药制剂的可持续发展,适应医疗卫生事业发展的需求。同时,四川省的民族药制剂众多,因其制剂室设备较差、条件落后,但又是保障当地群众健康的主要药物来源,所以应给予必要的政策扶持,放宽申报要求或针对其特点进行调研,制定出更适宜申报的相关政策要求,协助其进行质量标准的制定等。另外,政府相关部门应制定政策,鼓励医疗机构将自身疗效较好、临床价值较高的医疗机构制剂开发成新药,以丰富市售药品,创造更大的经济价值,对创新型医疗机构制剂起到积极的鼓舞作用,确保其可持续发展。
3.2 强化医疗机构制剂的质量管理,确保安全、有效
四川省应借鉴北京、广东等地的管理经验,深入对医疗机构制剂特色的研究,构建由省、市、县医疗机构医药管理专家组成的医疗机构制剂研发平台,为四川省医疗机构制剂的发展献计献策。同时,充分利用四川省的中医药技术人才优势资源,针对医疗机构制剂的特点,研究和制定质量标准指导原则与技术要求,提高医疗机构制剂的质量。此外,建议对原料药来源进行地、市局备案制,规范原料药来源,从源头确保医疗机构制剂安全、有效;规范中药制剂生产、使用及ADR监测的监管行为,杜绝中药制剂上报ADR模糊、缺失的现象发生。
3.3 建立长期、完善的抽验检查制度,确保医疗机构制剂质量可控、安全、稳定
鉴于批量生产和小生产医疗机构制剂之间有可能出现质量不稳定因素,必须强化医疗机构制剂配制使用之前的抽样检查,确保医疗机构制剂质量的可控、安全、稳定。加强日常监督检查,由地、市局负责制定适合本区域医疗机构制剂良性发展的日常监督检查计划,对医疗机构制剂室在日常配制时起到监督约束作用,确保每批用于患者的医疗机构制剂都能体现其价格实惠、疗效优良、安全可靠的特点。
3.4 发挥医药资源与技术优势,构建区域制剂配制中心,提升医疗机构制剂发展能力与水平
医疗机构制剂区域配制中心,是在一定区域范围内以软、硬件条件优质的医疗机构制剂室为基础,整合区域内医疗机构制剂资源,建立的区域配制中心。其集中配制市场没有供应但临床需要的制剂,并在行政管理部门的批准和监督下为该区域内的医疗机构调剂供应所需医疗机构制剂。笔者认为,这是四川省医疗机构制剂发展的必然趋势。第一,构建四川省医疗机构制剂区域配制中心,以川东、川南、川北、川中(成都)、民族地区(甘孜州、阿坝州、凉山州)等为片区,遴选片区内医疗机构中制剂室设施设备好、品种数量多、专业技术力量强的医疗机构承担片区内医疗机构制剂的配制任务,确保医疗机构制剂的质量与需求。第二,建立医疗机构制剂区域配制中心,利于整合区域内的医疗机构制剂资源,可避免重复建设。第三,集中利用区域内最好的资源条件,使医疗机构制剂的配制能力和水平得到提升,能够更好地保证医疗机构制剂的质量。第四,区域内最佳条件下的集中配制,可降低区域内医疗机构制剂配制总的运营成本,也为区域配制中心的运营保证了稳定的市场,提高了医疗机构制剂的效益,促进了医疗机构制剂的良性发展。第五,整合信息资源,建立起临床、生产和药学研究一体的体系,互相促进,可为提高医疗机构制剂的水平和新药开发奠定基础。
3.5 实施医疗机构制剂室分类管理制度,有利于制剂室的规范与建设
针对一些规模较大、配制能力较强的三级医院,可加强其制剂室的建设,提高制剂室的配制水平,提高人才素质,建立重点制剂室。针对实力较弱的医院,可实行制剂室的小型化,精化设备、工艺,提高配制水平。对制剂室的监管实行重点制剂室、一般制剂室、区域中心制剂室的分类管理,可提高管理水平,促进医院配制疗效较好、质量可控、安全可靠的医疗机构制剂[9]。
4 结语
随着社会的进步与发展,人们越来越关注健康,医药的发展得到了社会的高度重视。医疗机构制剂作为药品的一种补充形式,在日常疾病的预防和治疗过程中占有举足轻重的地位。医疗机构制剂保证了在市场经济冲击下一些价廉效优的药品能够继续为人类健康服务,保障了一些有效期短的药品、医院老中医的协定处方、地方特色疾病需求药品等的供应。本文基于目前四川省医疗机构制剂的现状提出了一些可持续发展建议,但随着时间的发展会不断出现新问题和新变化,因此四川省医疗机构制剂的发展对策研究是一个漫长的过程,还需后来的学者继续跟进。
[1]沈文娟,张珂良,汪丽,等.对我国医疗机构制剂管理现状的思考[J].中国药事,2012,26(4):321.
[2]赵怀权,王雪,张芳.北京医疗机构制剂现状研究[J].中国医院药学杂志,2012,32(13):1 060.
[3]孙轶康,叶桦.上海市医疗机构制剂现状及发展趋势分析[J].上海医药,2012,31(8):357.
[4]王赛男,田侃.2008-2012年江苏省医疗机构制剂的现状分析[J].中国药房,2014,25(9):782.
[5]张芳,赵怀全.对医疗机构制剂再注册工作中相关问题的认识和探讨[J].中国药房,2012,23(42):3 860.
[6]袁丽霞,郭凡岭,冯华东.济宁市药品生产企业、医疗机构制剂室实验室药品检验现状调查[J].齐鲁药事,2009,28(8):456.
[7]谢正福,唐年忠.广东省医疗机构制剂申报资料存在问题讨论[J].今日药学,2013,32(7):464.
[8]四川省食品药品监督管理局.关于不予换发制剂批准文号的公示[S].2008-06-13.
[9]臧晓丽,陈静,高骥,等.北京军区医疗机构制剂室分类管理探讨[J].解放军药学学报,2009,25(2):186.

