新化合物结构蜕皮甾酮衍生物TAPA降糖作用与机制的初步研究
王晓琳,李宏伟,张 竞,谭正怀(.重庆植恩药业有限公司,重庆 400039;.四川省中医药科学院,成都
610042)
蜕皮甾酮是一类天然产物的统称,最初在昆虫体内发现,是一种具有蜕皮活性的物质,有促进细胞生长的作用。研究表明,蜕皮甾酮有多种药理学作用,如调节合成代谢、胃保护、抗氧化、抑制代谢综合征、保护心血管等[1]。相关研究表明,蜕皮甾酮具有胰岛素增敏活性,可通过肝细胞发挥非胰岛素依赖的降糖作用,但不能刺激胰岛素分泌[2];在胰岛素抵抗细胞模型中能提高胰岛素介导的葡萄糖摄取和利用能力,即增加胰岛素的敏感性,并能明显改善糖代谢[3]。后续研究还证实,蜕皮甾酮胰岛素增敏作用靶点涉及多种与胰岛素抵抗相关的蛋白和激酶[4]。
蜕皮甾酮虽然降糖效果明显,但其水溶性差,常温时几乎不溶于水,体内半衰期很短(仅40 min)。如果做成缓释片,其半衰期虽然能达到18 h,但其生物利用度仅为7.8%[5],不利于成药。因此,笔者以蜕皮甾酮为基础进行结构修饰,筛选得到了一个水溶性好、结构稳定的新化合物结构蜕皮甾酮衍生物(五元环磷酸内酯衍生物)TAPA。TAPA或其钠盐的水中溶解度较蜕皮甾酮分别提高了10倍和50倍,在2×10-7~2×10-9mol/L浓度范围内可使肝癌细胞HepG2的葡萄糖消耗量增加500%以上,活性较蜕皮甾酮提高30倍以上[6],这为其进一步开发奠定了基础。本文就TAPA对2型糖尿病模型大鼠的体内降糖作用进行研究,进一步评估其成药性,同时通过HepG2细胞模型考察TAPA对胰岛素敏感性和释放的影响,初步评估其作用机制。TAPA的化学结构式见图1。

图1 TAPA的化学结构式Fig 1 Chemical structure of TAPA
1 材料
1.1 仪器
7600型全自动生化分析仪(日本Hitachi公司);JPS-3+型手持式快速全血葡萄糖测试仪(北京怡成生物电子技术有限公司);全自动酶标读数仪(美国Biorad公司)。
1.2 药品与试剂
TAPA(白色粉末,重庆植恩药业有限公司自制,批号:100305,纯度:98.5%);罗格列酮钠片(太极集团重庆涪陵制药厂有限公司,批号:10070165,规格:每片4.0 mg);链脲佐菌素(STZ,美国Sigma公司);柠檬酸(成都科龙化工试剂厂,批号:20041102);柠檬酸钠(重庆东方试剂厂,批号:200309);甘油三酯(TG)试剂盒、总胆固醇(TC)试剂盒(北京北华康泰临床试剂有限公司,批号:006304、0709061);胆固醇(安徽天启化工科技有限公司出品,批号:20110106);猪胆酸钠(北京奥博星生物技术有限责任公司生产,批号:20081006);基因工程人胰岛素(美国Lilly公司);3H-d-葡萄糖(中国原子能研究院提供);格列齐特片(哈药集团制药总厂制剂厂,批号:20130115,规格:每片80 mg)。
1.3 动物
Wistar大鼠,SPF级,♀,体质量180~200 g,由四川省中医药科学院实验动物中心提供,合格证号:SCXK(川)2008-19。
1.4 细胞
HepG2细胞和胰岛β细胞瘤细胞系3(βTC3)细胞株均由重庆医科大学动物中心细胞培养室惠赠。
2 方法
2.1 TAPA对2型糖尿病模型大鼠的降糖作用
2.1.1 2型糖尿病模型大鼠的建立。取大鼠100只,随机分为正常对照组(n=10)和高脂组(n=90)。高脂组给予高脂饲料(含猪油15 g、胆固醇4 g、胆盐1 g、蛋黄粉5 g、基础饲料75 g)8周,正常对照组大鼠给予等量基础饲料。在给予高脂饲料28 d并禁食不禁水16 h后,测定其TG和TC,取血脂高于正常对照组平均值20%的大鼠用于建立2型糖尿病模型。将合格高脂大鼠在禁食不禁水24 h后腹腔注射给药STZ 25 mg/kg 1次,在注射后72 h测定其血糖浓度,随机血糖大于11 mmol/L的大鼠即为建模成功。
2.1.2 分组与给药。将建模成功的2型糖尿病模型大鼠随机分为5组,即模型组、TAPA-1组(1 mg/kg)、TAPA-5组(5 mg/kg)、TAPA-25组(25 mg/kg)以及罗格列酮组(2 mg/kg),每组10只,后4组即为给药组。给药组每日灌胃相应药物1次,连续4周。正常对照组和模型组大鼠灌胃等体积的蒸馏水。
2.1.3 检测指标。给药期间每周测定各组大鼠摄食量、体质量、饮水量以及随机血糖水平各1次。末次给药后1 h测定各组大鼠口服糖耐量,即禁食不禁水4 h后,灌胃葡萄糖2 g/kg,并分别于灌胃葡萄糖后0、0.5、1、2 h(前期研究表明2 h内血糖浓度已达峰值)剪尾采血,测定血糖浓度,计算其血糖-时间曲线下面积(AUC)。
2.2 TAPA对胰岛素敏感性的影响
2.2.1 HepG2细胞胰岛素抵抗模型的建立。采用高浓度胰岛素诱导培养法复制HepG2细胞的胰岛素抵抗模型[7]。将HepG2细胞悬液用含体积分数为2%小牛血清DMEM洗涤1次,然后按1×106个/孔接种于24孔培养板中,细胞贴壁后用不含小牛血清的DMEM培养液洗涤2次,加入1 ml新配制的含有或不含有5×10-7mol/L人胰岛素的培养液(不加胰岛素者为对照)于37 ℃、5%CO2培养箱中孵育16 h,用不含胰岛素的培养液洗涤1次,共20 min。在含5×10-7mol/L胰岛素培养液中孵育的HepG2细胞称为模型细胞,不含胰岛素培养液中孵育的称为对照细胞,测定两种细胞的胰岛素敏感性。
2.2.2 分组与给药。试验分为6组,即空白模型组、空白对照组、TAPA-M组(培养液含1×10-5mol/L TAPA的模型细胞组)、TAPA-C组(培养液含1×10-5mol/L TAPA的对照细胞组)和罗格列酮-M组(培养液含1×10-5mol/L罗格列酮的模型细胞组)、罗格列酮-C组(培养液含1×10-5mol/L罗格列酮的对照细胞组)。
2.2.3 检测指标。采用3H-d-葡萄糖掺入实验(检测细胞的葡萄糖掺入率)评价细胞的胰岛素敏感性[3]。在两种胰岛素浓度(分别为1×10-9mol/L和1×10-7mol/L)下,测定“2.2.2”项下各组细胞的葡萄糖掺入率。
具体操作步骤:取分别按“2.2.2”项下分组加入不含小牛血清的DMEM培养液(1 ml/孔),于37 ℃、5%CO2条件下预孵育0.5 h,加入3H-d-葡萄糖(1.3 μCi/ml)孵育2 h,加入冰冷的磷酸盐缓冲液快速洗涤细胞以终止反应。细胞用20%KOH 0.5 ml溶解后,转移至玻璃试管中,取出100 μl细胞溶解液,采用考马斯亮蓝法测定蛋白质浓度,冷乙醇溶液洗涤2次,室温下3 000 r/min(离心半径15 cm)离心5 min后弃去上清液,将沉淀物(糖原)倒置沉积在直径为2 cm的滤纸片上(反复冲洗),滤纸片用冷藏于4 ℃的冷乙醇搅拌洗涤4次,共3 h。将滤纸片烘干后置于10 ml闪烁液中测定放射性计数。根据3H-d-葡萄糖的比放射性、细胞融解液的蛋白质浓度及糖原的放射性,可计算出3H-d-葡萄糖的掺入率,单位为mmol·g(Pro)/h。公式为:葡萄糖的掺入率=糖原的放射性计数(cpm)/[3H-d-葡萄糖的比放射性(Bq/mmol)×细胞融解液的蛋白质浓度(g/L)×细胞融解液体积(ml)×温育时间(h)]。
2.3 胰岛素释放试验
2.3.1 分组与给药。试验分为给药组和空白对照组,给药组包括3个TAPA组与格列齐特组,即TAPA-Ⅰ组(1×10-10mol/L)、TAPA-Ⅱ组(1×10-8mol/L)、TAPA-Ⅲ组(1×10-6mol/L)、格列齐特组(1×10-5mol/L)。
2.3.2 检测指标。将βTC3细胞接种于24孔板,生长3 d待细胞50%融合后,按“2.3.1”项下分组换上相应的培养液,再孵育24 h,每孔取100 μl培液检测胰岛素含量。
2.4 数据处理
3 结果
3.1 降糖作用
3.1.1 建模结果。大鼠经高脂喂食及STZ处理后,部分动物死亡,少数在处理结束后随机血糖低于11 mmol/L,剩余53只大鼠随机血糖高于11 mmol/L,为2型糖尿病大鼠造模成功,供试验用。
3.1.2 各组大鼠摄食量、体质量和饮水量的变化。高脂喂养大鼠在STZ诱导后,其摄食量、体质量和饮水量与正常对照组比较差异无统计学意义(P>0.05)。给药组大鼠在给药4周后,体质量有所增加[给药前(263.1±17.7)g,给药28 d后(289.1±20.0)g],但给药组大鼠的摄食量、体质量和饮水量与模型组比较差异无统计学意义(P>0.05)。
3.1.3 各组大鼠血糖水平的变化。与正常对照组比较,模型组大鼠的血糖浓度明显升高,差异具有统计学意义(P<0.05)。与模型组比较,给药组大鼠给药4周后其血糖浓度均明显降低,差异具有统计学意义(P<0.05)。TAPA-25组大鼠在给药后,血糖浓度与罗格列酮组比较差异无统计学意义(P>0.05);且都在给药1周后,血糖浓度就明显下降,说明TAPA-25组降糖效果与罗格列酮组相当。TAPA-1组在给药4周后血糖浓度明显降低;TAPA-5组在给药3周后血糖浓度明显降低,并维持到给药4周后;而TAPA-25组在给药1周后血糖浓度就明显降低,并维持到给药4周后。4周后,TAPA各剂量组大鼠的血糖浓度间比较差异无统计学意义(P>0.05)。由此可见,TAPA的降糖效果与给药剂量和时间呈正相关,剂量越高,其降糖作用越快速。各组大鼠的血糖浓度比较见表1。
表1 各组大鼠的血糖浓度比较(,n=10)Tab 1 Comparison of blood glucose concentration of rats in each group(,n=10)
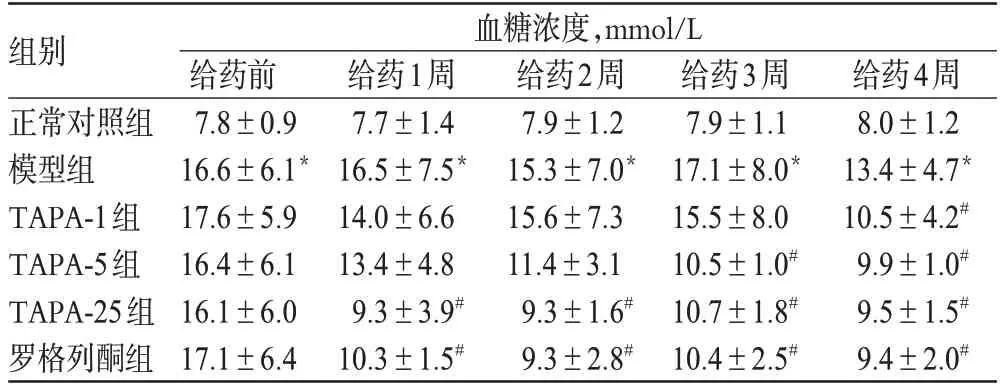
表1 各组大鼠的血糖浓度比较(,n=10)Tab 1 Comparison of blood glucose concentration of rats in each group(,n=10)
与正常对照组比较:*P<0.01;与模型组比较:#P<0.05vs.normal control group:*P<0.01;vs.model group:#P<0.05
3.1.4 各组大鼠糖耐量的变化。高脂大鼠在STZ诱导4周后,其糖耐量明显降低,模型组与正常对照组比较差异具有统计学意义(P<0.05);给药组大鼠的糖耐量均显著改善(P<0.05),给药组间差异无统计学意义P>0.05)。各组大鼠的糖耐量比较见表2。
表2 各组大鼠的糖耐量比较(,n=10)Tab 2 Comparison of glucose tolerance of rats in each group(,n=10)

表2 各组大鼠的糖耐量比较(,n=10)Tab 2 Comparison of glucose tolerance of rats in each group(,n=10)
与模型组比较:#P<0.05,##P<0.01vs.model group:#P<0.05,##P<0.01
3.2 TAPA对胰岛素敏感性的影响
胰岛素抵抗HepG2空白模型细胞组的葡萄糖掺入率在不同浓度胰岛素刺激下均低于空白对照细胞组(P<0.01),说明模型细胞产生胰岛素抵抗,建模成功;加入TAPA或罗格列酮的对照细胞组与未加入药物的对照细胞组葡萄糖掺入率无显著差异(P>0.05),说明TAPA与罗格列酮均无刺激胰岛素分泌作用,对正常对照细胞的葡萄糖掺入率无影响;而加入TAPA或罗格列酮的模型细胞组的葡萄糖掺入率较未加入药物的模型细胞组显著提高(P<0.01),加入TAPA与加入罗格列酮的模型细胞组的葡萄糖掺入率无显著差异(P>0.05),说明TAPA与罗格列酮均有胰岛素增敏作用,且二者作用强度相当。各组细胞的葡萄糖掺入率比较见表3。
3.3 TAPA对βTC3细胞胰岛素释放的影响
格列齐特为第二代磺脲类口服降糖药,主要通过刺激胰岛素分泌而发挥降糖作用。在葡萄糖浓度为11.1 mmol/L的条件下,与空白对照组比较,格列齐特有明显的刺激βTC3细胞分泌胰岛素的作用;1×10-10~1×10-6mol/L浓度范围内的TAPA对βTC3细胞的胰岛素释放无明显影响,与空白对照组无明显差异,说明TAPA无刺激胰岛素分泌作用。各组细胞的胰岛素释放量比较见表4。
表3 各组细胞的葡萄糖掺入率比较(,mmol·(gPro)/h,n=10)Tab 3 Comparison of incorporation amount of glucose in each group cell(,mmol·(gPro)/h,n=10)
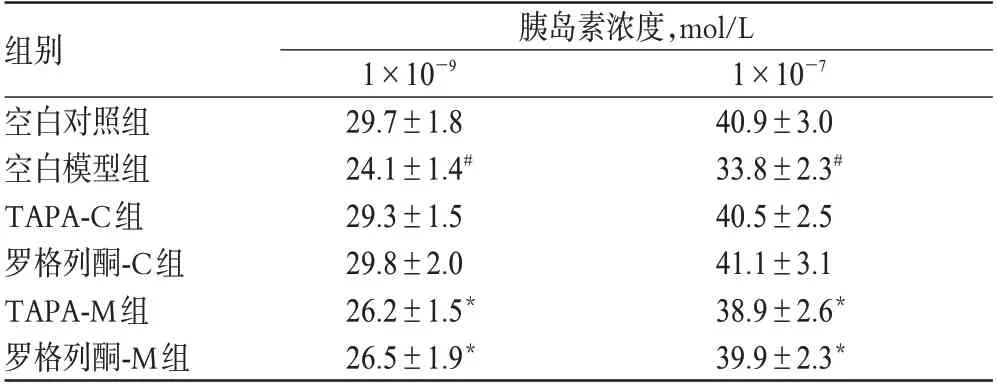
表3 各组细胞的葡萄糖掺入率比较(,mmol·(gPro)/h,n=10)Tab 3 Comparison of incorporation amount of glucose in each group cell(,mmol·(gPro)/h,n=10)
与对照细胞比较:*P<0.01;与模型细胞比较:#P<0.01vs.control cell:*P<0.01;vs.model cell:#P<0.01
表4 各组细胞的胰岛素释放量比较(,n=10)Tab 4 Comparison of insulin secretion in each group cell(,n=10)

表4 各组细胞的胰岛素释放量比较(,n=10)Tab 4 Comparison of insulin secretion in each group cell(,n=10)
与空白对照组比较:*P<0.01vs.blank control group:*P<0.01
4 讨论
胰岛素抵抗是2型糖尿病的重要病因和显著特征,因此也是近年来国际上针对代谢相关疾病的研究热点。胰岛素抵抗不但是2型糖尿病的重要病理基础,同时还与相关的并发症有密切关系,所以针对胰岛素抵抗的治疗成为治疗糖尿病的关键,并可起到“一石多鸟”之效:既可降低糖尿病患者的高血糖、保护胰岛β细胞免受损害、延缓2型糖尿病的进展,又可在改善大血管并发症的发生发展、降低其病死率方面起到积极作用[8]。针对胰岛素抵抗的治疗药物主要为胰岛素增敏剂,噻唑烷二酮类药是一类新型的并较为公认的胰岛素增敏剂,但该类药因安全性问题已大部分退市,目前临床上亟需开发更加安全、有效的胰岛素增敏剂。
笔者前期研究表明,蜕皮甾酮具有胰岛素增敏作用,且与噻唑烷二酮类药具有不同的作用机制。TAPA是在蜕皮甾酮的基础上进行结构修饰所得,因此首先考虑TAPA可能具有与蜕皮甾酮相同的作用效果与机制。为此,前期采用HepG2细胞检测了TAPA对葡萄糖消耗量的影响。本研究进一步从体内研究TAPA对2型糖尿病大鼠的血糖水平、糖耐量的影响,同时对TAPA的作用机制在细胞水平作了初步探讨。以上实验均以研究组前期对蜕皮甾酮的系列研究作为基础,且《化合物经口急性毒性分级标准》显示TAPA属于1~2级(无毒~实际无毒),以此确定的实验方案、检测指标以及给药剂量[9-10]。
本研究结果表明,给药4周,TAPA可降低2型糖尿病大鼠的血糖水平,其中TAPA-25组的降糖效果与2 mg/kg胰岛素增敏剂罗格列酮组相当,同时TAPA各剂量组以及罗格列酮组均能改善2型糖尿病模型大鼠的糖耐量,各给药组间结果相当。因此,初步体内试验证明,在蜕皮甾酮结构基础上修饰得到的TAPA能降低糖尿病关键指标——血糖浓度和升高糖耐量。其次,通过细胞水平的机制研究表明,TAPA可增加胰岛素抵抗模型HepG2细胞的葡萄糖消耗量[6]以及提高HepG2细胞的葡萄糖掺入率,并且在相同的药物浓度1×10-5mol/L条件下,效果与胰岛素增敏剂罗格列酮相当。同时,通过对βTC3细胞的胰岛素释放试验证明,在葡萄糖浓度为11.1 mmol/L的条件下,1×10-10~1×10-6mol/L浓度范围内的TAPA对βTC3细胞的胰岛素释放没有明显的影响,说明TAPA不具有刺激胰岛素分泌的作用。
综上,在蜕皮甾酮结构基础上修饰得到的TAPA可显著降低2型糖尿病模型大鼠的血糖浓度,升高糖耐量;经细胞水平研究证实,TAPA可提高胰岛素抵抗细胞模型HepG2细胞的葡萄糖消耗量及掺入率,但无促进胰岛素分泌作用。提示TAPA的降糖作用可能与原型蜕皮甾酮一致,与罗格列酮同属胰岛素增敏剂,通过改善胰岛素的敏感性达到体内降糖作用。后期亟需开展多模型动物实验,以进一步验证其体内的药效和安全性,并对其作用机制进行深入研究,以期将TAPA开发成具有全新作用机制、更加安全有效的胰岛素增敏剂。
[1]Cahlíková L,Macáková K,Chlebek J,et al.Ecdysterone and its activity on some degenerative diseases[J].Natural Product Communications,2011,6(5):707.
[2]Chen Q,Xia YP,Qiu ZY.Effect of ecdysterone on glucose metabolism in vitro[J].Life Sciences,2006,78(10):1 108.
[3]陈秋,夏永鹏,邱宗荫.蜕皮甾酮对胰岛素抵抗细胞模型胰岛素敏感性和糖代谢的影响[J].中国药理学通报,2006,22(4):460.
[4]宋敏,李耀军,赖国旗,等.蜕皮甾酮对胰岛素抵抗HepG2细胞的蛋白质组学研究[J].中国药理学通报,2009,25(12):1 640.
[5]王晓琳.新型的非噻唑烷二酮类胰岛素增敏剂TB的药理研究[D].重庆:重庆医科大学,2008:84-88.
[6]夏永鹏,王晓琳,秦勇,等.新的蜕皮甾酮合成衍生物及其制备方法和用途,中国:ZL201010168580.7[P].2010-05-07.
[7]陈秋,夏永鹏,邱宗荫.吡格列酮对胰岛素抵抗HepG2细胞模型的药理学评价[J].中国药理学通报,2006,22(2):248.
[8]Tadayyon M,Smith SA.Insulin sensitisation in the treatment of type 2 diabetes[J].Expert Opin Investig Drugs,2003,12(3):307.
[9]陈秋.蜕皮甾酮的胰岛素增敏作用及其机制的实验研究[D].重庆:重庆医科大学,2005:57-69.
[10]陈秋,夏永鹏,邱宗荫.蜕皮甾酮对HepG2细胞葡萄糖消耗的影响[J].中国药理学通报,2005,21(11):1 358.

