乌龙茶粗多酚、EGCG和EGCG3’Me体外抑制α-葡萄糖苷酶活性
费群勤,秦一禾,杨孟伽,钟 梁,胡 冰,孙 怡*,曾晓雄
(南京农业大学食品科技学院,江苏 南京 210095)
乌龙茶粗多酚、EGCG和EGCG3’Me体外抑制α-葡萄糖苷酶活性
费群勤,秦一禾,杨孟伽,钟 梁,胡 冰,孙 怡*,曾晓雄
(南京农业大学食品科技学院,江苏 南京 210095)
为研究乌龙茶粗多酚、表没食子儿茶素没食子酸酯((-)-epigallocatechin gallate,EGCG)、甲基化EGCG(epigallocatechin3-O-(3-O-methyl)gallate,EGCG3’Me)对α-葡萄糖苷酶活性的抑制作用,采用酶动力学和紫外吸收光谱方法,探究并比较了三者的抑制活性及类型。结果表明:乌龙茶粗多酚、EGCG和EGCG3’Me对α-葡萄糖苷酶均有较强的抑制作用,半抑制浓度(half inhibitory concentration,IC50)依次为0.178、0.040、0.064 mg/mL;Lineweaver-Burk双倒数作图显示乌龙茶粗多酚和EGCG的抑制类型为非竞争抑制,而EGCG3’Me为竞争性抑制;紫外吸收光谱实验表明乌龙茶多酚样品能够使α-葡萄糖苷酶的吸收光谱发生蓝移,推测酶蛋白的构象有所变化。EGCG与EGCG3’Me对α-葡萄糖苷酶活性的影响和抑制类型的不同可能是由于EGCG的一个羟基被甲氧基取代所引起的。
乌龙茶粗多酚;表没食子儿茶素没食子酸酯;甲基化表没食子儿茶素没食子酸酯;α-葡萄糖苷酶;紫外吸收光谱
茶多酚是茶叶的主要活性成分,主要包括表儿茶素((-)-epicatechin,EC)、表没食子儿茶素((-)-epigallocatechin,EGC)、表儿茶素没食子酸酯((-)-epicatechin gallate,ECG)和表没食子儿茶素没食子酸酯((-)-epigallocatechin gallate,EGCG)等,占茶叶干质量的20%~35%,具有降血脂、降血糖、抗氧化等多种生物功能[1-5],其中EGCG含量最高。在半发酵茶乌龙茶中还具有其他茶类少有的甲基化EGCG(epigallocatechin 3-O-(3-O-methyl)gallate,EGCG3’Me),结构式见图1,其酯溶性、稳定性以及吸收率较EGCG均有所提高[6]。
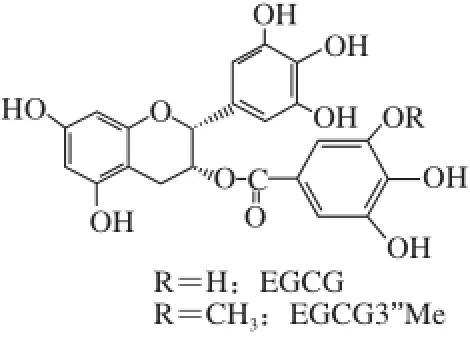
图1 EGCG和EGCG3’’Me的化学结构Fig.1 Structures of EGCG and EGCG3’Me
α-葡萄糖苷酶(EC 3.2.1.20)是一种存在于小肠绒毛黏膜细胞刷状缘的酶类,可以通过α-1,4糖苷键还原淀粉和其他多糖中的葡萄糖[7]。抑制α-葡萄糖苷酶的活性能够减缓葡萄糖的生成,从而降低餐后血糖峰值,有效预防糖尿病及其并发症[8]。近年来,多种α-葡萄糖苷酶抑制剂已被成功用于Ⅱ型糖尿病的治疗,如市售的阿卡波糖和米格列醇等[9]。但这些化学合成的抑制剂,常具有多种毒副作用,如造成病人腹泻、肠绞痛及肠紊乱等[10-11]。因此,从天然食源性材料中寻找高效的α-葡萄糖苷酶抑制剂具有重要的研究意义[12-14]。
研究表明,茶多酚能够有效抑制α-葡萄糖苷酶的活性,并可以减缓血糖的快速升高[15-18]。Yilmazer-Musa等[15]报道了绿茶、白茶及其单体EGCG等对α-葡萄糖苷酶具有显著的抑制作用;全吉淑等[17]研究表明绿茶提取物具有较强的α-葡萄糖苷酶抑制活性,同时动物实验发现茶多酚能够显著降低兔小肠刷状缘囊泡葡萄糖转运能力。乌龙茶中含有丰富的多酚类物质,但相关抑制α-葡萄糖苷酶作用的研究甚少,因此研究乌龙茶多酚及其单体对α-葡萄糖苷酶的抑制作用对α-葡萄糖苷酶抑制剂的开发具有重要实践意义。
前期本课题组建立了茶叶儿茶素包括EGCG3’Me的分离、纯化以及高效液相色谱(high performance liquid chromatography,HPLC)分析方法[19-21],并采用体外厌氧粪样混合培养与荧光原位杂交技术,评价了EGCG和EGCG3’’Me对肠道微生物菌群生长的影响[22]。本实验以乌龙茶为原料提取总多酚类物质,并分离纯化出EGCG和EGCG3’Me单体,进一步研究三者对α-葡萄糖苷酶的抑制活性及可能机制,为天然α-葡萄糖苷酶抑制剂的开发提供理论基础。
1 材料与方法
1.1 材料与试剂
乌龙茶 市售。
酵母、α-葡萄糖苷酶、4-硝基苯α-D-吡喃葡萄糖苷(4-nitrophenyl α-D-glucopyranoside,PNPG) 美国Sigma公司;EGCG、ECG、EGC、EC标品 日本Funakoshi公司;EGCG3’’Me标品 本实验室自制;阿卡波糖 拜耳医药保健有限公司;聚酰胺树脂 无锡临江化学试剂厂;Toyopearl HW-40S 日本Tosoh公司;其他化学试剂均为分析纯。
1.2 仪器与设备
BL-220H分析天平 日本Shimadzu公司;Synergy-2酶标仪 美国Biotek公司;Genius 3旋涡混匀器 德国IKA公司;Heidolph Laborota 4000真空旋转蒸发仪 德国Heidolph公司;真空冷冻干燥机 美国Labconco公司;Agilent 1100高效液相色谱仪 美国安捷伦公司;HH-4数显恒温水浴锅 江苏国华电器有限公司;HL-2B数显恒流泵、BS-100A自动部分收集器 上海沪西分析仪器厂。
1.3 方法
1.3.1 乌龙茶粗多酚的制备及EGCG、EGCG3’Me的分离纯化
称取适量的乌龙茶粉,以料液比1∶20(m/V)在96 ℃的热水中恒温振荡浸提40 min,室温条件下4 500×g离心15 min,取上清液[22],茶渣用同样方法再次浸提,合并上清液并浓缩、冻干,得到乌龙茶粗提物。将冻干样加水溶解后,过膜(0.45 μm),上样于聚酰胺层析柱(1.6 cm×30 cm)。先用超纯水洗脱2 BV以去除杂质,后用80%的乙醇洗脱2 BV,洗脱液浓缩、冻干,得到乌龙茶粗多酚。将乌龙茶粗多酚溶解适量,上样于Toyopearl HW-40S柱(5.0 cm×50 cm),然后用80%的乙醇洗脱收集(10 mL/管),HPLC检测其中儿茶素的组成,合并所需组分,浓缩、冻干,得到EGCG和EGCG3’’Me单体样品。
1.3.2 乌龙茶粗多酚含量测定及EGCG、EGCG3’Me纯度的检测
茶多酚含量采用Folin-Ciocalteu法测定[23-24],EGCG和EGCG3’’Me纯度采用HPLC外标法检测。色谱条件:TSKgel ODS-100Z色谱柱(4.6 mm×150 mm,5 μm);柱温40 ℃;检测波长280 nm;梯度洗脱(流动相A:CH3COOH,pH 2.5;流动相B:CH3OH);洗脱时间15 min,流动相A的比例由82%降至40%,流速1.0 mL/min;进样量20 μL。
1.3.3 α-葡萄糖苷酶活性测定
参照Li Ting等[25]的方法并稍作改进:用pH 6.8的0.1 mmol/L磷酸缓冲液(phosphate buffer saline,PBS)配制一系列不同浓度梯度的硝基酚溶液,测定其在405 nm波长处的吸光度,绘制产物标准曲线。然后用PBS缓冲溶液分别配制0.2 U/mL的α-葡萄糖苷酶和2.5 mmol/L PNPG溶液。在96 孔板中先加20 μL 0.2 U/mL的α-葡萄糖苷酶溶液,再加120 μL PBS混匀后,于37 ℃水浴15 min,然后加入30 μL 2.5 mmol/L PNPG溶液作为底物,混匀后于37 ℃反应15 min,加入80 μL的饱和 Na2CO3溶液终止反应,测定其在405 nm波长处的吸光度,代入标准曲线得出酶活力。α-葡萄糖苷酶活力单位定义为pH 6.8、37 ℃条件下每分钟释放1.0 μmol硝基酚为1 个活力单位(U)。
1.3.4 乌龙茶粗多酚、EGCG和EGCG3’Me对α-葡萄糖苷酶的抑制作用
在96 孔板中加入10 μL不同质量浓度的乌龙茶粗多酚、EGCG和EGCG3’’Me水溶液,按1.3.3节所述方法加入α-葡萄糖苷酶和底物溶液反应,测定酶活力。以PBS缓冲液为空白对照,相同浓度阿卡波糖为阳性对照,每组实验重复3 次,按公式(1)计算不同样品对α-葡萄糖苷酶的抑制率。
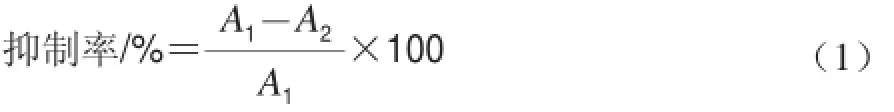
式中:A1、A2分别为空白对照和不同样品溶液在405 nm波长处的吸光度。
以样品质量浓度为横坐标,抑制率为纵坐标,绘制抑制曲线,通过线性拟合计算不同样品对α-葡萄糖苷酶的半抑制浓度(half inhibitory concentration,IC50)。
1.3.5 乌龙茶粗多酚、EGCG和EGCG3’Me对α-葡萄糖苷酶抑制类型的确定
选取各抑制剂质量浓度均为0.1 mg/mL,加入不同浓度(0.1、0.2、0.4、0.8、1.0 U/mL)的酶溶液,按1.3.4节方法进行反应,测定吸光度,确定反应速率。以酶浓度对反应速率作图,以确定抑制类型。
选取抑制剂质量浓度为0.1 mg/mL,酶浓度为0.5 U/mL,改变底物溶液的浓度(0.63、1.25、2.50、5.00、10.00 mmol/L),进行反应并测定吸光度,绘制Lineweave-Burk双倒数曲线图,确定其动力学特征及其最大反应速率(Vmax)、米氏亲和常数(Km)、解离常数(Ki)。对照组采用PBS替代抑制剂,每组实验重复3 次。
样品对α-葡萄糖苷酶的抑制常数通过公式(2)进行计算。

式中:[I]为抑制剂的质量浓度/(mg/mL);α通过公式(3)确定。

式中:Vmax为未加入抑制剂的最大反应速率/(mg/(mL·min));V*max为加入抑制剂的最大反应速率/(mg/(mL·min)),均可以通过上述酶抑制动力学测定获得。
1.3.6 紫外吸收光谱分析
乌龙茶粗多酚、EGCG和EGCG3’’Me对α-葡萄糖苷酶的紫外吸收光谱分析采用孟丽艳等[26]的方法并稍作修改。移取3.0 mL的不同质量浓度(0.06、0.13、0.25、0.50、1.00 mg/mL)的乌龙茶粗多酚、EGCG、EGCG3’’Me溶液、PBS溶液及0.5 U/mL的α-葡萄糖苷酶溶液于石英比色池中,测定其200~300 nm波长处的紫外吸收光谱。再在0.5 U/mL α-葡萄糖苷酶溶液中分别加入300 μL上述不同质量浓度的乌龙茶粗多酚、EGCG和EGCG3’’Me溶液,混匀,放置3 min后测定其200~300 nm波长范围内的吸收光谱。
1.4 统计分析
所得到的实验数据采用SPSS 16.0进行单因素方差分析,根据t检验确定其显着性差异(P<0.05)。
2 结果与分析
2.1 乌龙茶粗多酚的制备及EGCG、EGCG3’Me的分离纯化
采用聚酰胺层析柱对1.3.1节所得到的乌龙茶浸提物进行了初步纯化,得到多酚含量为83.92%的乌龙茶粗多酚,其HPLC色谱见图2B。乌龙茶粗多酚的主要成分为EGCG、EGCG3’Me、GCG、EC、ECG和CG,其中EGCG和EGCG3’Me含量占总多酚含量的27.58%和14.30%(表1)。通过Toyopearl HW-40S层析柱对乌龙茶粗多酚进一步分离,可得到EGCG、EGCG3’’Me单体组分,其HPLC色谱图分别见图2C和图2D,其纯度均高于95%。
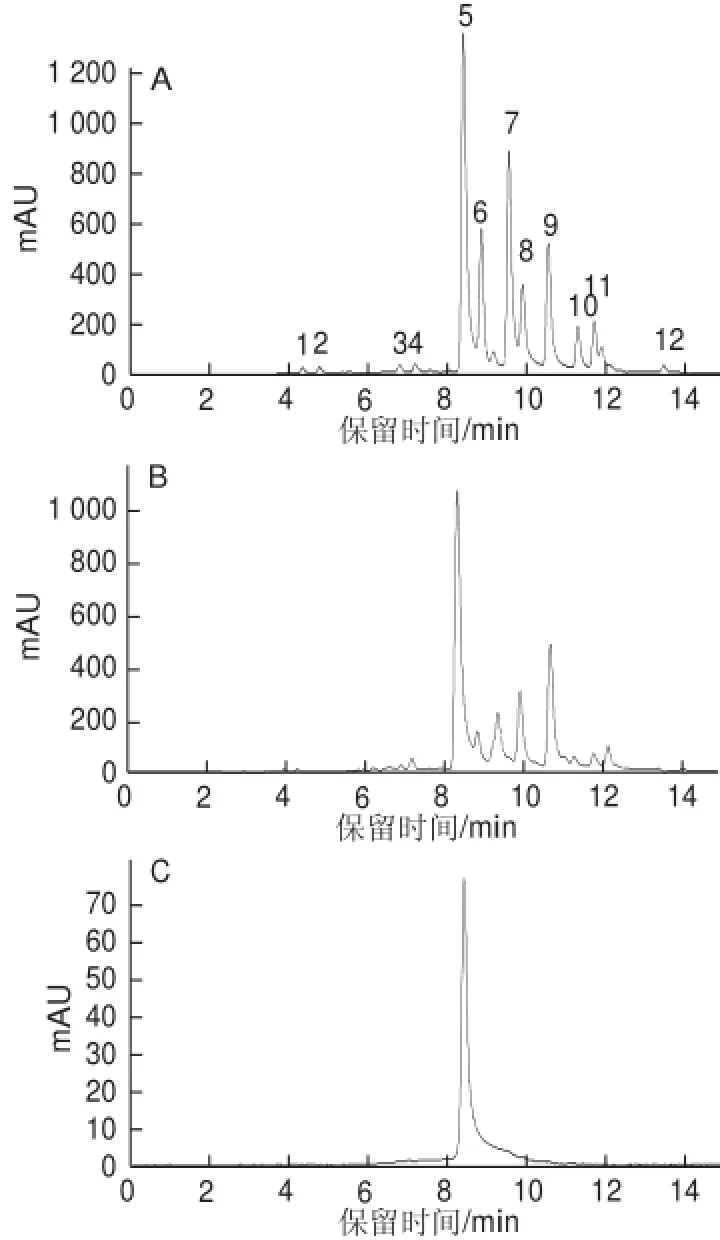
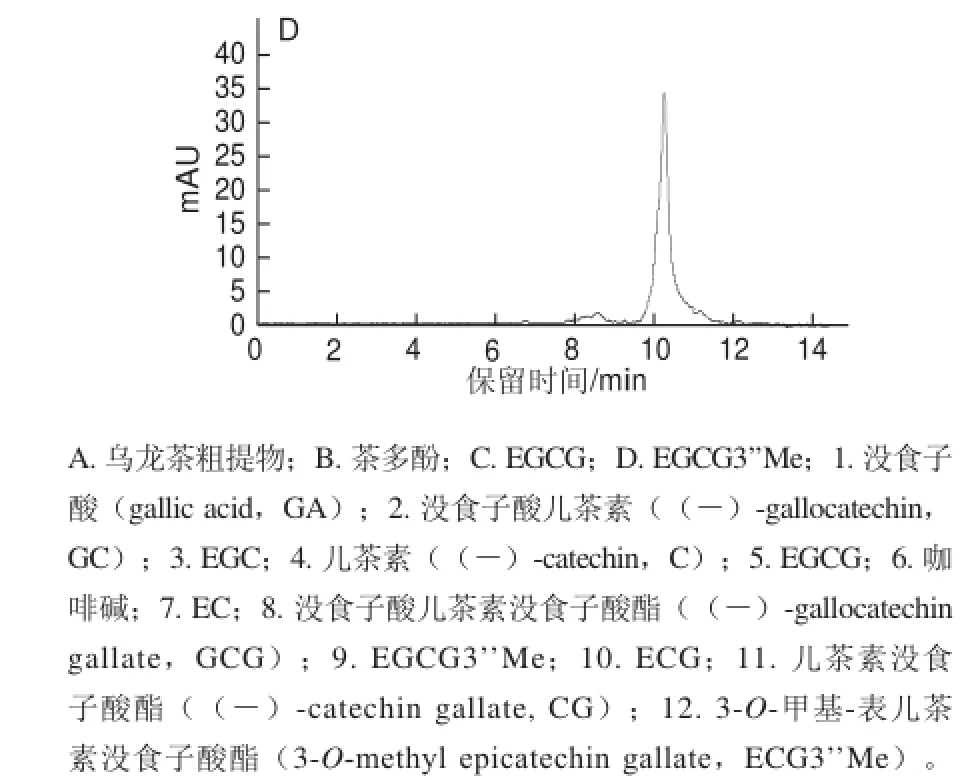
图2 乌龙茶粗多酚及其纯化组分的HPLCFig.2 HPLC chromatograms of crude extract of oolong tea and its purif i ed fractions
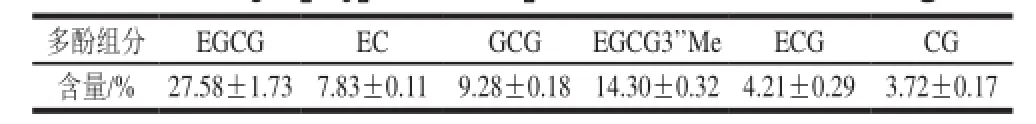
表1 乌龙茶茶多酚的儿茶素组成与含量Table1 Major polyphenols components and contents in oolong tea
2.2 乌龙茶粗多酚、EGCG和EGCG3’Me对α-葡萄糖苷酶的抑制作用
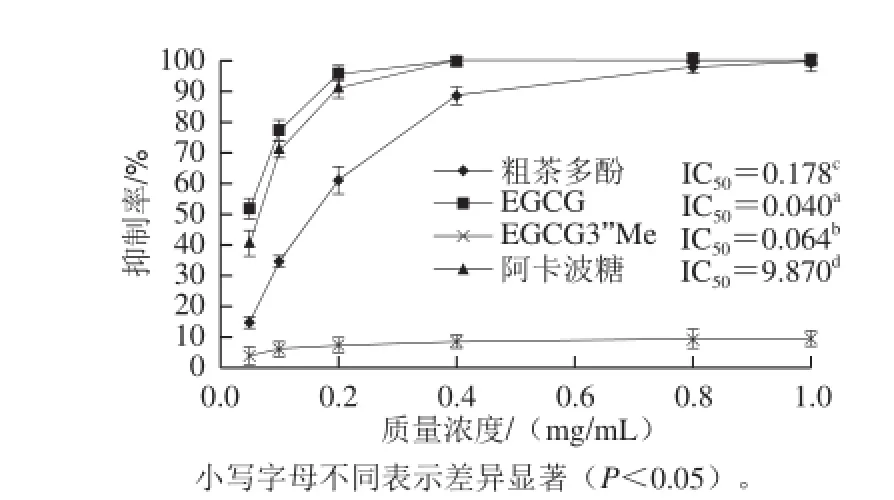
图3 乌龙茶茶多酚对α-葡萄糖苷酶的抑制效果Fig.3 Inhibitory effect of oolong tea polyphenols on α-glucosidase activity
IC50可表征样品对α-葡萄糖苷酶的抑制作用强弱,IC50越小,抑制作用越强。由图3可知,乌龙茶粗多酚、EGCG和EGCG3’Me的IC50均明显小于阿卡波糖,表明乌龙茶粗多酚、EGCG和EGCG3’Me对α-葡萄糖苷酶的抑制效果均强于市面所售的降血糖药品阿卡波糖。
乌龙茶粗多酚、EGCG和EGCG3’Me三者之间比较可以看出EGCG的抑制效果最好,EGCG3’Me其次,粗多酚效果最弱,表明EGCG与EGCG3’’Me是乌龙茶茶多酚中抑制α-葡萄糖苷酶活性的主要成分。此外,EGCG与EGCG3’’Me结构不同,两者产生的抑制效果也有所不同。EGCG的抑制效果优于EGCG3’’Me,这可能是由于EGCG的一个羟基(OH)被甲氧基(OCH3)取代所引起的[27-28]。
2.3 乌龙茶粗多酚、EGCG和EGCG3’’Me对α-葡萄糖苷酶的抑制类型
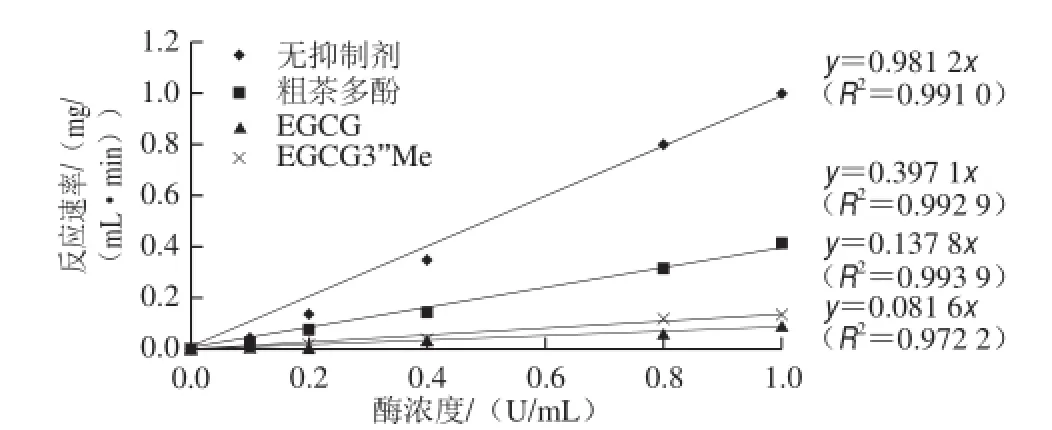
图4 乌龙茶粗多酚、EGCG、EGCG3’’Me对α-葡萄糖苷酶的抑制类型Fig.4 Inhibition types of oolong tea polyphenols, EGCG and EGCG3’’Me on α-glucosidase
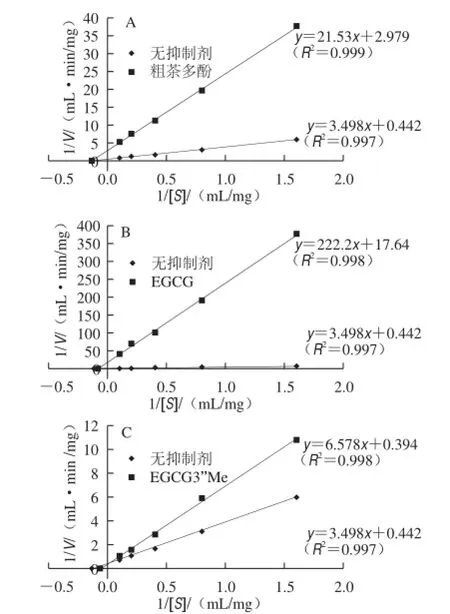
图5 乌龙茶粗多酚(A)、EGCG(B)、EGCG3’Me(C)对α-葡萄糖苷酶的可逆抑制类型Fig.5 Reversible inhibition types of oolong tea polyphenols (A), EGCG (B), and EGCG3’Me (C) on α-glucosidase
酶的抑制类型分为可逆和不可逆抑制。可逆抑制类型又可分为竞争性、非竞争性、反竞争性抑制类型。由图5可知,粗多酚和EGCG组与无抑制剂组都交于双倒数图像的x轴,可判断其抑制类型为非竞争性可逆抑制类型。而EGCG3’Me组与无抑制剂组交于y轴,说明为竞争性可逆抑制类型。通过公式计算得出各样品的Vmax、Km和Ki值,见表2。
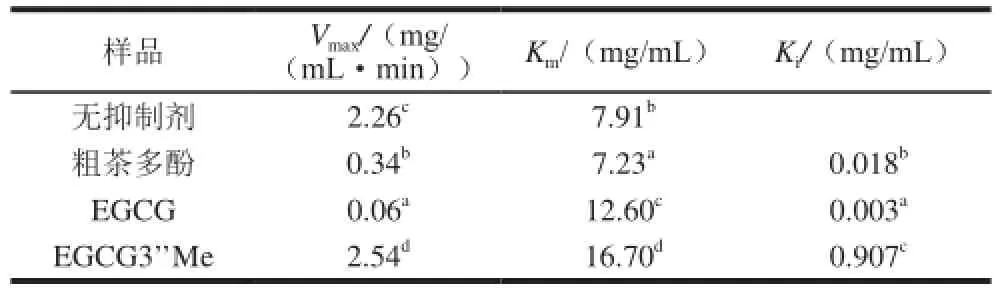
表2 粗多酚、EGCG、EGCG3’Me的动力学参数Table2 Kinetic parameters of oolong tea polyphenols, EGCG and EGCG3’Me
据文献报道,不同酚类对α-葡萄糖苷酶的抑制作用类型有所不同,如石榴皮多酚对α-葡萄糖苷酶抑制作用类型为反竞争性抑制[29],苹果多酚提取物对α-葡萄糖苷酶为非竞争性抑制类型[30]。这可能与其主要抑酶活性成分的组成和结构以及与酶活性中心的结合部位和结合方式等的不同有关。本实验中EGCG3’’Me与EGCG的抑制类型的不同可能由其甲基化基团导致。
2.4 乌龙茶粗多酚、EGCG和EGCG3’Me对α-葡萄糖苷酶紫外吸收光谱的影响
由图6可知,α-葡萄糖苷酶的最大吸收峰在280 nm波长处。随着抑制剂质量浓度的增加,α-葡萄糖苷酶的最大吸收波长略有减小,发生蓝移,说明氨基酸所处环境的疏水性增加。蛋白质波长的变化与所处的环境极性有关,可由波长的变化判断蛋白质构象的变化[31]。因此可推断波长蓝移是因为乌龙茶粗多酚、EGCG和EGCG3’Me样品与α-葡萄糖苷酶结合导致了酶构象的变化。
多酚类与酶等蛋白质类相互作用主要是通过氢键、疏水键等非共价键形成稳定的复合物。氢键是由多酚类的羟基与蛋白质以氢键形式多点结合[32-33],乌龙茶粗多酚、EGCG和EGCG3’Me可通过酚羟基与α-葡萄糖苷酶结合,从而改变酶的构象,但因为EGCG的甲基化而减少了一个酚羟基,从而削弱了甲基化EGCG的抑制效果,并改变了其抑制类型。
3 结 论
本研究从乌龙茶中分离制备了粗多酚及单体EGCG和EGCG3’’Me,并探究了其对α-葡萄糖苷酶的抑制作用。乌龙茶粗多酚、EGCG和EGCG3’Me的抑制效果明显强于市面所售α-葡萄糖苷酶抑制药物阿卡波糖,且抑制类型均为可逆抑制;EGCG和EGCG3’’Me的抑制效果明显强于粗茶多酚,表明在抑制过程中,茶多酚各儿茶素组分中EGCG和EGCG3’’Me两个单体发挥了主要作用;EGCG的一个羟基被甲氧基取代形成EGCG3’Me,导致它们的抑制效果和抑制类型均有所不同。茶多酚与酶的结合引起酶紫外吸收光谱的变化,形成比较稳定的复合物,有效地改变了酶的活性基团结构,造成疏水性、酶活性等功能的降低,从而有效地影响了酶的生物活性功能。本研究为探究乌龙茶多酚作为天然α-葡萄糖苷酶抑制剂的开发提供了理论基础。
[1] 李叶云, 江昌俊, 王秀丽. 茶多酚的生物活性及药理学研究进展[J].安徽中医学院学报, 2002, 21(5): 57-60.
[2] 毛清黎, 施兆鹏, 李玲, 等. 茶叶儿茶素保健及药理功能研究新进展[J].食品科学, 2007, 28(8): 584-588.
[3] KURODA Y, HARA Y. Antimutagenic and anticarcinogenic activity of tea polyphenols[J]. Mutation Research, 1999, 436(1): 69-97.
[4] YANG C S, MALIAKAL P, MENG X. Inhibition of carcinogenesis by tea[J]. Annual Review of Pharmacology and Toxicology, 2002, 42(1): 25-54.
[5] KRIS-ETHERTON P M, KEEN C L. Evidence that the antioxidant fl avonoids in tea and cocoa are benef i cial for cardiovascular health[J]. Current Opinion in Lipidology, 2002, 13(1): 41-49.
[6] 吕海鹏, 林智, 谭俊峰, 等. 茶叶中EGCG3”Me的研究与开发[J]. 食品工业科技, 2008, 29(12): 275-277.
[7] 寇彤, 孟晓敏, 常建涛, 等. 何首乌对α-葡萄糖苷酶活性的抑制作用[J].大连轻工业学院学报, 2006, 25(4) : 239-241.
[8] PULS W, KEUP U, KRAUSE H P, et al. Glucosidase inhibition:a new approach to the treatment of diabetes, obesity, and hyperlipoproteinaemia[J]. Naturwissenschaften, 1977, 64(10): 536-537.
[9] 丰田隆谦. α-葡萄糖苷酶抑制药[J]. 李曼, 译. 日本医学介绍, 1997, 18(8): 362-363.
[10] SCHMIDT D D, FROMMER W, JUNGE B, et al. α-Glucosidase inhibitors: new complex oligosaccharides of microbial origin[J]. Naturwissenschaften, 1977, 64(10): 535-536.
[11] FUJISAWA T, IKEGAMI H, INOUE K, et al. Effect of two α-glucosidase inhibitors, voglibose and acarbose, on postprandial hyperglycemia correlates with subjective abdominal symptoms[J]. Metabolism Clinical and Experimental, 2005, 54(3): 387-390.
[12] TUNDIS R, LOIZZO M R, MENICHINI F. Natural products as α-amylase and α-glucosidase inhibitors and their hypoglycaemic potential in the treatment of diabetes: an update[J]. Mini-Reviews in Medicinal Chemistry, 2010, 10(4): 315-331.
[13] MCDOUGALL G J, SHPIRO F, DOBSON P, et al. Different polyphenolic components of soft fruits inhibit α-amylase and α-glucosidase[J]. Journal of Agricultural and Food Chemistry, 2005, 53(7): 2760-2766.
[14] KWON Y I, APOSTOLIDIS E, SHETTY K. Inhibitory potential of wine and tea against α-amylase and α-glucosidase for management of hyperglycemia linked to type 2 diabetes[J]. Journal of Food Biochemistry, 2008, 32(1): 15-31.
[15] YILMAZER-MUSA M, GRIFFITH A M, MICHELS A J, et al. Grape seed and tea extracts and catechin 3-gallates are potent inhibitors of α-amylase and α-glucosidase activity[J]. Journal of Agricultural and Food Chemistry, 2012, 60(36): 8924-8929.
[16] 全吉淑, 尹学哲, 田中真实. 茶多酚降糖作用机制的研究[J]. 山东医药, 2006, 46(32): 32-33.
[17] 全吉淑, 尹学哲, 及川和志. 绿茶降糖作用机制的研究[J]. 食品科学, 2008, 29(1): 296-298.
[18] 张海凤, 董亚琳, 张琰. 没食子酸对α-葡萄糖苷酶的抑制作用及其降糖机制研究[J]. 药物研究, 2011, 20(21): 8-10.
[19] ZHANG Xin, XU Fei, GAO Yuan, et al. Optimising the extraction of tea polyphenols, (-)-epigallocatechin gallate and theanine from summer green tea by using response surface methodology[J]. International Journal of Food Science and Technology, 2012, 47(10): 2151-2157.
[20] HU Bin, WANG Lin, ZHOU Bei, et al. Eff i cient procedure for isolating methylated catechins from green tea and effective simultaneous analysis of ten catechins, three purine alkaloids, and gallic acid in tea by highperformance liquid chromatography with diode array detection[J]. Journal of Chromatography A, 2009, 1216(15): 3223-3231.
[21] 周蓓, 王琳, 李伟, 等. 茶叶中甲基化儿茶素的分离、纯化和高效液相色谱法分析[J]. 分析化学, 2008, 36(4): 494-498.
[22] 张鑫, 马丽苹, 张芸, 等. 茶叶儿茶素对肠道微生态的调节作用[J].食品科学, 2013, 34(5): 232-237.
[23] AINSWORTH E A, GILLESPIE K M. Estimation of total phenolic content and other oxidation substrates in plant tissues using Folin-Ciocalteu reagent[J]. Nature Protocols, 2007, 2(4): 875-877.
[24] 游见明, 曹新志. 福林酚法测定茶树中茶多酚的分布水平[J]. 湖北农业科学, 2013, 52(10): 2417-2419.
[25] LI Ting, ZHANG Xiaodong, SONG Yuwen, et al. A microplate-based screening method for alpha-glucosidase inhibitors[J]. 中国临床药理学与治疗学, 2005, 10(10): 1128-1134.
[26] 孟丽艳, 屈凌波, 杨冉, 等. 紫外吸收光谱和荧光光谱法研究大黄酚与牛血清白蛋白相互作用机制[J]. 理化检验: 化学分析, 2009, 45(10): 1169-1173.
[27] 崔文, 李勇, 张腾, 等. EGCG氧化聚合物的α-葡萄糖苷酶抑制活性研究[J]. 食品科技, 2013, 38(6): 258-261.
[28] DOU Q P. Molecular mechanisms of green tea polyphenols[J]. Nutrition and Cancer, 2009, 61(6): 827-835.
[29] 张海均, 贾冬英, 孙慧, 等. 石榴皮多酚提取物及纯化物对α-葡萄糖苷酶的抑制作用研究[J]. 天然产物研究与开发, 2012, 24(9): 1253-1256.
[30] 刘杰超, 焦中高, 王思新. 苹果多酚提取物对α-淀粉酶和α-葡萄糖苷酶的抑制作用[J]. 果树学报, 2011, 28(4): 553-557.
[31] 盛良全, 闫向阳, 徐华杰, 等. 烟碱与牛血清白蛋白相互作用的光谱研究[J]. 光谱学与光谱分析, 2007, 27(2): 306-308.
[32] HASLAM E, LILLEY T H, CAI Y, et al. Traditional herbal medicines: the role of polyphenols[J]. Planta Medica, 1989, 55(1): 1-8.
[33] HE Qiang, LÜ Yuanping, YAO Kai. Effects of tea polyphenols on the activities of α-amylase, pepsin, trypsin and lipase[J]. Food Chemistry, 2006, 101(3): 1178-1182.
in vitro Inhibitory Effects of Oolong Tea Polyphenols, EGCG and EGCG3”Me on α-Glucosidase Activity
FEI Qun-qin, QIN Yi-he, YANG Meng-jia, ZHONG Liang, HU Bing, SUN Yi*, ZENG Xiao-xiong
(College of Food Science and Technology, Nanjing Agricultural University, Nanjing 210095, China)
The inhibitory effects of oolong tea polyphenols, EGCG and EGCG3”Me on α-glucosidase were comparatively investigated by enzyme kinetics and UV absorption spectroscopy, and the possible mechanisms involved were explored. The results showed that oolong tea polyphenols, EGCG and EGCG3”Me all had inhibitory effects on the activity of α-glucosidase, and the half inhibitory concentration (IC50) values were 0.178, 0.040 and 0.064 mg/mL, respectively. The Lineweaver-Burk double reciprocal plot indicated that the inhibition type of oolong tea polyphenols and EGCG was non-competitive inhibition, whereas EGCG3”Me was competitive inhibition. Furthermore, oolong tea polyphenols could induce a blueshift in the UV absorption maximum of α-glucosidase, suggesting the possible change in enzyme conformation. The differences in inhibitory effects and inhibition types between EGCG and EGCG3”Me may be due to their structural difference (the hydroxyl group in EGCG substituted by methoxy group to form EGCG3”Me).
oolong tea polyphenols; (-)-epigallocatechin gallate (EGCG); epigallocatechin3-O-(3-O-methyl) gallate (EGCG3’Me); α-glucosidase; UV absorption
TS272;TS201.3
A
1002-6630(2014)21-0010-06
10.7506/spkx1002-6630-201421003
2014-06-04
国家自然科学基金面上项目(30871743);江苏省科技支撑计划项目(BE2013313);江苏高校优势学科建设工程资助项目
费群勤(1989—),女,硕士研究生,研究方向为食品生物技术。E-mail:2012108066@njau.edu.cn
*通信作者:孙怡(1966—),女,高级实验师,博士,研究方向为食品营养化学与功能性食品开发。E-mail:sunyi01@njau.edu.cn

