基于电子舌技术检测商业果汁中脂环酸芽孢杆菌
李二虎,冯佳洁,许 灿,潘思轶*
(环境食品学教育部重点实验室,华中农业大学食品科学技术学院,湖北 武汉 430070)
基于电子舌技术检测商业果汁中脂环酸芽孢杆菌
李二虎,冯佳洁,许 灿,潘思轶*
(环境食品学教育部重点实验室,华中农业大学食品科学技术学院,湖北 武汉 430070)
采用法国Alpha M.O.S.公司生产的α-Astree Ⅱ型电子舌对7 种市售果汁饮料及其接种脂环酸芽孢杆菌样品进行测定,所得数据应用主成分分析法进行辨别分析。2 种含乳类果汁饮料未能被区分开,其他5 种样品均可区分。将电子舌可区分的6 种果汁饮料接种两株脂环酸芽孢杆菌并在45 ℃条件下培养30 d,所有接种处理中均可检出脂环酸芽孢杆菌。3 种浑浊型饮料的检出量较多,大于103CFU/mL。3 种澄清型饮料的检出量较少,小于103CFU/mL。应用电子舌技术可将6 种接种脂环酸芽孢杆菌DSM 3922的果汁饮料与对照组区分开,4 种接种脂环酸芽孢杆菌XC-6的果汁饮料与对照组区分开,2 种接种脂环酸芽孢杆菌XC-6的混合果汁饮料和橙汁饮料同对照组未能被区分。
脂环酸芽孢杆菌;果汁饮料;电子舌;主成分分析
脂环酸芽孢杆菌(Alicyclobacillus sp.)是饮料加工中常见的非致病污染性微生物[1-2],由于该菌代谢不会明显改变饮料酸度且不产生气体,在饮料生产和销售环节很难被检测[3]。脂环酸芽孢杆菌生成芽孢,经过传统的巴氏杀菌很难完全灭活[4]。在苹果汁[5-6]、橙汁[7]、番茄汁[8]等各类果汁中都出现过污染脂环酸芽孢杆菌的报道。其代谢产物愈创木酚和卤酚等质量浓度超过21 μg/L就会使果汁产生类似药水的味道,严重影响果汁加工产品的质量[9-10]。
目前常用的果汁中脂环酸芽孢杆菌的检测方法有:平板分离法[11]、感官鉴评法[12]、仪器分析法[9,13]以及生物技术等相关方法[14-16]。普通平板分离法准确度低、耗时较长[17]。感官鉴评法必须通过专业培训的品尝人员对果汁样品进行气味和口感分析。感官鉴评法虽已被果汁生产企业广泛应用,但是其结果的准确度和可信度受到品尝员素质和各类环境的影响。仪器分析法主要有高效液相色谱(high performance liquid chromatography,HPLC)[6]、气相色谱-质谱(gas chromatography-mass spectrometry,GC-MS)联用、气相色谱-嗅觉(gas chromatography -olfactometry,GC-O)[9,18]测定、电子鼻技术[19]和分光光度计法[13]等分析方法。应用仪器检测脂环酸芽孢杆菌,不但对样品前处理方法和仪器的操作人员要求较高,而且需要确定不同菌株在不同果汁饮料中的特征性代谢产物。普通分光光度计法准确性较差,并且只能测定澄清果汁饮料中愈创木酚的含量。生物学技术的检测手段,主要应用聚合酶链式反应(polymerase chain reaction,PCR)技术,以及酶联免疫等方法可快速、准确检测果汁产品是否污染该菌[20],但是该类方法对硬件条件以及操作人员的技术水平要求较高,很难在果汁生产企业广泛推广。应用电子鼻技术检测果汁中脂环酸芽孢杆菌已有相关研究[21],但是关于电子舌技术检测商业果汁污染脂环酸芽孢杆菌任然处于起步阶段,相关研究未见发表。
电子舌技术主要由传感器阵列和模式识别系统组成,传感器检测可以对液体样品进行味觉感官评分,模式识别系统进行综合分析判别[22]。电子舌具有操作简便、果汁样品不需要进行前处理、对环境条件适应能力强等优点,且可得到样品的整体信息[23],也称作“指纹”数据。本实验使用法国Alpha MOS公司生产的α-Astree Ⅱ型电子舌,其传感器采用化学修饰场效应晶体管技术,每个传感器上覆有不同的分子膜,对不同滋味物质具有不同的吸附特性[24],以市售商业无菌果汁饮料为材料,采用电子舌技术对正常果汁样品和接种脂环酸芽孢杆菌果汁样品进行测定,通过主成分分析进行辨别分析,以期为电子舌技术快速检测商业果汁饮料中脂环酸芽孢杆菌污染提供理论依据和技术指导。
1 材料与方法
1.1 材料
1.1.1 果汁饮料
从超市选取包装完好、密封完整、无外漏、保质期内且配方中无防腐剂的7 种果汁饮料,详见表1。将各果汁饮料无菌分装于灭菌后的玻璃瓶中密封保存。

表1 样品列表Table 1 List of samples used in this study
1.1.2 菌株
选取两株脂环酸芽孢杆菌,一株为标准菌株Alicyclobacillus acidoterrestris DSM 3922,购自德国菌种保藏中心;一株为分离菌株XC-6,本实验室从玉米果汁饮料中分离得到,通过分子生物学鉴定为Alicyclobacillus sp.,NCBI登录号为KJ158157。
1.1.3 培养基
BAT培养基(g/L)[11,25]:CaCl2·2H2O 0.25、MgSO4·7H2O 0.50、(NH4)2SO40.20、KH2PO43.0、酵母膏2.0、葡萄糖5.0、琼脂15,痕量盐溶液1 mL(痕量盐溶液(g/L):CaCl2·2H2O 0.66、ZnSO4·7H2O 0.18、CuSO4·5H2O 0.16、MnSO4·H2O 0.15、CoCl2·5H2O 0.18、H3BO30.10、Na2MoO4·2H2O 0.30)、蒸馏水1 000 mL。加入1 L去离子水,用硫酸调节pH值至3.7,115 ℃高压灭菌30 min,冷却至50 ℃。
1.2 仪器与设备
α-Astree Ⅱ型电子舌(配有ZZ、BA、BB、CA、GA、HA、JB传感器和及αSOFTV 12.3数据处理系统),法国AlphaM.O.S.公司。电子舌7根传感器均为交叉传感器,每个传感器对酸、甜、苦、咸、鲜5类滋味物质都有不同的吸附特性,但对每种滋味物质检测的阈值不同(表2)。

表2 电子舌传感器对5 种滋味物质的检测阈值Table 2 The detection thresholds of 5 flavor components by E-tongue sensors mol/L
1.3 方法
1.3.1 菌种扩培与收集
将两株脂环酸芽孢杆菌菌株接种于250 mL BAT液体培养基中,在45 ℃、200 r/min摇床培养48 h。将培养48 h后的菌液以4 000 r/min无菌离心15 min,弃去上清液,再用无菌生理盐水冲洗菌体沉淀。将用无菌生理盐水冲洗后的菌悬液,再以4 000 r/min离心15 min,重复上次操作3 次,得到纯净不含异味的菌体。
1.3.2 微生物接种、计数
上述操作所获两株菌的菌悬液接种于不同商业果汁中,接种量为100 CFU/mL,对照组不接种任何菌株。接种组和对照组于80 ℃水浴处理30 min,冷却至45~65 ℃后,置于45 ℃培养箱中密封培养30 d。使用BAT平板计数法测定不同处理果汁中脂环酸芽孢杆菌的菌落总数。
1.3.3 电子舌检测方法
1.3.3.1 电子舌校准
校准程序:将传感器阵列在超纯水中清洗10 s,然后使用0.01 mol/L的盐酸作为校准液,在标准液中反应120 s,如此重复8 次。
1.3.3.2 电子舌诊断
诊断程序:传感器阵列在超纯水中清洗10 s,然后在0.01 mol/L的盐酸作为校准液反应120 s,在超纯水中清洗10 s,0.01 mol/L的NaCl校准液反应120 s,再次清洗10 s,最后在0.01 mol/L的谷氨酸钠校准液反应120 s,以上过程循环6 次。上述3 种标准溶液在主成分分析图中的贡献率必须达到99%以上,说明仪器传感器正常。
1.3.3.3 电子舌检测
分别量取80 mL实验样品,与超纯水交错摆放在自动检测盘上,使样品检测和清洗交错进行。电子舌传感器检测时间120 s,每1 s采集一次数据,清洗时间:10 s,数据类型:cleaning。按照该段程序测量2 次后,传感器响应强度趋于稳定,每样品重复检测8 次,选取后6 次的测量的数据进行主成分分析。
1.4 数据分析
本研究采用多元统计分析中的主成分分析法对电子舌采集的数据进行分析。主成分分析是将电子舌传感器多指标的信息进行数据转换和降维,并对降维后的特征向量进行线性分析,最后在PCA图上显示主要的两维图。应用SPSS 11.5统计软件对数据进行主成分分析,Origin 8.0软件画图。
2 结果与分析
2.1 电子舌对7 种商业果汁饮料的辨别分析
图1为7 种市售果汁饮料的主成分分析图,2、3、 4、5和6号样品之间能够很好地区分,分别聚类在PCA图中的不同区域。1和7号样品之间不能区分开来,在PCA图中两者基本重叠。由表1可知,样品1和7均为含乳类饮料,配方成分相似,因此选用1~6号样品进行后续实验。
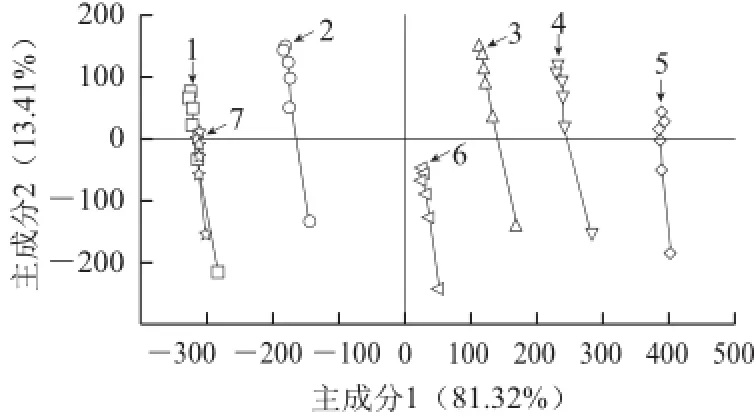
图1 电子舌对7 种商业果汁饮料样品辨别的主成分得分图Fig.1 Principal component analysis (PCA) plots of seven fruit juice beverage samples
2.2 接种处理后各果汁饮料中微生物筛选结果

表3 培养30 d后果汁饮料中脂环酸芽孢杆菌菌落总数Table 3 Total number of Alicyclobacillus sp. in fruit juice beverages after incubation for 30 days CFU/mL
对照组培养30 d后,1~6号果汁饮料在BAT平板上均无菌落检出(表3)。接种标准菌株和分离菌株培养30 d后,各样品在BAT平板上均有菌落生成,其中1、2号和6号浑浊型饮料有大量菌落检出,菌落总数超过103CFU/mL,3、4号和5号澄清型饮料中菌落总数小于103CFU/mL,特别是4号和5号样品中菌落总数小于初始接种量102CFU/mL。结合表1可知,1、2号和6号样品的pH值在3.5~4.5之间,为脂环酸芽孢杆菌生长的最适pH值[11,26]。
2.3 电子舌对接种处理果汁饮料的辨别分析
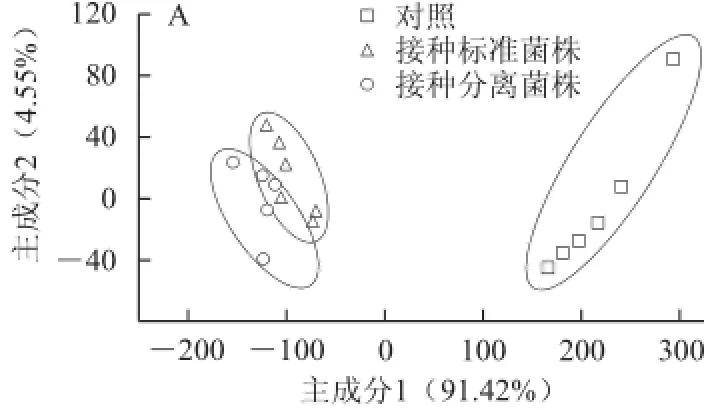

图2 电子舌对6 种接种果汁饮料样品的主成分分析图Fig.2 PCA plots of six fruit juice beverage samples inoculated with different Alicyclobacillus sp. isolates
由图2可知,2号和6号样品不同接种处理及对照聚类在PCA图中的不同区域,能够被很好地区分开来。样品1中,接种标准菌株和分离菌株处理之间不能很好地区分,但接种处理与对照之间能够很好地区分。3号样品中,3 种处理样品虽可聚类在PCA图中的不同区域,但标准菌株与对照之间的距离较近。样品4中,标准菌株与对照之间能够区分,但分离菌株与对照之间距离较近。5号样品中,两种接种菌株之间不能区分,但接种与对照处理之间可以区分开来。综上,除3和4号样品外,分离菌株与对照不能完全区分,其他样品中接种处理与对照之间均能够很好地区分开来。结合表3可知,1、2号和6号样品接种菌落总数均大于103CFU/mL,接种处理与对照能区分开,3、4号和5号样品中接种菌落总数均小于103CFU/mL,其中3号和4号样品接种分离菌株处理同对照组不能区分,但5号样品接种处理同对照组可以区分,可能与分离菌株在不同果汁饮料中的代谢产物有关,尚需进一步研究。

图3 电子舌对不同接种处理的果汁主成分分析图Fig.3 PCA plots of fruit juice beverage samples with different inoculums
将6 种果汁饮料按照对照、接种标准菌株及接种分离菌株3 组处理进行电子舌信号的主成分分析,其结果见图3。组Ⅰ为所有样品的对照处理以及3号和4号样品接种分离菌株处理;组Ⅱ为所有样品接种标准菌株处理以及1、5号和6号样品接种分离菌株处理;组Ⅲ为2号样品接种分离菌株处理。综上所述,除样品3和4外,采用电子舌技术可将接种脂环酸芽孢杆菌的果汁饮料同对照组区分开。
3 结 论
采用电子舌技术对7 种商业果汁饮料进行辨别分析,除2 种含乳类饮料配方相似外,其余产品均可被快速、准确区分。将电子舌可辨别的6 种样品分别接种两株脂环酸芽孢杆菌并培养30 d,所有接种处理在BAT平板上均有菌落检出,但不同饮料的检出量不同。3 种浑浊型饮料的pH值在3.5~4.5之间,接种脂环酸芽孢杆菌的生长量较多,超过103CFU/mL,3 种澄清型饮料的pH值小于3.5,接种脂环酸芽孢杆菌的检出量均小于103CFU/mL。通过电子舌测定及主成分分析可将接种脂环酸芽孢杆菌DSM 3922的6 种果汁饮料同对照组区分开,接种脂环酸芽孢杆菌XC-6的4 种果汁饮料同对照组区分开,接种XC-6的3号样品(混合果汁饮料)及4号样品(橙汁饮料)和对照组不能辨别。本研究探索电子舌技术在脂环酸芽孢杆菌污染检测中的应用,有关其应用机理尚需进一步研究。
参考文献:
[1] SMIT Y, CAMERON M, VENTER P, et al. Alicyclobacillus spoilage and isolation: a review[J]. Food Microbiology, 2011, 28(3): 331-349.
[2] 岳田利, 胡贻椿, 袁亚宏, 等. 脂环酸芽孢杆菌(Alicyclobacillus)分离鉴定研究进展[J]. 食品科学, 2008, 29(2): 487-492.
[3] 胡贻椿, 岳田利, 袁亚宏, 等. 果汁中脂环酸芽孢杆菌(Alicyclobacillus spp.)的危害及其控制[J]. 食品科学, 2008, 29(1): 364-368.
[4] LEE S Y, PARK S H, KANG D H. Inactivation of Alicyclobacillus acidoterrestris spores in apple and orange juice concentrates by gamma irradiation[J]. Journal of Food Protection, 2014, 77(2): 339-344.
[5] WANG J, HU X S, WANG Z F. Kinetics models for the inactivation of Alicyclobacillus acidiphilus DSM14558(T) and Alicyclobacillus acidoterrestris DSM 3922(T) in apple juice by ultrasound[J]. International Journal of Food Microbiology, 2010, 139(3): 177-181.
[6] BAHCECI K S, ACAR J. Determination of guaiacol produced by Alicyclobacillus acidoterrestris in apple juice by using HPLC and spectrophotometric methods, and mathematical modeling of guaiacol production[J]. European Food Research and Technology, 2007, 225(5/6): 873-878.
[7] SPINELLI A, SANT’ANA A S, RODRIGUES S, et al. Influence of different filling, cooling, and storage conditions on the growth of Alicyclobacillus acidoterrestris CRA7152 in orange juice[J]. Applied and Environmental Microbiology, 2009, 75(23): 7409-7416.
[8] BEVILACQUA A, CORBO M R. Characterization of a wild strain of Alicyclobacillus acidoterrestris: heat resistance and implications for tomato juice[J]. Journal of Food Science, 2011, 76(2): M130-M136.
[9] RUIZ PEREZ-CACHO P, DANYLUK M D, ROUSEFF R. GC-MS quantifi cation and sensory thresholds of guaiacol in orange juice and its correlation with Alicyclobacillus spp[J]. Food Chemistry, 2011, 129(1): 45-50.
[10] KINOUCHI T, KOMEDA T, NAKANISHI K, et al. Growth of Alicyclobacillus acidoterrestris in the hypoxic environment of bottled fruit juice[J]. Biocontrol Science, 2014, 19(2): 85-88.
[11] 袁亚宏, 刘晓珂, 岳田利, 等. 一株源于果园Alicyclobacillus的分离、鉴定及其生物学特性[J]. 食品科学, 2012, 33(17): 129-135.
[12] SCHROEDER M, POLLINGER-ZIERLER B, AICHERNIG N, et al. Enzymatic removal of off-flavors from apple juice[J]. Journal of Agricultural and Food Chemistry, 2008, 56(7): 2485-2489.
[13] 叶建芳, 李文俊, 赵文超, 等. 分光光度计法快速检测果汁中嗜热耐酸菌[J]. 食品科学, 2011, 32(14): 241-244.
[14] WANG Z L, CAI R, YUAN Y H, et al. An immunomagnetic separation-real-time PCR system for the detection of Alicyclobacillus acidoterrestris in fruit products[J]. International Journal of Food Microbiology, 2014, 175: 30-35.
[15] LI J K, HUANG R R, XIA K, et al. Double antibodies sandwich enzyme-linked immunosorbent assay for the detection of Alicyclobacillus acidoterrestris in apple juice concentrate[J]. Food Control, 2014, 40: 172-176.
[16] 陈世琼, 陈文峰, 胡小松, 等. 16S rDNA PCR-RFLP法快速鉴定分离自浓缩苹果汁生产线的脂环酸芽孢杆菌[J]. 中国食品学报, 2006, 6(2): 99-102.
[17] 朱小翠. 苹果汁中耐热菌的分离鉴定与PCR快速检测的研究[D]. 杨凌: 西北农林科技大学, 2008.
[18] GOCMEN D, ELSTON A, WILLIAMS T, et al. Identification of medicinal off-fl avours generated by Alicyclobacillus species in orange juice using GC-olfactometry and GC-MS[J]. Letters in Applied Microbiology, 2005, 40(3): 172-177.
[19] HARTY NI P, DALMADI I, KNORR D. Electronic nose investigation of Alicyclobacillus acidoterrestris inoculated apple and orange juice treated by high hydrostatic pressure[J]. Food Control, 2013, 32(1): 262-269.
[20] WANG Z, YUE T, YUAN Y, et al. Development of polyclonal antibody-based indirect enzyme-linked immunosorbent assay for the detection of Alicyclobacillus strains in apple juice[J]. Journal of Food Science, 2012, 77(11): M643-M649.
[21] CONCINA I, FALASCONI M, SBERVEGLIERI V. Electronic noses as flexible tools to assess food quality and safety: should we trust them?[J]. IEEE Sensors Journal, 2012, 12(11): 3232-3237.
[22] SODERSTROM C, RUDNITSKAYA A, LEGIN A, et al. Differentiation of four Aspergillus species and one Zygosaccharomyces with two electronic tongues based on different measurement techniques[J]. Journal of Biotechnology, 2005, 119(3): 300-308.
[23] SODERSTROM C, WINQUIST F, KRANTZ-RULCKER C. Recognition of six microbial species with an electronic tongue[J]. Sensors and Actuators B-Chemical, 2003, 89(3): 248-255.
[24] PEIN M, ECKERT C, PREIS M, et al. New protocol for alpha Astree electronic tongue enabling full performance qualifi cation according to ICH Q2[J]. Journal of Pharmaceutical and Biomedical Analysis, 2013, 83: 157-163.
[25] GROENEWALD W H, GOUWS P A, WITTHUHN R C. Isolation, identifi cation and typifi cation of Alicyclobacillus acidoterrestris and Alicyclobacillus acidocaldarius strains from orchard soil and the fruit processing environment in South Africa[J]. Food Microbiology, 2009, 26(1): 71-76.
[26] 许灿, 李二虎, 王鲁峰, 等. 酸土脂环酸芽孢杆菌对玉米果汁饮料挥发性成分及色度的影响[J]. 现代食品科技, 2014, 30(6): 268-275.
Detection of Alicyclobacillus sp. Spoilage of Commercial Fruit Juice Beverages by Electronic Tongue
LI Er-hu, FENG Jia-jie, XU Can, PAN Si-yi*
(Key Laboratory of Environment Correlative Dietology, Ministry of Education, College of Food Science and Technology, Huazhong Agricultural University, Wuhan 430070, China)
Commercial fruit juice beverages and their samples inoculated with Alicyclobacillus sp. isolates were discriminated by an α-Astree Ⅱ electronic tongue with principal component analysis. Except for two beverages mainly containing dairy components, other samples could be separated in different groups. Six beverages that could be discriminated by E-tongue were inoculated with two Alicyclobacillus sp. isolates and were incubated at 45 ℃ for 30 days. All inoculated samples were detected with colonies on Bacillus acidoterrestris plate, but number of colonies varied in different beverages. Three c loudy samples had a higher colony number over 103CFU/mL and three clear samples had a lower colony number below 103CFU/mL. All samples inoculated with Alicyclobacillus sp. DSM 3922 could be distinguished from control by E-tongue method. Excepted for mixed fruit juice and orange juice, other samples with Alicyclobacillus sp. XC-6 inoculation could be grouped from the control by E-tongue method.
Alicyclobacillus sp.; fruit juice beverage; electronic tongue; principal component analysis
TP212.2
A
1002-6630(2014)22-0141-05
10.7506/spkx1002-6630-201422026
2014-05-19
国家自然科学基金青年科学基金项目(31201414);中央高校基本科研业务费专项(2013PY098)
李二虎(1982—),男,讲师,博士,研究方向为食品生物技术。E-mail:erhuli@mail.hzau.edu.cn
*通信作者:潘思轶(1963—),男,教授,博士,研究方向为农产品加工。E-mail:pansiyi@mail.hzau.edu.cn

