S-8大孔吸附树脂富集紫胶色酸
陈智勇
(中国林业科学研究院资源昆虫研究所,国家林业局特色森林资源工程技术研究中心,云南 昆明 650224)
S-8大孔吸附树脂富集紫胶色酸
陈智勇
(中国林业科学研究院资源昆虫研究所,国家林业局特色森林资源工程技术研究中心,云南 昆明 650224)
以提取液中紫胶色酸的含量为指标,通过静态吸附-解吸和动态吸附-解吸紫胶色酸提取液,确定S-8大孔吸附树脂富集紫胶色酸的工艺参数。结果表明:S-8大孔吸附树脂对紫胶色酸有良好的吸附性能,静态吸附过程中S-8大孔吸附树脂在30 ℃条件下吸附4.5 h后达到对紫胶色酸的最佳饱和吸附,吸附液流速为2 mL/min时,S-8大孔吸附树脂达到动态饱和最佳吸附;解吸液为95%乙醇溶液、100 mL乙醇中加1.0 mL 2 mol/L的盐酸溶液、解吸液流速3 mL/min时色酸富集效果好,解吸率大于90%;经20 次重复吸附/解吸后对紫胶色酸的解吸率依然达到89.50%,树脂可多次重复使用;经大孔吸附树脂富集精制后的紫胶色酸含量由24.77%提高至62.92%,纯度提高了1.54 倍,富集后紫胶色酸的得率(以原胶质量计)达到0.52%,说明采用S-8大孔吸附树脂富集紫胶色酸是可行的。
紫胶色酸;大孔吸附树脂;富集
紫胶色酸是紫胶红色素中蒽醌类化合物的统称,是紫胶红色素中的有效显色物质[1-3]。紫胶色酸是一系列蒽醌衍生物的混合物,由于其多数衍生物均含有羧基,而呈现一定酸性[4-6]。目前已经发现的紫胶色酸有5 种,分别是紫胶色酸A、B、C、D、E,其基本结构极为类似,主要区别在于取代基的种类与位置不同[7-11]。由于紫胶色酸理化性质非常稳定,加之其天然、安全、无毒的优良特性,是食品、化妆品、医药及纺织品的优良着色剂[12-16],为我国允许用于食品添加剂的天然色素[17-18]。
紫胶色酸主要由紫胶虫体经水洗、沉降、结晶而得到,由于紫胶虫体中含有的糖、蛋白、灰分等杂质不可避免地进入到提取物中,因此需对其进行精制,以提高产品中紫胶色酸的含量[19-20]。然而,一直以来人们对紫胶色酸的提取技术关注较多,相关报道也较为常见[21-23],而对紫胶色酸的精制技术研究还不够细致,尤其高纯度紫胶色酸产品还很鲜见[24]。本研究以S-8大孔吸附树脂为填料,采用树脂吸附的方法将蒽醌类物质保留,实现紫胶色酸与杂质的有效分离,从而达到精制紫胶色酸的目的,为高纯度紫胶色酸产品的开发和制备提供参考方法和理论依据。
1 材料与方法
1.1 材料与试剂
紫胶原胶,由中国林业科学研究院资源昆虫研究所景东南亚热带实验站提供,为云南紫胶虫(K. yunnanensis Ou et Hong)原胶[25]。
S-8大孔吸附树脂 天津市海光化工有限公司;盐酸 天津市风船化学试剂厂;乙醇 天津市大茂化学试剂厂。
1.2 仪器与设备
CPC-505电导率仪 德国斯玛特公司;AB204-S精密型电子天平 Mettler Tole
do中国有限公司;DU-800型紫外-可见分光光度计 美国Beckman-Coulter公司;SHZ-82恒温振荡器 金坛市富华仪器有限公司;HHS-11-2型电热恒温水浴锅 江苏省医疗器械厂;SLEVA-2转盘离心机 德国Hermle Labortechnik公司;BCD-208K BS冰箱 青岛海尔股份有限公司。
1.3 方法
1.3.1 大孔吸附树脂的预处理
将S-8大孔吸附树脂以无水乙醇浸泡3~4 h,然后以无水乙醇洗涤树脂并放净洗涤液,重复洗涤多次,直至向洗涤液中加入3 倍体积水不显浑浊时停止。最后以去离子水淋洗树脂至无乙醇气味后离心脱水,并于冰箱中冷藏备用。
1.3.2 紫胶色酸原液制备
取原胶颗粒粉碎成1~6 mm颗粒后称质量,按照紫胶与去离子水比1∶5(g/mL)取样后,机械搅拌2 h,并以200 目细纱布过滤洗色液,重复提取6 次后,合并洗色液,以柠檬酸调整洗色液pH 3.5~4,搅拌澄清后采用滤膜过滤,取滤液备用。
1.3.3 S-8大孔吸附树脂的吸附实验
1.3.3.1 吸附温度对S-8大孔吸附树脂吸附能力的影响
精确称量1.00 g经1.3.1节中预处理的S-8大孔吸附树脂并置于100 mL三角瓶中,加入1.3.2节中制备的紫胶色酸原液50 mL,设置恒温振荡器温度分别为20、30、40、50 ℃后,每30 min取一次上清液测定其吸光度并计算其质量浓度,直至紫胶色酸质量浓度不再降低为止,并按照式(1)、(2)计算各温度条件下紫胶色酸的吸附量及吸附率随时间的变化。
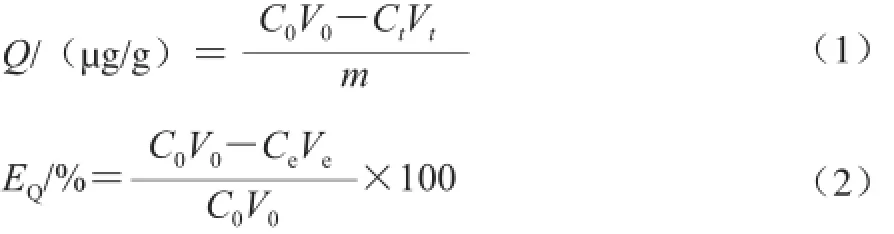
式中:Q为紫胶色酸在S-8大孔吸附树脂上的吸附量/(øg/g);EQ为紫胶色酸在S-8大孔吸附树脂上的吸附率/%; C0、Ct、Ce分别为吸附前、t时间和吸附后原液中紫胶色酸的质量浓度/(øg/mL);V0、Vt、Ve分别为吸附前、t时间和吸附后吸附液的体积/mL;m为S-8大孔吸 附树脂的质量/g。
1.3.3.2 吸附液流速对S-8大孔吸附树脂吸附能力的影响
精确称量5.00 g经1.3.1节中预处理的S-8大孔吸附树脂,采用湿法装柱。取1.3.2节中已预处理的紫胶色酸原液,分别在吸附液流速为1.0、2.0、3.0、4.0、5.0 mL/min条件下流过上述预装的吸附柱,每隔5 min取样并测定流出液的吸光度At,并计算流出液中紫胶色酸的质量浓度Ct。以Ct=1/10C0为始漏点,合并到达始漏点前的流出液,以流出液中紫胶色酸的质量浓度Ct和体积Vt,计算吸附量和吸附率。
1.3.4 S-8大孔吸附树脂的解吸实验
1.3.4.1 乙醇体积分数对S-8大孔吸附树脂解吸能力的影响精确称量1.00 g经1.3.1节中预处理的S-8大孔吸附树脂并置于100 mL三角瓶中,加入1.3.2节中制备的紫胶色酸原液50 mL,设置恒温振荡器温度为30 ℃恒温振荡6 h,以去离子水洗涤去除残余色素后吸干水分。配制体积分数分别为20%、40%、60%、80%和95%的乙醇溶液各50 mL,并以其解吸S-8大孔吸附树脂12 h;在每50 mL不同体积分数的乙醇溶液中各加0.5 mL 2mol/L的盐酸溶液,以提高解吸液对S-8大孔吸附树脂的解吸能力。测定其吸光度并计算其质量浓度,按式(3)、(4)计算解吸量和解吸率。
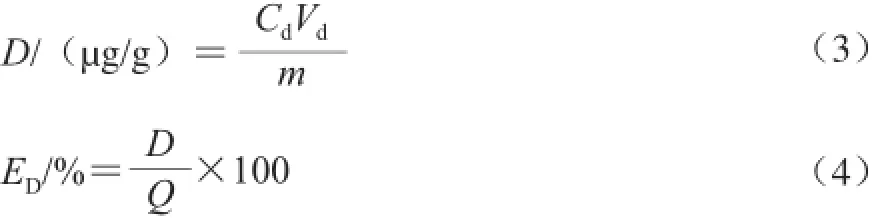
式中:D为紫胶色酸在S-8大孔吸附树脂上的解吸量/(øg/g);Cd为解吸液中紫胶色酸的质量浓度/(øg/mL);Vd为解吸液体积/mL;m为S-8大孔吸附树脂的质量/g;ED为紫胶色酸在S-8大孔吸附树脂上的解吸率/%;Q为紫胶色酸在S-8大孔吸附树脂上的吸附量/(øg/g)。
1.3.4.2 盐酸加入量对S-8大孔吸附树脂解吸能力的影响
精确称量1.00 g经1.3.1节中预处理的S-8大孔吸附树脂并置于100 mL三角瓶中,加入1.3.2节中制备的紫胶色酸原液50 mL,设置恒温振荡器温度为30 ℃恒温振荡6 h,以去离子水洗涤去除残余色素后吸干水分。量取1.3.4.1节中洗脱效果较好的乙醇溶液50 mL,加不同体积2 mol/L的盐酸溶液调酸,并以其解吸S-8大孔吸附树脂12 h。测定其吸光度并计算其质量浓度,计算不同盐酸加入量的乙醇溶液解吸量和解吸率。
1.3.4.3 解吸液流速对S-8大孔吸附树脂解吸能力的影响精确称量5.00 g经1.3.1节中预处理的S-8大孔吸附树脂,采用湿法装柱。按1.3.3.2节较佳流速动态吸附的条件上柱;采用1.3.4.1节及1.3.4.2节中较佳的洗脱液分别在1.0、1.5、2.0、2.5、3.0 mL/min流速条件下洗脱。每隔5 min测定流出液的吸光度At,并计算流出液中紫胶色酸的质量浓度Ct,以流出液的紫胶色酸质量浓度Ct为初始流出液吸光度的1/10时为终点,合并到达终点前所有流出液,测流出液中紫胶色酸的质量浓度Cd和体积Vd,计算解吸量和解吸率。
1.3.5 最佳条件下S-8大孔吸附树脂对紫胶色酸的富集效果
在1.3.3节及1.3.4节中确定的最佳吸附、解吸条件下,取紫胶色酸原液50 mL,按照文献[24]中方法测定其紫胶色酸含量T0后,以S-8大孔吸附树脂对紫胶色酸原液进行吸附和解吸实验,收集解吸液后测定解吸液的体积V1和解吸液的质量浓度C1,并计算紫胶色酸的含量T1,并以原胶质量m0为基准计算富集后紫胶色酸的得率Y1。

1.3.6 S-8大孔吸附树脂的动态重复性实验
精确称量5.00 g经1.3.1节中预处理的S-8大孔吸附树脂,采用湿法装柱。取1.3.2节中已预处理的紫胶色酸原液,在1.3.3.2节中较佳的流速条件下,进行动态吸附。待S-8大孔吸附树脂达到吸附饱和后,先以质量分数0.01% HCl溶液洗涤,目的是除去极性较强、水可以解吸的物质,再以乙醇溶液在上述得到的最佳解吸条件下解吸。分别收集上述动态吸附过程的解吸液及紫胶色酸原液,测定其吸光度At,并计算解吸液中紫胶色酸的质量浓度和解吸率。同一树脂柱重复上述操作20 次,考察S-8大孔吸附树脂的重复使用性能。
1.3.7 分析方法
按照文献[24]中提供的方法进行如下步骤的吸光度测试:以移液管精确移取吸附液/解吸液,将含有紫胶色酸的吸附液/解吸液置于水浴锅上蒸干,再按照文献[24]中以质量分数0.5%醋酸镁-甲醇溶液溶解显色,在540 nm波长条件下测定吸光度,并带入标准曲线计算测试样中的紫胶色酸质量浓度。
2 结果与分析
2.1 S-8大孔吸附树脂的吸附实验
2.1.1 吸附温度对S-8大孔吸附树脂吸附能力的影响
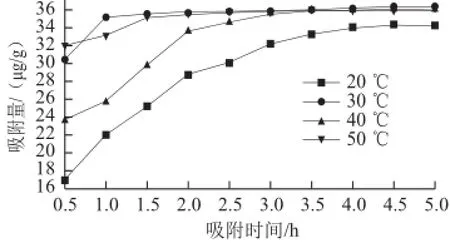
图1 不同温度条件下S-8大孔吸附树脂吸附量随时间的变化Fig.1 Adsorption quantity vs curves of S-8 at different temperatures
如图1所示,在不同温度条件下、5 h的吸附时间内,S-8大孔吸附树脂对紫胶色酸的吸附量呈增大的趋势,但就达到饱和吸附的速度而言,温度对S-8大孔吸附树脂有着较大的影响,温度为30 ℃时大孔吸附树脂的吸附量较高,且更快达到饱和吸附。
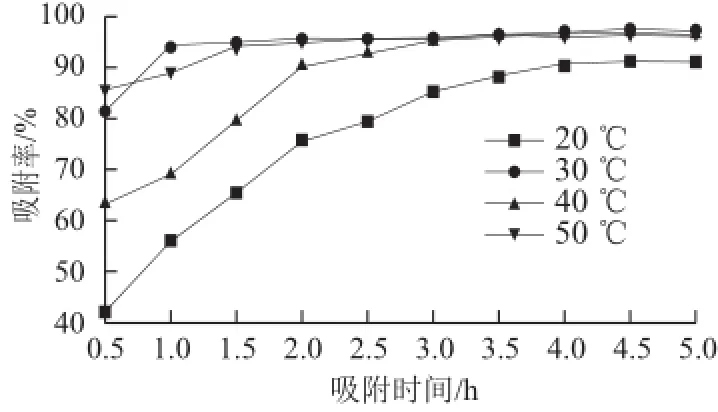
图2 不同温度条件下S-8大孔吸附树脂吸附率随时间的变化Fig.2 Adsorption rate vs time curves of S-8 at different temperatures
如图2所示,随吸附时间延长,S-8大孔吸附树脂对紫胶色酸吸附率增加;5 h内S-8大孔吸附树脂在30~50 ℃条件下逐渐趋于吸附饱和,吸附率均大于95%;而由吸附率曲线可见,S-8大孔吸附树脂在30 ℃条件下吸附率达到最大,趋于饱和后随着时间的延长吸附率基本维持稳定。综合图1与图2的结果可知,S-8大孔吸附树脂在30 ℃条件下吸附4.5 h后达到对紫胶色酸的最佳饱和吸附。
2.1.2 吸附液流速对S-8大孔吸附树脂吸附能力的影响
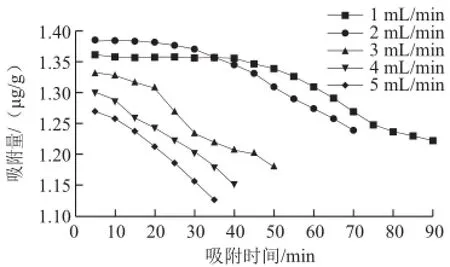
图3 吸附液流速对S-8大孔吸附树脂吸附量的影响Fig.3 Effect of flow rate of the sample solution on adsorption quantity onto S-8
如图3所示,随着吸附时间的延长,S-8大孔吸附树脂的吸附量逐次降低,总体来看,流速越快,曲线斜率越大,说明流速越快,吸附量降低的也就越快,这是因为吸附液流速越快时,单位时间内流过树脂的紫胶色酸也就越多,因而大孔树脂也就越容易达到饱和,但这并不意味着流速越大,树脂吸附效果越好,因为树脂的累积吸附量也是必须考虑的重要因素。
由图4可以看出,随着吸附液流速增加,S-8大孔吸附树脂对紫胶色酸的累积吸附量增加,但大孔吸附树脂的动态吸附过程不仅要考虑吸附量的大小,由于吸附率的高低决定了紫胶色酸原液的利用率和吸附效率,因此,吸附率的大小是动态吸附过程中吸附液流速考量的重要因素。各流速下,紫胶色酸吸附液的吸附量及吸附率如表1所示。
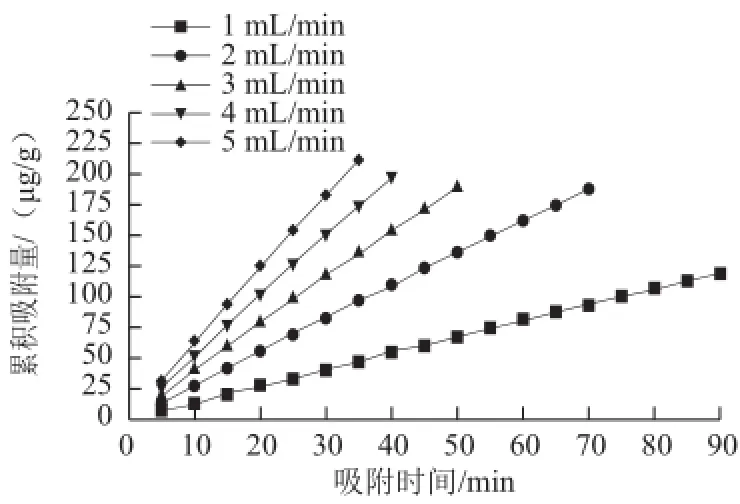
图4 吸附液流速对S-8大孔吸附树脂累积吸附量的影响Fig.4 Effect of flow rate of the sample solution on cumulative adsorption quantity onto S-8

表1 S-8大孔吸附树脂达到始漏点的吸附参数Table 1 Adsorption parameters of S-8 at the starting leakage point
由表1可知,当吸附液流速为2 mL/min时,S-8大孔吸附树脂对紫胶色酸的吸附率达到最高,而随着吸附原液流速继续增大,吸附率明显降低。此外,当动态吸附过程中流速过快时,由于吸附液与大孔吸附树脂表面接触的时间过短,原液中的溶质分子来不及扩散至树脂表面时就会发生树脂漏液现象,从而降低了树脂对原液的吸附效率。综上可见,吸附液流速为2 mL/min时,S-8大孔吸附树脂对紫胶色酸的吸附效率最佳。
2.2 S-8大孔吸附树脂的解吸实验
2.2.1 乙醇体积分数对S-8大孔吸附树脂解吸能力的影响
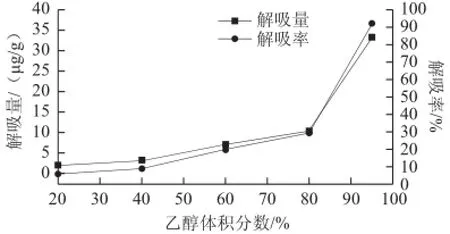
图5 不同体积分数的乙醇解吸液对S-8大孔吸附树脂解吸能力的影响Fig.5 Effect of ethanolconcentration on desorption rate
由图5可以看出,乙醇体积分数对S-8大孔吸附树脂的解吸影响显著,随着乙醇体积分数的增大,树脂解吸率由5.76%增加至92.36%。可见,增大解吸液中乙醇的体积分数有利于S-8大孔吸附树脂中紫胶色酸的高效解吸。
2.2.2 解吸液加酸量对S-8大孔吸附树脂解吸能力的影响
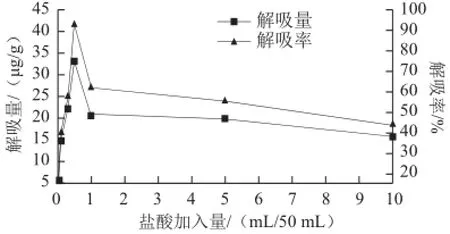
图6 加酸量对S-8大孔吸附树脂解吸能力的影响Fig.6 Effect of different amounts amount of hydrochloric acid added to aqueous ethanol on desorption capability of S-8
由图6可知,盐酸的加入明显改变乙醇溶液对S-8大孔吸附树脂的解吸能力。由图6可以看出,少量盐酸的加入即可达到较好的解吸效果,在每50 mL 95%乙醇盐酸用量为0.5 mL时,解吸能力达到最大,解吸率达到92.36%,而后随着盐酸浓度的持续增大,解吸率明显降低。可见,50 mL 95%乙醇中加入0.5 mL 2 mol/L的盐酸时,其解吸效果最好,解吸率最高。
2.2.3 解吸液流速对树脂解吸能力的影响
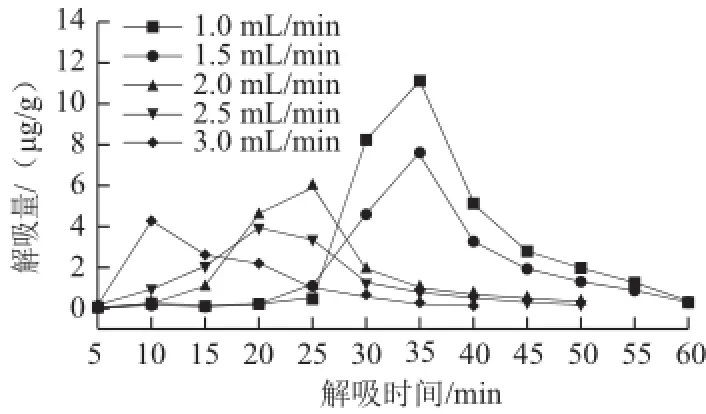
图7 解吸液流速对S-8大孔吸附树脂解吸量的影响Fig.7 Effect of flow rate of the desorption solution on desorption quantity of S-8
如图7所示,随着解吸液流速的增大,解吸曲线整体向左平移,即从S-8大孔吸附树脂上解吸相同量的紫胶色酸所用的时间越短,可见适当增大解吸液流速有利于缩短解吸时间,但解吸液流速并非越大越好,因为还必须得考虑解吸的效率,为方便计算解吸率,各流速条件下S-8大孔吸附树脂的累积解吸量曲线如图8所示。
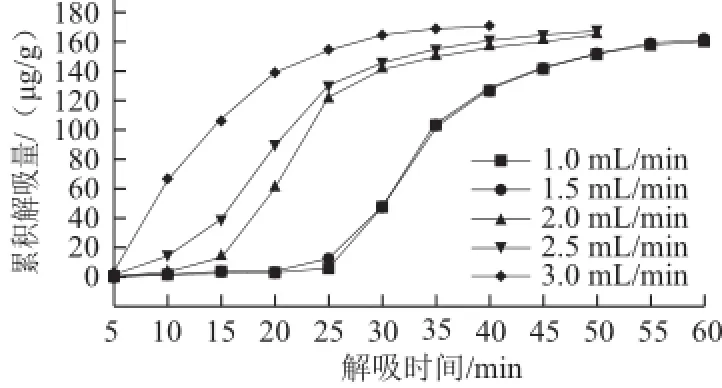
图8 解吸液流速对S-8大孔吸附树脂累积解吸量的影响Fig.8 Effect of flow rate of the desorption solution on cumulative desorption of S-8
由图8可以看出,随着解吸液流速的依次增大,S-8大孔吸附树脂的累积解吸量依次增加,且当解吸液流速越大时,达到相同累积解吸量所需解吸时间也就越短,可见增大解吸液流速有利于S-8大孔吸附树脂对紫胶色酸的解吸。各流速梯度下,S-8大孔吸附树脂的解吸效率如表2所示。
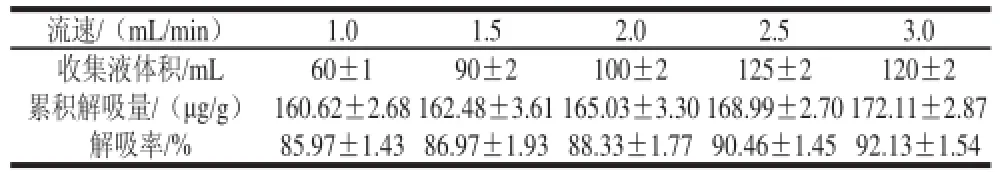
表2 S-8大孔吸附树脂达到解吸终点解吸参数Table 2 Adsorption parameters of S-8 macroporous resin at the end of desorption
由表2可知,当解吸液流速为3 mL/min时,S-8大孔吸附树脂对紫胶色酸的累积解吸量和解吸率达到最高,可将S-8大孔吸附树脂中吸附的90%以上紫胶色酸成分充分洗脱下来,而随解吸液流速减小,吸附量和吸附率均有所下降。
2.3 最佳吸附/解吸条件下S-8大孔吸附树脂对紫胶色酸的富集效果
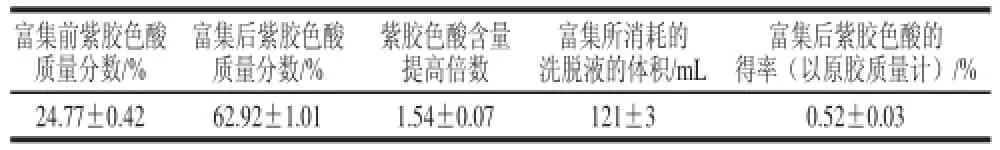
表3 S-8大孔吸附树脂对紫胶色酸的富集效果Table 3 Enrichment performance of laccaic acid by S-8
由表3可见,在上述所得的最佳吸附、解吸条件下,S-8大孔吸附树脂对紫胶色酸有较好的富集效果,紫胶色酸样品质量分数由富集前的24.77%提高至62.92%,提高1.54倍,富集后紫胶色酸的得率达到了0.52%。
2.4 动态吸附/解吸验证性实验
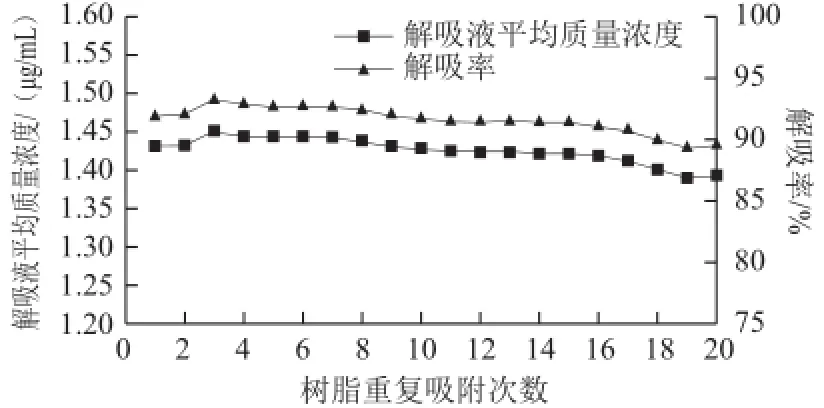
图6 S-8大孔吸附树脂的重复使用性能验证Fig.6 Reusability of S-8
由图6可见,S-8大孔吸附树脂重复吸附/解吸20 次,结果表明:以2.0 mL/min流速、140 mL紫胶色酸原液在30 ℃条件下吸附上柱,吸附时间4.5 h后达到动态饱和最佳吸附;然后用质量分数0.01% HCl溶液进行洗柱,再用浓度2 mol/L的盐酸,按照盐酸与95%乙醇 溶液体积比1∶100进行调和,120 mL调和液以3.0 mL/min流速解吸20次重复后,虽然解吸液中蒽醌平均质量浓度和解吸率有所下降,但变化幅度不大,经20 次重复吸附/解吸后对紫胶色酸的解吸率依然达到89.50%,表明S-8大孔吸附树脂重复使用性好。
3 结 论
S-8大孔吸附树脂对紫胶色酸有良好的吸附性能,静态吸附过程中S-8大孔吸附树脂在30 ℃条件下吸附4.5 h后达到对紫胶色酸的最佳饱和吸附;柱上动态吸附时,吸附液流速为2.0 mL/min,140 mL紫胶色酸原液在30 ℃条件下吸附上柱,吸附时间4.5 h后达到动态饱和最佳吸附。
S-8大孔吸附树脂的最佳解吸条件为解吸液95%乙醇溶液、100 mL乙醇中加1.0 mL 2 mol/L盐酸溶液、解吸液流速3 mL/min,此时色酸富集效果好,解吸率大于90%;经20 次重复吸附/解吸后对紫胶色酸的解吸率依然达到89.50%,树脂可多次重复使用。
经S-8大孔吸附树脂富集精制后的紫胶色酸含量由24.77%提高至62.92%,纯度提高了1.54倍,富集后紫胶色酸的得率(以原胶质量计)达到0.52%,说明采用S-8大孔吸附树脂富集紫胶色酸是可行的。
[1] 陈晓鸣, 陈又清, 张弘, 等. 紫胶虫培育与紫胶加工[M]. 北京: 中国林业出版社, 2008: 44-46.
[2] 郑华, 张弘, 张忠和. 天然动植物色素的特性及其提取技术情况[J].林业科学研究, 2003, 16(5): 628-635.
[3] 王祥荣, 侯学妮, 丁雷, 等. 紫胶红色素的稳定性[J]. 纺织学报, 2008, 29(8): 67-70.
[4] 卢艳民, 周梅村, 郑华, 等. 蒽醌类色素的特性和研究进展[J]. 林产化学与工业, 2007, 27(B10): 147-152.
[5] 张弘, 房桂干, 郑华, 等. 紫胶红色素稳定性研究[J]. 食品科学, 2009, 30(23): 65-69.
[6] 廖亚龙, 刘中华. 国内外紫胶深加工状况及研发趋势[J]. 食品工业科技, 2007, 28(8): 190-193.
[7] HIRATA K, UEMATSU Y, SUZUKI K, et al. Analysis of main pigments and other ingredients in lac color product[J]. Journal of the Food Hygienic Society of Japan, 2001, 42(2): 109-113.
[8] KATSUHIRO W, TAKATOSHI K, HIROMITSU A. Analytical and preparative separation of kaoliang and lac colors by pH-zone-refining CCC[J]. Journal of Liquid Chromatography and Related Technologies, 2005, 28(12/13): 2097-2106.
[9] OKA H, ITO Y, YAMASA S, et al. Identification of lac dye components by electrospray high performance liquid chromatographytandem mass spectrometry[J]. Journal of the Mass Spectrometry Society of Japan, 1998, 46(1): 63-68.
[10] 梅梅, 杨闻翰, 杜文霞. 果汁中天然色素紫胶红的UPLC-TUV定量检测及UPLC-MS-MS结构确证[J]. 分析测试学报, 2011, 30(12): 1338-1344.
[11] ITAKURA Y, UENO E, ITO Y, et al. Analysis of lac and cochineal colors in foods using reversed-phase thin-layer chromatography/ scanning densitometry[J]. Journal of Food Hygienic Society of Japan, 1999, 40: 183-188.
[12] 刘新民. 颇值得化妆品界开发利用的紫胶红色素[J]. 广西轻工业, 1994(4): 27-31.
[13] DIVYA R P, SINGH B, BABOO K M, et al. Evaluation of coloring efficacy of lac dye in comminuted meat product[J]. Journal of Food Science and Technology, 2011, 48(3): 378-381.
[14] DUBE D K, LOCH-CARUSO R, TROSKO J, et al. Assessment of the carcinogenic potential of a proposed food coloring additive, laccaic acid, using short term assays[J]. Cell Biology and Toxicology, 1984, 1(11): 111-125.
[15] HIRATA C, UEMATSU Y, SUZUKI K, et al. Analysis of lac color in diets and feces of rats for toxicity studies[J]. Journal of the Food Hygienic Society of Japan, 2002, 43(2): 110-113.
[16] CHIKKO S, NAOKO N, MASAYUKI T, et al. Inhibition of plasma hyaluronan-binding protein autoactivation by laccaic acid[J]. Bioscience, Biotechnology and Biochemistry, 2010, 74(11): 2320-2322.
[17] 凌关庭. 食品添加剂手册[M]. 3版. 北京: 化学工业出版社, 2003: 988. [18] 廖亚龙, 刘中华. 国内外紫胶深加工状况及研发趋势[J]. 食品工业科技, 2006, 27(8): 190-195.
[19] 张弘, 房桂干, 郑华, 等. 大孔吸附树脂精制紫胶红色素的研究[J].食品科学, 2010, 31(22): 232-236.
[20] 陈亿远, 刘佳铭, 庄全火, 等. 紫胶红色素提取及其废液治理的研究[J].齐齐哈尔轻工业学院学报, 1993, 9(2): 11-17.
[21] 刘跃明, 卢贵忠. 天然紫胶紫胶色素的特性及提取技术研究进展[J].云南农业大学学报, 2005, 20(1): 120-123.
[22] 郑君秀. 紫胶红色素提取工艺条件的优选[J]. 福州师专学报: 自然科学版, 1996, 16(1): 38-42.
[23] 曹铭, 周梅村, 唐莉英, 等. 紫胶色素提取方法的研究[J]. 食品科技, 2005, 30(2): 45-47.
[24] ZHANG Hong, FANG Guigan, ZHENG Hua, et al. Determination of anthraquinone content in lac dye through combined spectrophotometry and HPCE[J]. Procedia Engineering, 2011, 18: 86-94.
[25] 欧炳荣, 洪广基. 云南紫胶蚧新种记述[J]. 昆虫分类学报, 1990, 7(1): 16-17.
Enrichment of Laccaic Acid by S-8 Macroporous Resin
CHEN Zhi-yong
(Research Center of Engineering and Technology on Forest Resources with Characteristics, State Forestry Administration, Research Institute of Resources Insects, Chinese Academy of Forestry, Kunming 650224, China)
The conditions for static and dynamic adsorption and desorption by S-8 macroporous resin for enri ching laccaic acid were investigated by measuring the laccaic acid concentration in crude extract and eluates. The results showed that adsorption capability of S-8 macroporous resin was favorable to laccaic acid. In the static adsorption process, the resin exhibited maximum saturated adsorption at 30 ℃ after 4.5 hours. When the fl ow rate of the sample solution was 2 mL/min the dynamic adsorption achieved the maximum saturation level. The best enrichment results (more than 90% desorption rate) were obtained when the adsorbed laccaic acid was desorbed using 100 mL of 95% aqueous ethanol with 1.0 mL of 2 mol/L hydrochloric acid at a flow rate of 3 mL/min. The desorption rate remained as high as 89.50% after twentieth repeated use, suggesting good reusability of the sorbent. After the enrichment process, the purity of laccaic acid was increased from 24.77% to 62.92% with a purification factor of 2.54, and the yield of laccaic acid from lac was 0.52%. This study demonstrates the applicability of S-8 macroporous resin for enriching laccaic acid.
laccaic acid; macroporous adsorbent resin; enrichment
TQ028.3;TS264.4;S759.7;S899.2
A
1002-6630(2014)22-0017-05
10.7506/spkx1002-6630-201422004
2014-07-14
国家高技术研究发展计划(863计划)项目(2014AA021801)
陈智勇(1967—),男,高级工程师,博士,主要从事林业生物资源开发工程研究。E-mail:zychen@263.net

